重组人粒细胞集落刺激因子治疗IVF-ET不明原因反复种植失败患者的效果研究
2020-04-29魏蕊霞于晓惠刘荣娜
刘 珊,魏蕊霞,于晓惠,从 幸,刘荣娜,杨 波
尽管体外受精-胚胎移植(in vitro fertilization and embryo transfer, IVF-ET)技术使很多不孕患者获得子代,但是仍然有约10%的患者经历着反复种植失败。因此,不明原因反复种植失败(unexplained repeated implantation failure, uRIF)是目前急需解决的一大难题[1]。uRIF是指≥3次胚胎移植中至少有一个优质胚胎或多次胚胎移植累计移植胚胎数超过10枚仍未获得临床妊娠,而未发现任何影响胚胎移植的全身因素和子宫局部因素[2-3]。尽管反复移植失败病因复杂多样,但是生殖专家一直在努力寻找其病因及解决办法,如宫腹腔镜检查除外子宫内外环境、胚胎移植时间调整、应用各种药物改善子宫内膜容受性等,而疗效并不显著[4-5]。人粒细胞集落刺激因子(granulocyte colony stimulating factor, G-CSF)是一种正向调节粒系细胞分化的细胞因子,可一定程度促使其分化、增殖,还可调节Th1/Th2平衡[6-7]。事实上,G-CSF还可作用于人体内的多种成熟细胞,参与其正常生理功能的发挥。研究发现,G-CSF在人妊娠过程中具有非常重要的作用,它参与了人卵泡、胎盘及子宫内膜的生长发育,是胚胎着床过程中非常重要的一种细胞因子[8-9]。故本研究拟对uRIF患者胚胎移植前及移植后第3、5日分别皮下注射重组人粒细胞集落刺激因子(recombinant human granulocyte colony stimulating factor, rh G-CSF),旨在观察rh G-CSF对uRIF患者疗效。
1 对象与方法
1.1 对象及分组 本研究选择2018年1月—2019年4月因输卵管因素或男方因素在我院生殖医学科行IVF-ET的uRIF患者120例。纳入标准:①取卵年龄≤38岁;②既往经历3个移植周期,每周期均移植1~2个优质胚胎未获妊娠者,此次为第四次冻融胚胎移植(frozen embryo transfer, FET);③至少剩余2个胚胎(卵裂期或囊胚期胚胎)冻存,其中有≥1个优质胚胎。排除标准:①既往子宫内膜厚度≤8 mm,伴子宫内膜息肉、宫腔积液、输卵管积水者;②有内分泌及代谢紊乱、血栓形成倾向或抗磷脂综合征者;③剩余胚胎<2个。所有患者根据药物治疗方法的不同均分为观察组和对照组。两组取卵年龄、不孕年限、体质量指数及移植日子宫内膜厚度等比较差异均无统计学意义(P>0.05),具有可比性。见表1。本研究获医院伦理委员会批准同意。

表1 不同药物治疗的体外受精-胚胎移植不明原因反复种植失败两组基本情况比较
注:观察组为予重组人粒细胞集落刺激因子联合常规黄体支持治疗的体外受精-胚胎移植不明原因反复种植失败患者组,对照组为仅予常规黄体支持治疗的体外受精-胚胎移植不明原因反复种植失败患者组
1.2 治疗方法 月经规律患者选择自然排卵周期行FET,从月经第10日开始监测卵泡和内膜,当卵泡直径≥18 mm或内源性促黄体生成素(LH)>20 mU/ml时,应用人β绒毛膜促性腺激素(β-HCG)6000 U诱导排卵,并行内膜转换,排卵后第3日或第5日行FET。月经周期紊乱者行激素替代周期或促排卵周期FET,激素替代周期FET者从月经来潮第3日起予戊酸雌二醇片(广州拜耳医药保健有限公司生产,国药准字:J20130009)每次1 mg、每日2次口服,每4日增加戊酸雌二醇片2 mg直至最大剂量12 mg/d,待子宫内膜厚度≥8 mm时予内膜转化,同时检测血雌激素(E2)和孕酮(P)水平,内膜转化后第3日或第5日予FET;促排卵周期FET者从月经来潮第3日起予来曲唑(江苏恒瑞医药股份有限公司生产,国药准字:H19991001)2.5 mg/d口服,连用5 d,后联合或不联合应用人绝经期促性腺激素(丽珠集团丽珠制药厂生产,国药准字:H10940097)75~150 U/d和(或)戊酸雌二醇片2~4 mg/d,超声监测卵泡大小和子宫内膜厚度,当卵泡直径≥18 mm或内源性LH>20 mU/ml时,应用β-HCG 6000 U诱导排卵,并行内膜转换,排卵后第3日或第5日行FET。
对照组在FET期间仅行常规黄体支持,排卵周期黄体支持方案为黄体酮软胶囊[博赏医药咨询(上海)有限公司生产,注册证号:H20160265] 阴道给药,每次200 mg、每日1次,联合地屈孕酮片[雅培贸易(上海)有限公司生产,注册证号:H20170221]口服,每次20 mg、每日2次;激素替代周期黄体支持方案为黄体酮软胶囊阴道给药,每次200 mg、每日2次,联合地屈孕酮片口服,每次20 mg、每日2次。移植后12~14 d查血β-HCG,阴性者停药,阳性者继续用药至移植后8~10周。观察组在对照组治疗基础上加用rh G-CSF治疗,胚胎移植前1 h皮下注射rh G-CSF(华北制药金坦生物技术股份有限公司生产,国药准字:S19991017)300 U,胚胎移植后第3、5日分别皮下注射rh G-CSF 150 U。
1.3 观察指标 观察两组此次FET的生化妊娠率、临床妊娠率、胚胎种植率、流产率,以及不良反应和预后。生化妊娠率=生化妊娠周期数/移植周期总数×100%,临床妊娠率=临床妊娠总数/移植周期总数×100%,胚胎种植率=着床胚胎总数/胚胎移植总数×100%,流产率=流产的周期总数/临床妊娠周期总数×100%。移植后第12日或第14日血β-HCG>25 mU/ml为生化妊娠,移植后4周超声下看到孕囊为临床妊娠。

2 结果
2.1 两组子宫内膜准备过程中E2、LH及P水平比较 内膜准备过程中自然周期、促排卵周期两组排卵日E2、LH及P水平和人工周期内膜转化日E2及P水平比较差异均无统计学意义(P>0.05),见表2。

表2 不同药物治疗的体外受精-胚胎移植不明原因反复种植失败两组内膜准备过程中E2、LH及P比较
注:观察组为予重组人粒细胞集落刺激因子联合常规黄体支持治疗的体外受精-胚胎移植不明原因反复种植失败患者组,对照组为仅予常规黄体支持治疗的体外受精-胚胎移植不明原因反复种植失败患者组;LH为促黄体生成素、E2为雌激素、P为孕酮,且自然周期和促排卵周期均为排卵日数据,人工周期为内膜转化日数据;自然周期观察组28例、对照组30例,促排卵周期观察组12例、对照组14例,人工周期观察组20例、对照组16例
2.2 两组移植胚胎情况比较 两组此次移植胚胎类别、移植胚胎数及优质胚胎数比较差异均无统计学意义(P>0.05),见表3。
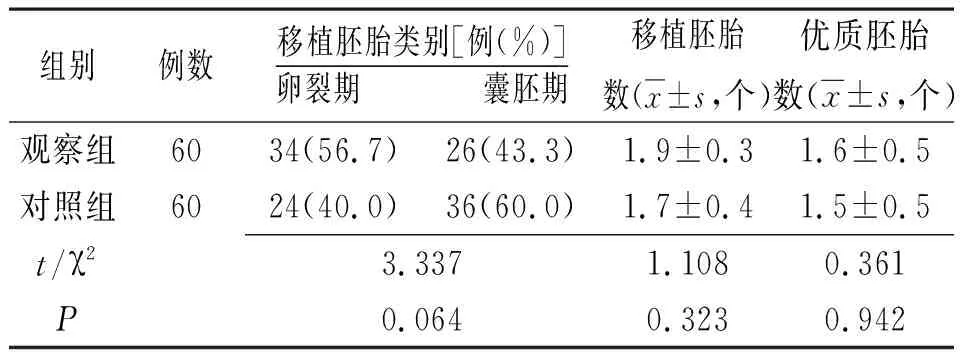
表3 不同药物治疗的体外受精-胚胎移植不明原因反复种植失败两组移植胚胎情况比较
注:观察组为予重组人粒细胞集落刺激因子联合常规黄体支持治疗的体外受精-胚胎移植不明原因反复种植失败患者组,对照组为仅予常规黄体支持治疗的体外受精-胚胎移植不明原因反复种植失败患者组
2.3 两组临床结局比较 观察组生化妊娠率和临床妊娠率均高于对照组,差异均有统计学意义(P<0.05或P<0.01)。见表4。观察组胚胎种植率为39.7%(46/116)高于对照组胚胎种植率26.9%(28/104),差异有统计学意义(χ2=3.982,P=0.048),但观察组和对照组流产率分别为14.7%(5/34)、20.0%(4/20),比较差异无统计学意义(χ2=0.247,P=0.633)。

表4 不同药物治疗的体外受精-胚胎移植不明原因反复种植失败两组临床结局比较[例(%)]
注:观察组为予重组人粒细胞集落刺激因子联合常规黄体支持治疗的体外受精-胚胎移植不明原因反复种植失败患者组,对照组为仅予常规黄体支持治疗的体外受精-胚胎移植不明原因反复种植失败患者组
2.4 不良反应及预后 观察组仅2例出现轻微发热(<38℃),第2日自行缓解,无其他不良反应。对照组中3例移植后成功妊娠,但孕近2个月时胚胎停育,行清宫术,胚胎绒毛染色体无异常;1例胚胎移植后输卵管妊娠,腹腔下切除患者输卵管。观察组中4例移植后成功妊娠,孕近2个月时胚胎停育,行清宫术,胚胎绒毛染色体无异常;1例自然流产,未行清宫术。
3 讨论
胚胎植入是一个成功的半同种移植,其成功有赖于发育潜能高的胚胎、良好的子宫内膜及母体对胚胎的免疫耐受[10]。胚胎来源的滋养层细胞向母体子宫内膜的迁移、浸润是正常胚胎植入及胎盘形成的关键环节[11]。由于G-CSF受体主要存在于胎盘组织和滋养层细胞,因此推测G-CSF可能具有调节滋养层细胞植入和维持早期妊娠的作用[12-13]。子宫内膜中的T细胞主要分布于功能层,包含丰富的T细胞亚群。CD4+ T细胞激活后按分泌细胞因子谱分为Th1型和Th2型两个功能亚群。大量研究表明,Th1型细胞介导的免疫应答不利于妊娠,而Th2型细胞介导的免疫应答有利于妊娠[14-15]。体内外实验证实,G-CSF不断重复刺激能维持G-CSF受体在CD4+ T细胞上的表达量[16],这可能是G-CSF对T细胞免疫调节的重要机制。G-CSF抑制T细胞的异种反应性,使T细胞处于免疫低反应状态。G-CSF可以诱导T细胞的应答不足并促进T细胞由Th1型向Th2型分化[17-18]。因此,子宫内膜局部的免疫异常可能是导致uRIF的原因。
反复种植失败病因非常复杂,涉及范围较为广泛,主要包括配子或胚胎质量及其发育潜能、子宫内膜容受性和局部免疫状态等多个方面。对于uRIF患者而言,虽然治疗方法多种多样,如各种药物及子宫内膜轻微搔刮术改善内膜容受性和淋巴细胞主动免疫治疗调节母体免疫等,但是疗效并不显著[19]。2009年Scarpellini和 Sbracia[20]首次提出对患有复发性流产(recurrent spontaneous abortion, RSA)的夫妇孕前应用rh G-CSF直到孕19周,治疗组的妊娠率和活产率显著高于对照组,且新生儿未发现明显的畸形。2013年,Gleicher等[21]对体外受精且有RSA史患者应用G-CSF获得较好的妊娠结局。
本研究内膜准备过程中两组E2、LH及P水平无明显差异,移植日子宫内膜厚度差异亦无统计学意义;观察组较对照组明显提高了生化妊娠率、临床妊娠率和胚胎种植率。两组移植胚胎数目及优质胚胎数均无差异,推测可能是母胎界面免疫细胞因子调节,促进滋养层细胞增殖和侵袭,改善了子宫内膜局部免疫所致。已有研究证实,G-CSF可刺激自然移植物的细胞滋养细胞增殖并抑制其凋亡,在G-CSF的作用下滋养细胞伪足增多、变长,侵袭能力增强[22]。故G-CSF对母胎界面具有双向调节作用,一方面对免疫细胞具有一定抑制作用,另一方面对滋养细胞生物学功能具有很好的促进作用[23]。
G-CSF经静脉或皮下注射后主要分布在肾脏、骨髓和血浆中,以氨基酸代谢途径被降解,并主要由尿排泄。本药在肿瘤领域中应用已近20年,尚未出现明显不良反应和致畸报道。Scarpellini和Sbracia[20]对35例RSA患者在妊娠前及妊娠期间皮下应用G-CSF达9周,并未发现严重不良反应和胎儿先天性异常。目前研究表明,在安全剂量范围内应用G-CSF不影响母体健康及胎儿健康;无论哪种给药方法, 用药48 h后检测尿中药物浓度及血中药物浓度均在临界值以下[24]。但是G-CSF静脉及皮下注射时可能存在一些风险及轻微不良反应,如腰痛、胸痛、骨痛、发热、头痛、倦怠、心悸等不适,偶有皮肤发红、皮疹、食欲不振、恶心、呕吐等消化道反应及肝损害等。对于出现疼痛者可口服吲哚美辛或肌内注射异丙嗪对症治疗,余不适无需特殊处理[25]。本研究观察组中仅2例出现发热,均低于38℃,第2日自行缓解,余患者无其他不适。
总之,rh G-CSF能改善uRIF患者再次解冻移植的妊娠结局,且应用安全性较好。但因本研究样本量较少,未研究rh G-CSF对胚胎植入的作用机制,将来需设计更加严谨的随机对照研究探讨rh G-CSF在生殖免疫方面的作用和机制,以及其规范治疗方案、给药方式、严格的适应证及禁忌证。
