LC-MS/MS法同时测定人尿液中氢化可的松和6β-羟基氢化可的松的浓度*
2020-04-29谢利军杨雨晴沈叶应玉雯黄烽如张烨刘云孙鲁宁王永庆
谢利军,杨雨晴,沈叶,应玉雯,黄烽如,张烨,刘云,孙鲁宁,王永庆
(1.南京医科大学第一附属医院临床药理研究室,南京 210029;2.东部战区总医院药学部,南京 211166)
细胞色素P450(cytochrome P450,CYP)是人体内主要的药物代谢酶。CYP3A4是人体肝脏中最主要的CYP酶(占总量的60%)[1],参与超过50%临床使用药物的代谢[2]。由于个体间CYP3A4酶活性具有较大的差异[3],造成药物疗效及不良反应存在较大的个体差异[4,5]。为了监测治疗效果,避免不良反应,需要对人体CYP3A4酶的活性进行测定[6]。目前,评价人体CYP3A酶活性的方法主要有探针药物法[7](包括咪达唑仑试验、红霉素呼吸试验和尿中氨苯砜回收率试验)和内源性生物标志物法[6β-羟基氢化可的松/氢化可的松比值[8]及6β-羟基氢化可的松的清除率CLm(6β)[9]]。探针药物法需要患者额外服用与治疗疾病无关的药物,可能会引起副作用和药物相互作用[10];而且,红霉素呼吸试验需要使用放射性同位素[11-12];另外,咪达唑仑试验需要多次采集血液样本进行浓度分析[13],该方法可在临床试验中应用,但不宜在临床诊疗中采用。6β-羟基氢化可的松和氢化可的松浓度的比值和6β-羟基氢化可的松的清除率CLm(6β)法可以作为评价CYP3A4酶活性的内源性生物标志物,这种方法具有非侵入性和患者依从性良好等优点[14]。
目前报道的测定人尿液中氢化可的松及6β-羟基氢化可的松浓度的分析方法主要有高效液相色谱法(HPLC)[15-18]和液相色谱-串联质谱法(LC-MS/MS)[19-21]。文献[15-18]报道的HPLC测定方法,灵敏度较低(定量下限,氢化可的松为5 ng·mL-1,6β-羟基氢化可的松为10 ng·mL-1)、分析时间较长(15~30 min)。文献[19-21]采用的LC-MS/MS法,前处理过程需要固相萃取后旋干等操作,成本较高且过程复杂。本文建立了一种简单快捷的LC-MS/MS法同时测定人尿液样本中氢化可的松和6β-羟基氢化可的松的浓度,用于评价人体CYP3A4酶活性,为临床用药提供依据。
1 仪器与试药
1.1仪器 API 4000质谱仪,配备电喷雾离子源及Analyst1.6.3数据处理系统(美国应用生物公司);1290 Infinity高效液相色谱仪,包括G1316C柱温箱、G4226A多孔板自动进样器和G4220A二元高压泵(美国安捷伦科技有限公司);BP211D 电子天平(德国Sartorius公司,感量:0.01 mg);Stratos离心机(德国Thermo Fisher公司);Mixmate涡旋混匀仪(德国Eppendorf公司)。
1.2试药 氢化可的松(德国Dr.Ehrenstorfer GmbH公司,批号:41210,纯度:99.8%);6β-羟基氢化可的松(美国Sigma-Aldrich公司,批号:SLBN4942V,纯度≥98%);d4-氢化可的松(加拿大Toronto Research Chemicals公司,批号:5-KSS-11-4,纯度:99%);d4-6β-羟基氢化可的松(加拿大Toronto Research Chemicals公司,批号:1-JMR-119-2,纯度:95%);甲醇为色谱纯(美国Merck公司);甲酸为色谱纯(美国Aladdin公司);超纯水(18.2 MΩ)由Millipore纯水仪制得。
2 方法与结果
2.1色谱条件 色谱柱:Waters CORTECS®C18+柱(2.1 mm×50 mm,2.7 μm);柱温:40 ℃;流动相由0.1%甲酸水溶液(A相)和甲醇(B相)组成。梯度洗脱:0 min,10%B;0~1 min:10%→40%B;1~3.5 min,40%B;3.5~3.6 min:40%→95%B;3.6~4.5 min:95%B;4.5~4.6 min:95%→10%B;4.6~5 min:10%B;流速:0.6 mL·min-1;进样量:20.0 μL;分析时间5 min。
2.2质谱条件 采用多重反应监测(MRM)离子检测方式,离子化方式为电喷雾离子化(ESI),离子极性为正离子,离子化电压为5500 V,温度设为600 ℃,雾化气压力为55 N,涡轮气压力为55 N,气帘气压力为35 N,碰撞气压力为10 N。氢化可的松、6β氢化可的松及其各自内标的定量离子对,去簇电压(DP),射入电压(EP),碰撞能量(CE),碰撞室射出电压(CXP)见表1。

表1 质谱条件
2.3储备液和工作液的配制 精密称取氢化可的松10.02 mg对照品(经纯度换算后相当于氢化可的松10.00 mg)用甲醇溶解定容至10.0 mL量瓶,得到1.00 mg·mL-1的氢化可的松储备液。用50%甲醇水溶解一瓶1.00 mg/瓶的6β-羟基氢化可的松对照品,转移至2.0 mL量瓶并定容,得到500 μg·mL-1的6β-羟基氢化可的松储备液。取浓度为1.00 mg·mL-1的氢化可的松储备液20 μL以及500 μg·mL-1的6β-羟基氢化可的松储备液200 μL至2.0 mL量瓶,并用50%甲醇水定容,得到氢化可的松和6β-羟基氢化可的松浓度分别为10.0/50.0 μg·mL-1的混合工作液,将此混合工作液用50%甲醇水逐级稀释,得到氢化可的松和6β-羟基氢化可的松浓度分别为0.020 0/0.100,0.040 0/0.200,0.100/0.500,0.400/2.00,1.00/5.00,2.00/10.0,4.00/20.0,5.00/25.0,6.00/30.0 μg·mL-1的系列浓度标准曲线用混合工作液,以及浓度分别为0.050 0/0.250,0.500/2.50,4.80/24.0 μg·mL-1的质控用混合工作液。以甲醇为溶剂,配制含d4-氢化可的松和d4-6β-羟基氢化可的松浓度分别为2.50/12.5 μg·mL-1的混合内标工作液。
2.4标准曲线和质控样本的配制 由于氢化可的松和6β-羟基氢化可的松为内源性物质,本研究需要测定待测化合物在尿液样本中的本底值,故需要选择合适的替代基质配制标准曲线和质控样本。经过介质效应和提取回收率的考察,待测化合物在尿液的基质效应和提取回收率均在100%附近(具体方法结果见“2.6.3”和“2.6.4”项下内容),因此,笔者采用水作为替代基质配制标准曲线和质控样本。取纯水190 μL,加入相应浓度的混合工作液10.0 μL,配成含氢化可的松和6β-羟基氢化可的松浓度分别为1.00/5.00,2.00/10.0,5.00/25.0,20.0/100,50.0/250,100/500,200/1000,250/1 250,300/1 500 ng·mL-1的混合标准曲线样本。以及氢化可的松和6β-羟基氢化可的松浓度分别为2.50/12.5,25.0/125,240/1200 ng·mL-1的混合质控样本。根据美国FDA指导原则,使用尿液基质同法制备中、高浓度混合质控样本(氢化可的松和6β-羟基氢化可的松浓度分别为25.0/125和240/1 200 ng·mL-1),于每一分析批中,以考察生物基质中含量测定的可靠性。
2.5样本前处理 于200 μL尿液样本中加入内标甲醇工作液20.0 μL,涡旋10 min,于4 ℃,16 000 r·min-1条件下离心15 min,取上清液进行LC-MS/MS分析。
2.6方法学验证
2.6.1专属性考察 本实验分别考察了氢化可的松、6β-羟基氢化可的松及其同位素内标在水基质中,以及同位素标记的氢化可的松、6β-羟基氢化可的松在人尿液中的专属性。氢化可的松、6β-羟基氢化可的松、d4-氢化可的松和d4-6β-羟基氢化可的松的保留时间分别约为3.0,1.2,3.0和1.2 min。典型色谱图如图1所示,结果表明水基质中氢化可的松,6β-羟基氢化可的松及其内标峰位处无干扰,尿液中d4-氢化可的松和d4-6β-羟基氢化可的松峰位处无干扰。
2.6.2标准曲线 按“2.4”项方法制备混合标准曲线样本和混合质控样本。按“2.5”项下处理样本。以浓度(C)为横坐标,以待测化合物/内标峰面积比值(f)为纵坐标,用权重系数1/C2进行最小二乘法线性回归。典型的氢化可的松及6β-羟基氢化可的松标准曲线方程分别为f=0.004 27×C+0.000 161(r=0.999 3)及f=0.004 61×C+0.001 52(r=0.998 8),结果表明分别在1~300 ng·mL-1及5~1500 ng·mL-1范围线性良好。
2.6.3提取回收率 按“2.4”项方法,使用6个不同来源的空白尿液制备低浓度(氢化可的松/6β-羟基氢化可的松,2.50/12.5 ng·mL-1)、中浓度(氢化可的松/6β-羟基氢化可的松,25.0/125 ng·mL-1)、高浓度(氢化可的松/6β-羟基氢化可的松,240/1200 ng·mL-1)混合质控样本,按“2.5”项下处理。同时在6个不同来源的空白尿液的甲醇提取液加入相同浓度的分析物和内标工作液,涡旋混匀。上述每个浓度样本配制3份,进样分析后,以空白尿液制备的样本中分析物的峰面积与空白尿液的甲醇提取液制备的样本中分析物的峰面积的比值,评价提取回收率。结果显示3种浓度尿液样本中氢化可的松的提取回收率分别为(100.8±9.6)%,(100.1±2.8)%,(108.3±5.3)%,6β-羟基氢化可的松的提取回收率为(97.2±0.8)%,(97.4±6.8)%,(101.9±4.5)%。

A.空白样本;B.中浓度质控水基质样本;C.空白尿液样本;D.仅含内标的尿液基质样本
1.blank sample;B.quality control sample at medium dose;C.blank urine sample;D.Urine sample containing internal standard
Fig.1Chromatogramsofhydrocortisone,6β-hydroxycortisoneandtheirinternalstandardsinwaterandurine
2.6.4基质效应 按“2.4”和“2.5”项方法,使用6个不同来源的空白尿液制备甲醇提取液,加入待测化合物和内标工作液,制备浓度为中浓度和高浓度质控的基质效应样本;同时用水基质制备相同的中浓度和高浓度样本;另外,对6个不同来源的尿液分别配制空白尿液甲醇提取液,仅加入内标工作液,用于计算空白尿液基线值;上述样本每个来源每个浓度各配制3份。将上述样本进样分析,得到各样本待测化合物与内标的峰面积,计算待测化合物/内标峰面积比值(f);将基质效应样本中的f值减去空白尿液f值(基线值)后除以水基质样本中的f值,获得扣除基线值的内标归一化基质效应因子,用于评价尿液基质对分析的影响。中浓度和高浓度尿液样本中氢化可的松的基质效应分别是(95.8±8.0)%,(97.7±4.8)%,6β-羟基氢化可的松的基质效应分别是(95.6±8.1)%,(106.0±6.2)%,结果显示尿液基质不影响样本检测,同时结合提取回收率结果验证了可以水溶液作为替代基质。
2.6.5准确度和精密度 按“2.4”项方法配制定量下限样本、低中高浓度的水基质混合质控样本以及低高两种浓度的尿液基质混合质控样本,每个浓度配制5份,按“2.5”项下处理,考察批内和批间准确度和精密度。结果见表2。
2.6.6稳定性实验 按“2.4”项方法,配制浓度为低、高两种浓度的水基质混合质控样本,及浓度为中高两种浓度的尿液基质混合质控样本,分别在室温(24 ℃)放置10 h、自动进样器(10 ℃)中放置24 h、反复冻融3次、-80 ℃冰冻3个月后,按“2.5”方法处理,以准确度评估稳定性。结果显示待测化合物在上述条件下稳定性均良好,见表3。

表2 精密度和准确度
COR表示氢化可的松;6β-OH COR表示6β-羟基氢化可的松。
Cor,cortisol;6β-OH COR,6β-hydroxycortisol.
2.7人尿液中氢化可的松和6β-羟基氢化可的松浓度的测定 6β-羟基氢化可的松和氢化可的松浓度的比值和6β-羟基氢化可的松的清除率CLm(6β)[9]作为评价人体CYP3A4酶活性的内源性生物标志物,具有非侵入性和患者依从性良好等优点[14]。西他沙星主要经UGT1A代谢消除[22],不是CYP的底物,对CYP酶没有诱导和抑制作用[23],故可以在研究西他沙星在健康受试者体内尿药排泄的同时,研究健康受试者尿液中6β-羟基氢化可的松和氢化可的松浓度的比值的经时变化情况及清除率,为人体CYP3A4酶活性的内源性生物标志物研究提供数据。
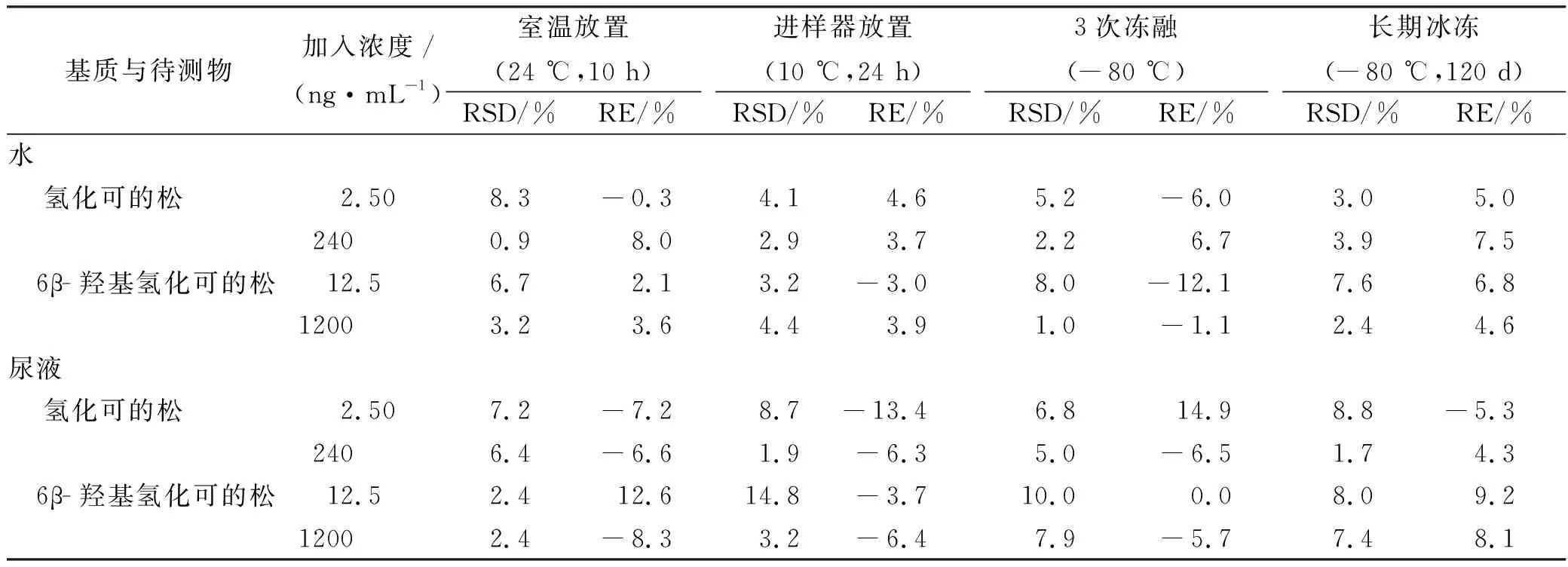
表3 稳定性考察结果
COR表示氢化可的松;6β-OH COR表示6β-羟基氢化可的松。
Cor,cortisol;6β-OH COR,6β-hydroxycortisol.
西他沙星颗粒剂在健康受试者体内的药动学(临床试验批件号:2014L00334)在南京医科大学第一附属医院Ⅰ期临床试验病房完成。其中,50 mg剂量组单次给药药动学研究,于给药前和给药后10,20,30,45 min,1.0,1.25,1.5,2,3,5,8,12,24,36 h采集静脉血进行人体药动学研究;于给药前和给药后0~3,3~6,6~12,12~24,24~36,36~48,48~60 h收集尿样样本进行西他沙星颗粒剂尿液排泄研究。
本文应用已建立的方法测定西他沙星颗粒剂50 mg剂量组单次给药前后(0~24 h)人尿液中6β-羟基氢化可的松和氢化可的松的浓度;应用已建立的测定人血浆中6β-羟基氢化可的松和氢化可的松浓度方法(另文发表),测定西他沙星颗粒剂50 mg剂量组单次给药前后(0~24 h)人血浆中6β-羟基氢化可的松和氢化可的松的浓度;分别计算人尿液中6β-羟基氢化可的松和氢化可的松浓度的比值和6β-羟基氢化可的松的清除率CLm(6β)[9](CLm(6β)=X(6β)/ AUC(F),其中,X(6β)为不同集尿时间段尿中6β-羟基氢化可的松的排泄量;AUC(F)为相应时间段内氢化可的松的血药浓度-时间曲线下面积。10例受试者单次给定西他沙星颗粒剂50 mg后(0~24 h)尿液中6β-羟基氢化可的松和氢化可的松浓度的比值的经时过程见图2,尿液样本中6β-羟基氢化可的松的清除率CLm(6β)为(2.46±1.03)mL·min-1,与文献报道[24]健康受试者结果接近。
3 讨论
笔者在研究建立并验证了同时测定人尿液中氢化可的松及6β-羟基氢化可的松的HPLC-MS/MS法。在方法开发过程中,对每项质谱参数进行了优化,使得两个待测化合物均具有现有条件下最高的质谱响应。优化色谱条件时,对不同的色谱柱,不同的流动相的组成、比例、流速进行了对比,选择峰形和分离均较好的色谱柱和色谱条件,同时建立了梯度洗脱程序,在实现良好的色谱分离的同时,在待测化合物出峰后使用95%有机相冲洗1 min以保护色谱柱和减少本次进样对下一次进样的影响,以提高方法的耐用性。由于氢化可的松和6β-羟基氢化可的松为内源性物质,本研究需要测定待测化合物在尿液样本中的本底值,故需要选择合适的替代基质配制标准曲线和质控样本。在方法验证过程中,经过介质效应和提取回收率的考察,充分验证了水作为替代基质的可行性。由于基质中氢化可的松和6β-羟基氢化可的松本底量高,而低浓度质控样本浓度相对较低,无法准确扣除本底量,因此只考察了中、高两种浓度质控样本的基质效应,结果显示无明显基质效应。在提取回收率实验中,用来对比的两种样本中均含有尿液基质,所以无需扣除本底量,结果显示提取回收率接近100%。另外,根据FDA指导原则,在每一分析批中额外加入了中、高两种浓度的尿液基质质控样本,以验证分析结果的可靠性。最终应用建立的同时测定人尿液中氢化可的松和6β-羟基氢化可的松浓度的HPLC-MS/MS法用于人体CYP3A酶活性评价。
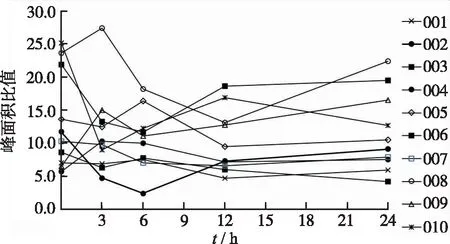
图2 尿液中6β-羟基氢化可的松和氢化可的松浓度的比值的经时过程
Fig.2Curvesofconcentrationratioof6β-hydroxycortisonetohydrocortisoneinhumanurineversustime
