成纤维细胞生长因子19改善缺氧/复氧心肌细胞H9c2损伤
2020-04-29王科程汤祥瑞程德均
王科程 汤祥瑞 程德均 张 鑫
心肌缺血再灌注损伤在心脏移植、经皮冠状动脉介入治疗、心肌梗死溶栓治疗等过程中较为常见,可引发心力衰竭、心室重构,影响患者预后[1]。心肌缺血再灌注损伤与心肌细胞功能异常有关,缺氧/复氧导致心肌细胞氧化应激,从而诱导细胞凋亡发生[2]。心肌缺血再灌注损伤与基因的异常表达有关,这些基因在心肌损伤过程中表达改变或代偿性改变与心肌细胞损伤发生有关[3]。成纤维细胞生长因子19(FGF19)是FGFs成员,在软骨、胎儿视网膜以及成人的胆囊中广泛表达,参与葡糖糖代谢、脂肪代谢、氧化应激等过程,FGF19是目前发现的细胞保护调节剂,能够对抗外界应激诱导的氧化应激和细胞损伤[4,5]。既往研究显示,FGF19在缺氧/复氧心肌损伤中表达上调,FGF19可以减少心肌细胞中氧自由基的积累,在缺氧/复氧心肌细胞损伤中可能发挥保护作用[6]。本实验以心肌细胞H9c2作为体外实验对象,旨在明确FGF19在缺氧/复氧心肌细胞损伤中的作用,为FGF19治疗缺氧/复氧心肌损伤提供理论参考。
1 材料与方法
1.1 细胞、试剂和仪器
心肌细胞H9c2购自美国ATCC;FGF19抗体购自美国Santa Cruz Biotechnology;Lipofectamine 2 000购自美国Invitrogen;乳酸脱氢酶(Lactate Dehydrogenase,LDH)检测试剂盒(批号20180218)、超氧化物歧化酶(Superoxide Dismutase,SOD)检测试剂盒(批号20180127)、过氧化氢酶(Catalase,CAT)检测试剂盒(批号20180410)、谷胱甘肽还原酶(Glutathione Reductase,GSH-Px)检测试剂盒(批号20180215)购自南京建成生物工程研究所有限公司;cDNA合成试剂盒购自生工生物工程(上海)股份有限公司;丙二醛(Malondialdehyde,MDA)检测试剂盒(批号20180129)、活性氧(Reactive Oxygen Species,ROS)检测试剂盒(批号20180321)购自北京普利莱基因技术有限公司;C-Caspase-3抗体、C-Caspase-9抗体购自美国Abcam;Cyt C抗体购自上海时代生物科技有限公司;阴性对照pcDNA 3.1、pcDNA 3.1-FGF19由上海吉玛制药技术有限公司构建。细胞培养箱,型号8000,美国Thermo Fisher Scientific公司;PCR检测仪,型号CFX96,美国Bio-Rad公司;电泳仪,型号PowerPac Basic,美国Bio-Rad公司;流式细胞仪,型号FACScan,美国BD公司;酶标仪,型号550,美国Bio-Rad公司;Western blot成像分析系统,型号AI600,美国GE公司;荧光显微镜,型号ISCM ,德国ZEISS产品。
1.2 细胞转染和分组处理
将心肌细胞H9c2分为对照组(Control组)、缺氧/复氧组(H/R组)、质粒转染对照+缺氧/复氧组(NC+H/R组)和质粒转染+缺氧/复氧组(FGF19+H/R组)。Control组为常规培养的心肌细胞H9c2;H/R组为心肌细胞H9c2经过缺氧/复氧处理; NC+H/R组、FGF19+H/R组为心肌细胞H9c2分别转染pcDNA 3.1、pcDNA 3.1-FGF19质粒后,再经过缺氧/复氧处理。细胞转染步骤按Lipofectamine 2 000转染试剂说明书操作。缺氧/复氧处理方法如下:取处于对数生长期的心肌细胞H9c2,以不含血清的DMEM细胞培养液培养,于含有95%N2和5%CO2的培养箱中培养4h,即为缺氧培养;然后将细胞培养液更换为含有胎牛血清的DMEM培养液,置于95%空气、5% CO2培养箱中孵育6h,即为复氧培养。处理完毕后检测下述指标,每项检测每组细胞设置3个复孔。
1.3 Realtime PCR检测FGF19 mRNA水平
采用Realtime PCR检测H/R组、NC+H/R组、FGF19+H/R组细胞FGF19 mRNA水平。步骤如下:收集细胞,用常规方法(Trizol试剂)提取细胞中的总RNA,取5μl RNA,用紫外分光光度计检测OD260/OD280的比值。用cDNA合成试剂盒进行逆转录。按照下述方法进行Realtime PCR检测,体系为:SYBR premix ex taq 10μl、上下游引物(浓度为2.5μM)各0.5μl、cDNA 1μl,添加DEPC水至总体积为20μl。PCR扩增条件为:95℃预变性15s,95℃变性5s,60℃延伸30s,共45个循环,以GAPDH为内参照。反应结束后,根据样品的CT值计算FGF19 mRNA水平,计算方法为2-△△CT法。引物序列如下:内参GAPDH上游 5’-AAG GTC GGA GTC AAC GGA TTT G-3’,下游5’-CCA TGG GTG GAA TCA TAT TGG AA-3’;FGF19上游5’-TCT CCT CTG ACT TCA ACA GCG ACA C-3’, 下游5’-TGT TGC TGT AGC CAA ATT CGT TGT C-3’。
1.4 Western blot检测FGF19蛋白水平
采用Western blot检测H/R组、NC+H/R组、FGF19+H/R组细胞FGF19蛋白水平。步骤如下:蛋白提取试剂提取各组细胞总蛋白,在蛋白样品中添加上样缓冲液,100℃煮沸5min,取40μg蛋白样品电泳。将NC膜裁剪成合适大小, 100V的电压1h电转至NC膜,于封闭液室温孵育2h;加入一抗(1∶1 000),室温孵育2h;再于二抗(1∶2 000)中室温孵育2h。ECL方法发光。以GAPDH为内参,Image J软件分析蛋白条带灰度值。以FGF19蛋白条带灰度值与GAPDH条带灰度值的比值表示FGF19蛋白相对表达水平。
1.5 LDH、MDA、ROS水平和SOD、CAT、GSH-Px活性检测
分别收集Control组、H/R组、NC+H/R组、FGF19+H/R组细胞培养液和细胞,ELISA检测培养液中LDH含量以及细胞中MDA、ROS和SOD、CAT、GSH-Px活性,步骤均完全按照试剂盒和仪器说明书进行。各组ROS结果以Control组作为参照。
1.6 流式细胞术检测细胞凋亡
取Control组、H/R组、NC+H/R组、FGF19+H/R组细胞,用PBS溶液将细胞配成106个/ml的细胞悬浮液,取1ml细胞悬液1 000g离心10min,将细胞重悬于500μl的Binding Buffer中,然后依次添加Annexin V-FITC和PI溶液各5μl,完全混合后,用流式细胞仪检测各组细胞凋亡水平。所有操作按仪器和试剂说明书进行。
1.7 Western blot检测细胞C-Caspase-3、C-Caspase-9蛋白和胞浆Cyt C蛋白
取Control组、H/R组、NC+H/R组、FGF19+H/R组细胞,应用蛋白提取试剂盒提取细胞总蛋白和胞浆蛋白,以Western blot方法检测细胞总蛋白中C-Caspase-3、C-Caspase-9水平和胞浆中Cyt C蛋白水平,内参为GAPDH。C-Caspase-3、C-Caspase-9抗体以1∶400稀释,Cyt C抗体以1∶600稀释。Western blot操作步骤同1.4。
1.8 JC-1法检测线粒体膜电位
取Control组、H/R组、NC+H/R组、FGF19+H/R组细胞,用细胞培养液悬浮细胞后添加终浓度为5μg/ml的JC-1染色液,避光孵育20min,再以JC-1缓冲液将细胞洗涤2次,在荧光显微镜下观察荧光强度。以Control组为参照,以每组细胞荧光强度与Control组荧光强度的比值表示该组细胞的线粒体膜电位。
1.9 统计学处理

2 结 果
2.1 各组心肌细胞H9c2中FGF19mRNA和蛋白表达水平比较
各组心肌细胞中FGF19 mRNA和蛋白表达差异均有统计学意义(P均<0.01)。与H/R组和NC+H/R组比较,FGF19+H/R组心肌细胞中FGF19 mRNA和蛋白表达水平均显著升高(q均>10.00,P均<0.01)。H/R组与NC+H/R组心肌细胞中FGF19 mRNA和蛋白表达水平比较,差异无统计学意义(q均<1.00,P>0.05)。见图1和表1。

图1 Western blot检测各组心肌细胞FGF19蛋白表达
2.2 各组心肌细胞H9c2培养液中LDH及细胞中MDA和ROS水平比较
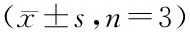
表1 各组心肌细胞FGF19 mRNA和蛋白表达水平
注:与H/R组比较,1)P<0.01;与NC+H/R组比较,2)P<0.01
各组心肌细胞培养液中LDH水平及细胞中MDA和ROS水平差异均有统计学意义(P均<0.01)。与Control组比较,H/R组细胞培养液中LDH水平升高(q=18.37,P<0.01),细胞中MDA和ROS水平亦升高(q=21.29、22.50,P<0.01)。与NC+H/R组比较,FGF19+H/R组细胞培养液中LDH水平降低(q=12.92,P<0.01),细胞中MDA和ROS水平亦降低(q=15.69、16.65,P<0.01)。H/R组与NC+H/R组各指标水平比较,差异无统计学意义(q均<1.00,P>0.05)。见表2。

表2 各组细胞培养液中LDH和细胞中MDA、ROS水平
注:与Control组比较,1)P<0.01;与NC+H/R组比较,2)P<0.01
2.3 各组心肌细胞H9c2中SOD、CAT和GSH-Px活性比较
各组心肌细胞中SOD、CAT和GSH-Px活性差异均有统计学意义(P均<0.01)。与Control组比较,H/R组细胞中SOD、CAT和GSH-Px活性均降低(q=21.77、31.85、16.64,P<0.01)。与NC+H/R组比较,FGF19+H/R组细胞中SODCAT和GSH-Px活性均升高(q=12.77、18.71、8.67,P<0.01)。H/R组与NC+H/R组各指标水平比较,差异无统计学意义(q均<1.00,P>0.05)。见表3。
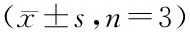
表3 各组细胞SOD、CAT和GSH-Px活性
注:与Control组比较,1)P<0.01;与NC+H/R组比较,2)P<0.01
2.4 各组心肌细胞H9c2凋亡及C-Caspase-3和C-Caspase-9蛋白表达水平比较
各组心肌细胞凋亡率、C-Caspase-3、C-Caspase-9蛋白水平比较差异均有统计学意义(P均<0.01)。与Control组比较,H/R组细胞凋亡率升高(q=30.113,P<0.01),C-Caspase-3和C-Caspase-9蛋白水平均升高(q=16.900、14.327,P<0.01)。与NC+H/R组比较,FGF19+H/R组细胞凋亡率降低(q=16.852,P<0.01),C-Caspase-3和C-Caspase-9蛋白水平均降低(q=9.907、8.249,P<0.01)。H/R组与NC+H/R组各指标水平比较,差异无统计学意义(q均<1.00,P>0.05)。见图2、图3和表4。
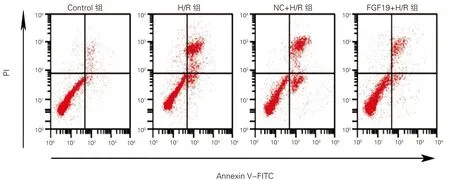
图2 各组心肌细胞凋亡(流式细胞术)

图3 各组心肌细胞C-Caspase-3和C-Caspase-9蛋白水平(Western blot)
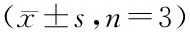
表4 各组细胞凋亡率和C-Caspase-3、C-Caspase-9蛋白水平

组 别凋亡率(%)C-Caspase-3C-Caspase-9Control组4.95±0.410.38±0.040.43±0.05H/R组18.62±1.531)0.67±0.071)0.76±0.091)NC+H/R组17.95±1.900.68±0.050.75±0.07FGF19+H/R组10.30±1.142)0.51±0.042)0.56±0.062)F值207.3269.5147.81
注:与Control组比较,1)P<0.01;与NC+H/R组比较,2)P<0.01
2.5 各组心肌细胞H9c2胞浆中Cyt C蛋白水平和线粒体膜电位比较
各组心肌细胞Cyt C蛋白水平和线粒体膜电位比较差异均有统计学意义(P均<0.01)。与Control组比较,H/R组细胞Cyt C蛋白水平升高(q=25.29,P<0.01),线粒体膜电位降低(q=17.59,P<0.01。与NC+H/R组比较,FGF19+H/R组细胞Cyt C蛋白水平降低(q=16.86,P<0.01),线粒体膜电位升高(q=6.96,P<0.01)。H/R组与NC+H/R组胞浆中Cyt C蛋白水平和线粒体膜电位水平比较,差异无统计学意义(q均<1.00,P>0.05)。见图4和表5。
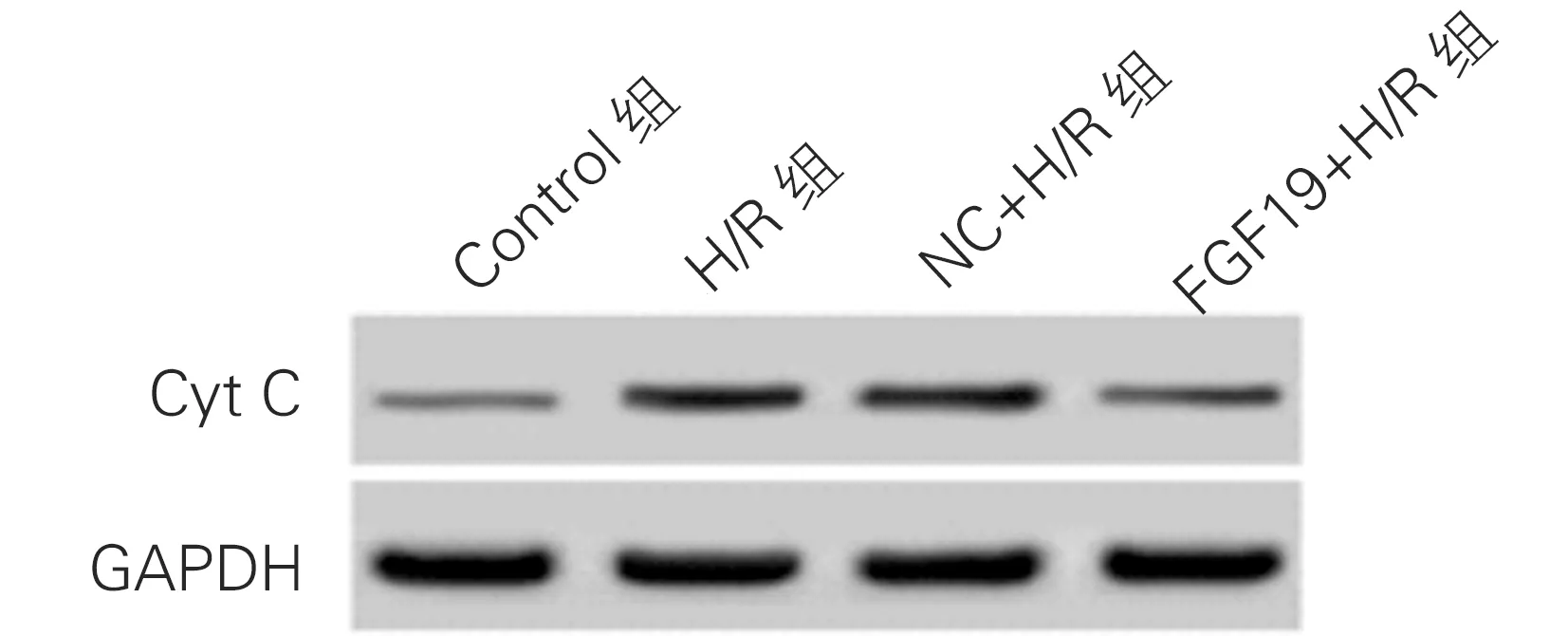
图4 各组心肌细胞胞浆中Cyt C蛋白水平(Western blot)
3 讨 论
FGF19基因定位在11号染色体的q13.1上,可以编码含有216个氨基酸的开放阅读框,由11条反平行链组成的球状结构是FGF19的核心[7]。FGF19参与糖代谢、炎症、肿瘤发生等生理和病理过程,与氧化应激、细胞凋亡发生有关[4,5,8]。研究显示,FGF19在缺氧/复氧心肌损伤中表达代偿性上调,并且下调FGF19可以抑制缺氧/复氧条件下心肌细胞增殖活性,FGF19在缺氧/复氧心肌损伤中可能发挥保护作用[6]。还有研究表明,FGF19是一个细胞保护因子,可抵抗炎症、氧化应激等引起的细胞损伤[9-11]。本文结果发现,上调FGF19可以明显减少缺氧/复氧诱导的心肌细胞H9c2凋亡,改善缺氧/复氧对心肌细胞的损伤。
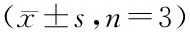
表5 各组细胞胞浆中Cyt C蛋白水平和线粒体膜电位
注:与Control组比较,1)P<0.01;与NC+H/R比较,2)P<0.01
氧化应激是心肌缺血再灌注损伤发生的重要原因,缺氧/复氧可以诱导心肌细胞中ROS的积累,过量的ROS诱导细胞膜脂质发生过氧化,从而导致细胞内LDH通过损坏的细胞膜进入到细胞外,MDA是脂质发生过氧化的产物[12,13]。ROS的积累与细胞内氧化平衡状态异常改变有关,细胞内抗氧化酶活性降低可以直接诱导细胞内ROS的聚集。SOD、CAT和GSH-Px是在细胞内广泛存在的抗氧化酶,其活性高低与细胞氧化应激有关[14-16]。本文结果显示,缺氧/复氧处理后的心肌细胞中ROS和MDA含量升高,细胞培养液中LDH水平也升高,细胞中SOD、CAT和GSH-Px活性降低,而上调FGF19可以抑制缺氧/复氧诱导的心肌细胞ROS、MDA和LDH水平异常升高,并提高细胞中SOD、CAT和GSH-Px活性,提示上调FGF19可以改善缺氧/复氧心肌细胞氧化损伤。
心肌缺血再灌注损伤的发生与氧化应激有关,而氧化应激条件下ROS过度聚集可以刺激线粒体中Cyt C蛋白进入胞浆,从而激活Caspase凋亡反应,诱导细胞凋亡的发生[17-19]。正常情况下,线粒体膜内外具有一定的膜电位,线粒体膜电位对于维持线粒体内外稳定具有重要意义[20]。Cyt C多存在于线粒体中,当线粒体受到ROS刺激后膜电位下降,导致Cyt C从线粒体转移至胞浆中,而胞浆中的Cyt C可以激活位于Caspase凋亡反应上游的Caspase-9,最终活化凋亡执行因子Caspase-3,诱导细胞凋亡发生[21]。本文结果表明,缺氧/复氧处理后的心肌细胞线粒体膜电位下降,胞浆中Cyt C蛋白水平升高,细胞中C-Caspase-3、C-Caspase-9蛋白表达增多,而上调FGF19能够抑制缺氧/复氧诱导的线粒体膜电位下降、胞浆Cyt C蛋白增多和C-Caspase-3、C-Caspase-9蛋白水平升高,说明上调FGF19可能通过线粒体途径减少缺氧/复氧心肌细胞凋亡。
总之, FGF19可能是改善缺氧/复氧心肌损伤的有效途径,其作用机制可能与抑制氧化应激诱导的心肌细胞凋亡发生有关。本次实验结果为研究缺氧/复氧心肌损伤分子发生机制奠定了基础,FGF19在缺氧/复氧心肌损伤中的具体靶向调控机制还不清楚,在以后的实验中会继续对其机制进行探讨。
◀