动脉栓塞术与微波消融术治疗肝海绵状血管瘤患者临床疗效对比研究*
2020-04-29李陆鹏曹广劭曹会存刘建文刘玉岩
李陆鹏,曹广劭,曹会存,刘建文,刘玉岩
肝海绵状血管瘤(cavernous hemangioma of liver,CHL)是一种无明显症状和体征的常见肝脏良性肿瘤,病程较长,肿瘤直径大于5 cm时可引起腹胀、腹痛等压迫症状,并具有血管瘤破裂出血的风险。现阶段,多采用外科手术治疗瘤体直径>5cm的患者,但手术治疗过程创伤大,风险高,容易诱导众多并发症的发生[1,2]。随着微创和介入放射学技术的发展,经导管动脉栓塞术(transcatheter arterial embolization,TAE)和微波消融创伤小,治疗后预后较好,备受临床医生和患者的青睐。已有研究显示TAE和微波消融治疗CHL患者效果良好[3,4]。我们采取TAE和微波消融治疗了CHL患者,比较了两种方法治疗各自的优缺点,现报道如下。
1 资料与方法
1.1 一般资料 2014年1月~2018年4月在我院综合介入科就诊的CHL患者74例,男性35例,女性39例;年龄范围为32~55岁,平均年龄为(43.48±10.34)岁。经影像学检查并符合CHL的诊断标准[5],有明显的腹痛腹胀和压迫周围组织症状或瘤体直径>5 cm,无行介入治疗的禁忌证。其中单个病灶43例,两个及以上病灶31例;瘤体直径为5~10 cm者54例,瘤体直径≥10 cm者20例;肿瘤在肝右叶者28例,肝左叶者26例,两叶均有20例。排除标准:①伴有严重的中枢和外周神经性疾病、皮肤病、血液系统疾病或恶性肿瘤;②严重的腹腔积液或恶液质;③治疗前3月内服用过损伤肝功能的药物。将患者分成两组,两组一般资料比较具有良好的可比性(P>0.05)。所有患者签署知情同意书,本研究经我院医学伦理委员会审核通过。
1.2 治疗方法 在行微波消融治疗时,使用KY-2000系列微波消融治疗仪(南京康友医疗科技有限公司)和Voluson730Pro彩色多普勒超声诊断系统(上海涵飞医疗器械有限公司)。术前禁食、禁饮,术中予以补液和全程生命体征监测。术前设计好最佳穿刺点及路径,避开膈肌、肝静脉、胆管、门静脉等重要结构。对于孤立,且远离肝脏重要结构的瘤体,给予常规局部麻醉,在超声引导下进行定位、穿刺。对于周围组织较为复杂,距离肝脏或周围重要组织结构较近的瘤体,给予常规全身麻醉,在腹腔镜下探查、显露病灶。在超声引导下进行定位和穿刺。对所有患者均行两圆相交消融技术进行微波消融治疗,仪器输出功率为50~74 w。根据瘤体大小确定治疗时间为8~15 min。术毕,在膈下或肝下置管引流,给予止痛、预防感染、护肝治疗和护理,直至患者病情恢复,出院[6];在行TAE时,患者取仰卧位,行局部麻醉,采用Seldinger技术插管,穿刺右侧股动脉,将导管送至病灶动脉,行DSA下造影,明确CHL的部位、大小、数目和血供情况。然后,经2.8 F微导管(日本Terumo公司)注入平阳霉素(吉林敖东药业集团延吉股份有限公司,国药准字:H20123357)与碘化油(LaboratorieGuerbet,批准文号:H20050307)的混合乳剂,根据瘤体血供及大小决定用量,行栓塞治疗。拔出导管并实施止血和局部包扎[7]。
1.3 血生化检测 使用DP180型全自动生化分析仪(东唐电子科技有效公司)检测。
1.4 视觉模拟评分(visual analogue score,VAS)的实施 采用VAS评分评估疼痛程度,评分范围为0~10分,分值越高,疼痛程度越严重。0分为无疼痛,10分代表难以忍受的最剧烈的疼痛[8]。
1.5 疗效判断 根据WHO实体瘤疗效评价标准,在术后6个月,使用CT检查测量并计算瘤体变化,以CT显示的CHL最大横截面测量其垂直径线长度,其平均缩小率=(治疗前平均面积-治疗后平均面积)/术前平均面积×100%(平均面积=瘤体最大横截面垂直径线的乘积)。瘤体完全消失为完全缓解(complete remission, CR);瘤体缩小率达50%记为部分缓解(partial remission, PR);瘤体缩小率<50%,但增大不超过25%记为稳定(stable,SD);瘤体最大横截面积增大超过25%记为进展(progress,PD)。总有效率=(CR+PR)例数/总例数×100%。

2 结果
2.1 两组疗效比较 经x2检验,两组总有效率无统计学差异(P>0.05,表1)。

表1 两组患者治疗后6个月疗效[n(%)]比较
2.2 两组肝功能指标变化的比较 治疗前,两组肝功能指标水平差异无统计学意义(P>0.05);治疗后,微波消融组血清ALT和AST水平显著低于TAE组(P<0.05,表2)。

表2 两组肝功能指标比较
与TAE组比,①P<0.05
2.3 两组VAS评分比较 治疗后,微波消融组VAS评分显著低于TAE组(P<0.05,表3)。

表3 两组VAS评分比较
与TAE组比,①P<0.05
2.4 两组不良反应发生率比较 经Fisher概率计算,微波消融组不良反应发生率与TAE组比,差异无统计学意义(P>0.05,表4)。
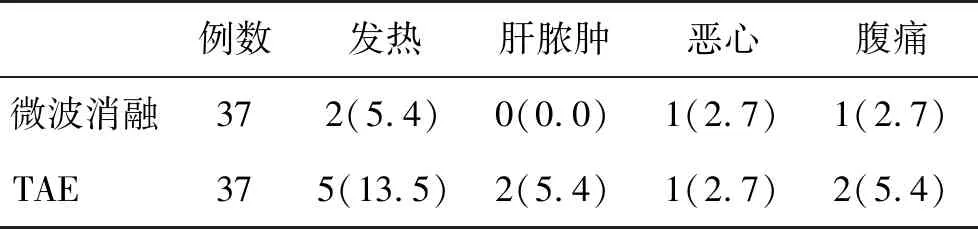
表4 两组不良反应发生率[n(%)]比较
3 讨论
CHL生长缓慢且少有临床症状。研究指出,CHL发病率占全部良性肝肿瘤的73%左右[9]。CHL发病复杂,肝毛细血管组织感染、肝组织局部坏死、肝内区域性血循环停滞、肝内出血、发育异常等均可导致其发病。较多学者认为肝脏内部血管异常所造成的良性先天性或后天缓慢生长的组织畸形是主要的发病原因。CHL患者瘤体可在腹腔内几乎不受限制地生长。当生长到一定程度后可引起上腹部疼痛、腹胀以及周围脏器压迫症状,严重者甚至可导致其自发破裂或Kasabach-Merritt综合征、Budd-Chiari综合征等严重并发症。一般情况下,CHL对肝功能无明显异常,但在治疗过程中可能由于手术创伤而对肝功能造成影响[10,11]。本研究结果显示,治疗后,两组患者血清ALT和AST水平与治疗前相比,均显著升高,但微波消融组血清ALT和AST水平显著低于TAE组。总体而言,经微波消融对CHL患者肝功能的影响较小。因TAE治疗后,瘤体周围正常肝组织缺血坏死,此时,血清ALT和AST在肝脏酶学中的活性最强,治疗本身可能造成其水平升高。此外,TAE还可导致胆管系统轻度缺血,有可能引起胆管水肿和狭窄,造成胆汁淤积,导致一过性黄疸。微波消融治疗在超声引导下进行,避开了膈肌、肝静脉、胆管、门静脉等重要结构,对肝脏的损伤较小,故而微波消融组肝功能指标变化程度较TAE组要小,但本研究亦发现两组患者总有效率无统计学差异,说明两种方法治疗都有效[12-15]。
腹部疼痛是瘤体直径>5 cm的CHL患者的主要临床症状,且在治疗过程中,由于肝脏周围组织器官较为复杂,手术操作带来的损伤等亦会导致患者出现术后疼痛。本研究结果显示,两组患者治疗后VAS评分逐渐降低,且术后12 h、24 h和48 h时微波消融组VAS评分均显著低于TAE组,说明经微波消融进行治疗,CHL患者术后疼痛程度较采用TAE治疗要轻。考虑系微波消融治疗过程中对于瘤体周围组织较为复杂的患者采取腹腔镜直视下进行手术,能有效减少对健康肝脏组织的损伤,且避开了胆管和重要的血管,并可根据瘤体大小进行多点、分次消融操作,可确保瘤体被彻底、完全消融,治疗效果显著,减少了术中病灶的残留,可有效治疗疾病本身所带来的疼痛感。而在TAE治疗过程中,有可能引起肝包膜血管栓塞,且对于瘤体直径越大者,所需注入的栓塞剂较多,容易引起不同程度的疼痛感[16,17]。
CHL由许多扩张的大小不等的血窦组成,表现为肝动脉分支畸形。在进行外科手术治疗时,创伤大,风险高,容易引起较多不良反应的发生。微波消融术通过穿刺直接到达病灶,直接通过高频率的微波产生高热从而导致瘤体组织坏死,无需进行肝脏切开,且避免了将病灶处的肝脏与周围组织分离的步骤,可显著缩短手术时间,降低患者术中出血量,手术创伤较小,进一步避免了由于麻醉时间长及出血量大导致的术后不良反应,故而发热、肝脓肿、胆管狭窄和肝衰竭等常见不良反应发生率较低[18,19]。CHL的血供主要来自肝动脉,TAE治疗以此为基础,注入平阳霉素及碘化油的混合乳剂进行栓塞治疗,可导致CHL患者体内血栓形成,使得血窦闭塞,进而控制瘤体继续生长,从而达到预防破裂出血的治疗目的,有效缓解临床症状。其中,平阳霉素发挥抑制血管内皮增生的作用,是一种温和的血管硬化剂,可破坏血窦内皮并使其闭塞,碘化油则作为一种载体,与平阳霉素乳化后,可促进局部高浓度的药物缓释作用,而达到硬化性栓塞作用。此外,该药还可选择性地沉积于CHL瘤体内,存留时间较长,导致异常血窦血栓形成和机化,使血管瘤成为纤维样结构,促进瘤体皱缩而达到治疗的目的[20,21]。在治疗过程中,对正常肝组织所产生的创伤小,手术可在一定程度上控制不良反应的发生,故而两组患者治疗后,微波消融组不良反应发生情况与TAE组比较,差异不具有统计学意义,推测该结果的获得还可能与术后积极的对症支持治疗措施等密切相关。
综上所述,TAE和微波消融治疗CHL患者均有很好的临床疗效,术后不良反应发生率低,对肝功能指标的影响较小,但微波消融治疗可在直视下进行,进入路径可控可选,消融效果可辨,术后疼痛发生率较低,值得临床进一步研究与应用。但TAE治疗对CHL来说,更符合肿瘤发生学的逻辑,对仪器设备和技术要求可能更高,可以总结的经验也应该更多,也是值得探讨的治疗方法。
