慢性乙型肝炎患者血清铁调素和铁代谢指标及体外HBV转染Huh7细胞铁调素水平变化*
2020-04-29王兆飞管世鹤陈礼文候舒文潘正兰段元丽
王兆飞,管世鹤,陈礼文,王 琴,杨 凯,张 浩,候舒文,潘正兰,段元丽
铁调素(hepcidin,Hepc)是一种由肝脏合成并分泌的生物活性多肽,也是迄今为止发现的唯一具有负性调铁作用的生物素[1]。目前,相关铁代谢与慢性病毒性肝炎的研究主要集中在丙型肝炎[2,3],而对乙型肝炎病毒(HBV)感染者体内铁调素与铁代谢变化规律的研究仍存在争议。为探究CHB患者血清铁调素和铁代谢指标变化的临床价值,我们比较了CHB患者与健康体检者血清铁调素和铁代谢指标的变化,现将结果报道如下。
1 资料与方法
1.1 研究对象 2017年4月~9月安徽医科大学第二附属医院治疗的慢性乙型肝炎患者71例,男性39例,女性32例;年龄为(36.83±10.08)岁。诊断符合2015年颁布的《慢性乙型肝炎防治指南》的诊断标准,所有患者均未接受过干扰素治疗。排除标准: 合并其他病毒性肝炎、肝癌 、遗传性 、缺铁性疾病或既往有铁代谢紊乱疾病的HBV感染者。另选24例健康体检者,男、女各12例,平均年龄为(35.70±13.24)岁作为对照,经检测排除各类肝炎的存在,无心、肝、肺、肾等疾病。患者组与健康健康人在年龄和性别方面差别均无统计学意义(P>0.05)。
1.2 检测方法 使用全自动生化分析仪(Dimension EXL with LM,德国西门子公司)检测生化指标;使用全自动蛋白分析仪(BN ProSpec,德国西门子公司)检测铁代谢指标【血清铁(SI)、铁蛋白(Ferr)、转铁蛋白(Tf)】;采用ELISA法检测血清Hepc(武汉基因美生物公司,美国伯腾仪器有限公司生产的SynergyH4酶标仪,在475nm波长下读取OD值,并计算铁调素水平);使用电化学发光全自动免疫分析仪(Cobas e 601,瑞士罗氏公司)检测血清IL-6;采用荧光定量PCR法测定血清HBV DNA水平(上海复星医药核酸提取试剂盒,Agilent Stratagene,California,USA)。
1.3 细胞培养与质粒转染 以含有100 U/mL青霉素、100 μg/mL链霉素、10%胎牛血清的DMEM对Huh7细胞(上海富亨细胞库)在37℃、5%CO2培养箱中培养,取对数生长期细胞,接种于 6孔板,调整每孔细胞数约为1×106。取具备乙型肝炎病毒全基因组的pC1.3质粒1.8 μg,混合脂质载体(Thermo Scientific,USA) 2μL,静置20 min,转染接种于6孔板24 h,培养Huh7细胞,达到80%融合;以等量的空载质粒(pBlue-ks)转染Huh7细胞,作为空白对照,在37℃、5%CO2培养箱中培养6 h,换液,继续培养24 h和48 h。
1.4 细胞铁调素mRNA水平检测 采用RT-qPCR法,在6孔板,分别转染细胞24 h和48 h,用TRIzol(Thermo Scientific,USA)提取肝细胞总RNA。测量RNA样品的纯度后,根据操作说明,使用逆转录试剂盒 (Thermo Scientific,USA)将RNA逆转录成cDNA,使用cDNA作为模板,采用PCR法扩增铁调素基因,引物序列 F: ATGTTCCAGAGGCGAAGGAG,R: CTACGTCTTGCAGCACATCC;选择β-actin(引物序列F:GGGAAATCGTGCGTGACATTAAGG, R:CAGGAAGGAAGGCTGGAAGAGTG)作为参考基因。使用Agilent Stratagene M×3000P荧光定量PCR系统进行测定。靶基因引物由安徽欣乐生物科技有限公司设计并合成。
1.5 细胞铁调素蛋白表达检测 采用Western blot法,在6孔板转染48 h,使用裂解缓冲液制备全细胞蛋白裂解物。采用BCA蛋白质定量试剂盒测定蛋白质浓度。随后,加入缓冲液到全细胞蛋白裂解物中(缓冲液与裂解物体积为1:4)。然后,100℃煮沸10 min,使用10%~15%SDS-PAGE电泳分离20 μg总蛋白,并转移到聚二氟乙烯(PVDF)膜上。5%脱脂奶粉封闭2 h。将膜洗涤3次,分别加抗人铁调素抗体(Abcam,UK)和抗人β-actin抗体(Abcam,UK),在4℃温育过夜。洗涤后,将膜与1:5000稀释的辣根过氧化物酶偶联的抗小鼠或抗兔二抗(北京中山金桥)在室温下孵育1 h,洗涤。采用化学发光法使蛋白条带可视化,用显影仪对显影蛋白条带图进行拍照保存,以并β-actin为内参,应用Image J软件分析蛋白条带灰度值,重复检测3次。

2 结果
2.1 CHB患者与健康人血清学指标比较 与健康人比, CHB患者血清SI、Ferr、ALT、AST、TBIL和IL-6水平显著升高,而血清Hepc、Tf、sTfR和ALB水平显著降低,差异有统计学意义(P<0.05,表1)。
2.2 不同炎症活动度CHB患者铁代谢及铁调素水平比较 肝组织中度炎症活动组患者血清SI和Ferr水平显著高于,血清Hepc显著低于轻度组,差异有统计学意义(P<0.05);重度炎症活动组血清SI和Ferr水平显著高于,而血清Tf和Hepc水平显著低于轻中度活动组,差异有统计学意义(P<0.05,表2)。

表2 不同肝组织炎症活动CHB患者铁调素和铁代谢指标【 M(interquartile range)】比较
与轻度炎症活动组比,①P<0.05;与中度炎症活动组比,②P<0.05
2.3 HBV感染细胞铁调素水平变化 在质粒转染Huh7细胞24 h和48 h后,Hepc mRNA相对水平为(5.21±0.43),较空载体质粒转染组的(0.73±0.14)显著升高;在48 h,病毒质粒转染细胞Hepc mRNA水平为(8.45±0.61),较空载体质粒转染组细胞的(1.16±0.17)显著升高,差异有统计学意义(P<0.05,图1);转染质粒48 h后,转染病毒组细胞hepc蛋白相对表达量较空白组显著升高,差异有统计学意义(P<0.05,图2)。
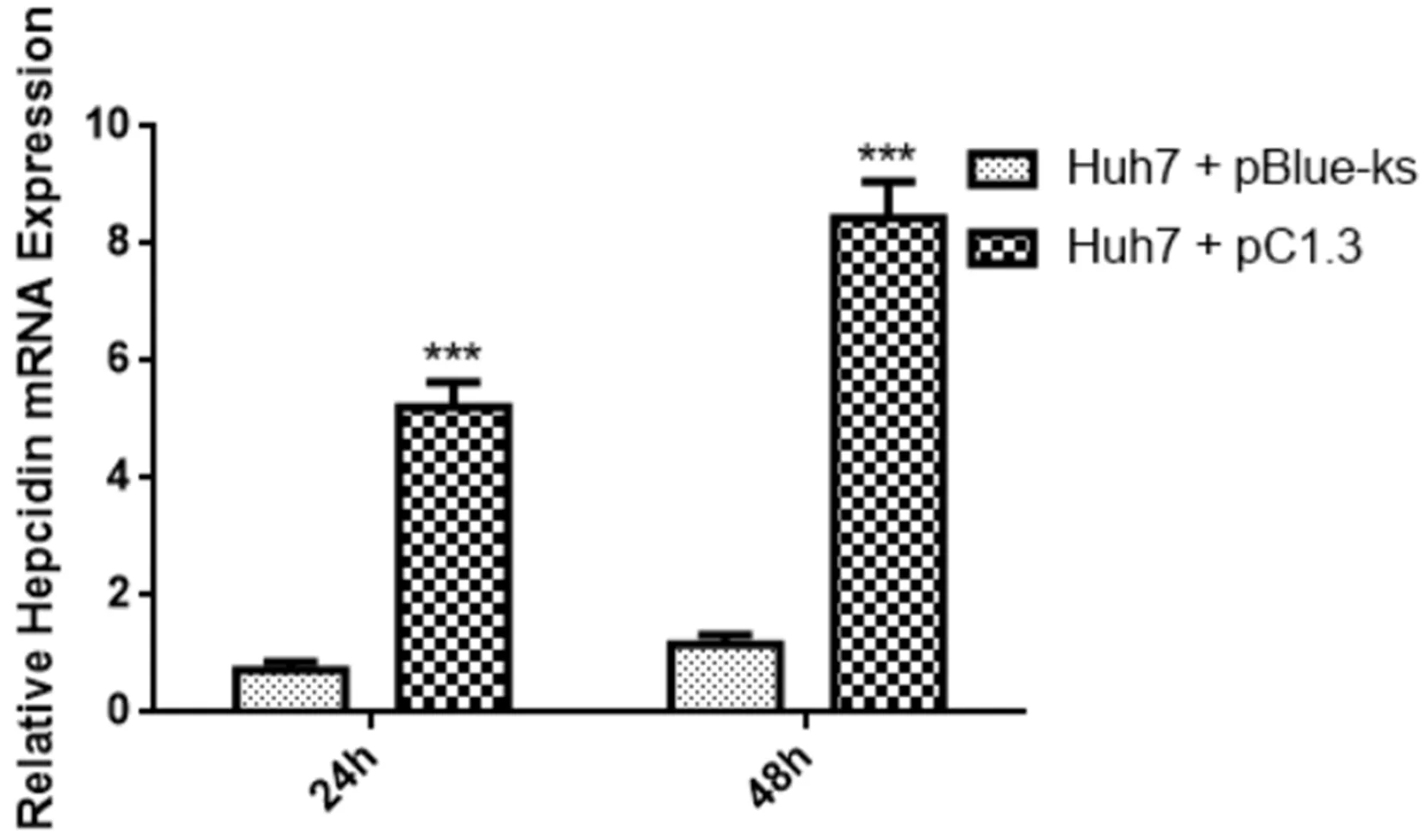
图1 转染细胞Hepcidin mRNA水平
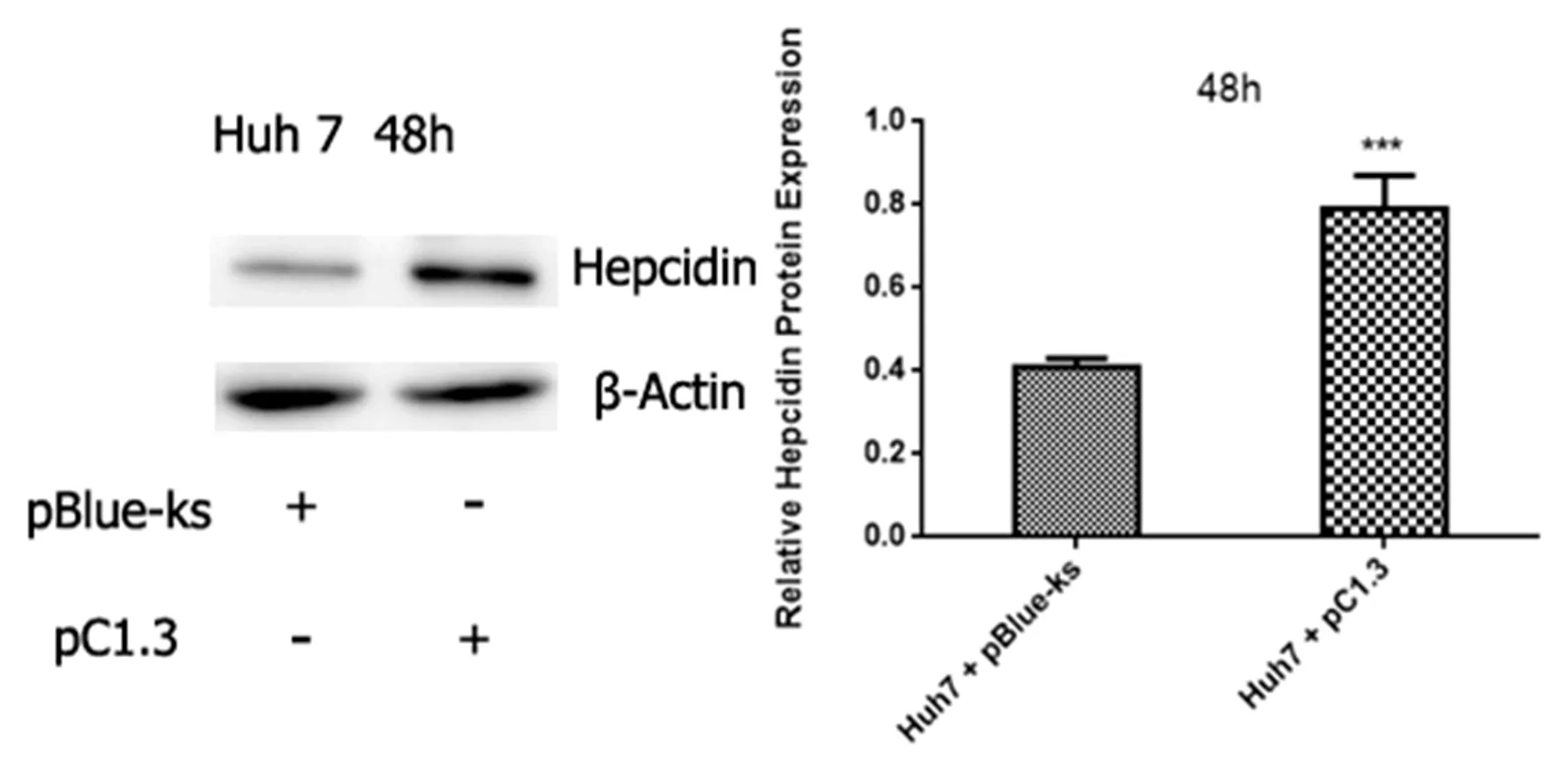
图2 转染48 h细胞Hepcidin蛋白相对表达量
3 讨论
已有文献报道CHB患者体内存在不同程度的铁代谢紊乱[4]。据本研究结果显示随着CHB患者肝组织炎症活动度加重,患者体内铁超载进行性加重,有关报道[5,6]研究结果一致。故检测血清铁调素水平及铁代谢相关指标有助于评估CHB患者的病情进展。
HBV DNA载量多用于确定感染性、判断治疗指征、确定耐药性的出现以及诊断隐匿性HBV感染[7]。ALB和TBIL是体现肝脏合成与转化能力的指标[8]。本研究结果显示病毒复制及肝脏合成功能降低与血清铁调素水平降低显著相关。然而,在我们构建的HBV感染肝细胞模型中,通过检测Hepc mRNA及其蛋白的相对表达情况,我们发现在肝细胞感染HBV后铁调素水平显著升高,此结果与本研究中发现的CHB患者血清铁调素显著降低相矛盾。我们在体外实验结果证明了HBV感染可刺激铁调素的表达。既往研究证明HBV感染本身并不会引起肝细胞损伤,而是由HBV感染引起的宿主炎症反应和T细胞免疫应答所致[9]。所以,体外HBV感染肝细胞后细胞损伤程度远低于体内,大量的肝细胞损伤会引起肝脏合成能力的降低。血清铁调素与血清白蛋白的合成有关,说明在HBV感染过程中体内大量肝细胞损伤引起了肝脏对铁调素合成能力的下降。此外,本研究CHB患者血清IL-6水平升高而铁调素水平减低,显示正向调控铁调素的细胞因子IL-6的升高并没有引起体内铁调素的升高,反而出现体内铁调素水平的减低。这是由于HBV复制引起的免疫反应干扰了体内复杂细胞因子及信号网络的正常功能[10],包括STAT3和BMP/SMAD在内共同调控铁调素表达的多种信号通路受到了影响。总之,我们认为在体内铁调素表达的正调节因子作用可能被负调节因子作用所掩盖,但具体机制仍有待探索。经以上分析我们推测HBV感染者体内铁调素表达降低为患者体内铁超载的重要原因之一【11-15】。
我们的研究证明了检测铁调素及其铁代谢相关指标有助于评估慢性乙型肝炎患者病情进展,并推测出铁调素持续低水平为导致CHB患者肝内铁超载的重要原因之一。对于CHB相关铁超载适当的去铁治疗至关重要。目前,静脉切开术和去铁胺输注已用于临床治疗铁超载。然而,这两种方案存在诸多不良反应。我们的研究结果提示提高血清铁调素水平可以用于HBV感染相关铁超载的去铁治疗。但人工合成铁调素不仅价格昂贵且具有一定的药理学性质成分不宜药用,近期研究发现使用合成的minihepcidins已经避免了这些问题[16-19]。此外,还可以通过增强内源性铁调素的产生来提高血清铁调素水平。目前,已报道的内源性激活铁调素表达的治疗策略有TMPRSS6失活剂[13]和BMP6激动剂[14]两种。总之,我们不仅可以通过检测铁调素及其铁代谢相关指标帮助评估慢性乙型肝炎患者病情进展,而且适当予以铁调素或者其相应内源性激活剂可针对性地治疗CHB患者相关铁超载问题,从而延缓病情进展。
