慢病毒介导miR-203过表达对酒精性肝病大鼠肝损伤的保护作用及其机制研究*
2020-04-29黄橘村胡东辉张建军田德英
黄橘村,胡东辉,张建军,田德英
MicroRNA-203( miR-203)是miRNAs家族中重要的成员。MiR-203位于人染色体14q32.33,该区域属于不稳定区域,编码人类约12%miRNA[1]。研究发现,miR-203与肿瘤的发生发展密切相关,miR-203过表达后有抑癌作用[2]。也有研究表明,miR-203对于人类皮肤的形态发育和功能维持有调控作用[3]。目前,关于miR-203的研究很多,但是miR-203对酒精性肝病(alcoholic liver disease, ALD)影响的研究还较少。ALD主要包括酒精性脂肪肝、酒精性肝炎和酒精性肝硬化等,其主要的致病原因就是长期过量饮酒。研究发现,ALD与机体的氧化应激、细胞转化因子表达和炎症介质释放等有关[4]。本研究采用慢病毒介导miR-203过表达观察了ALD大鼠肝组织氧化损伤和炎症反应的变化,以探讨miR-203参与ALD发病的机制。
1 材料与方法
1.1 动物、仪器与试剂 SPF级雄性SD大鼠,体质量180~220 g(由湖南长沙市天勤生物技术有限公司提供,动物质量合格证编号:43006700005608)。相差显微镜(Leica),多功能酶标仪(Thermo Scientific MultiSkan Go),PCR分析仪(苏州东胜兴业科学仪器有限公司),电泳仪电源(Tanon),全自动生化分析仪(日本日立公司)。红星二锅头酒(北京红星股份有限公司,批号:6906785230165)。miR-203慢病毒质粒(上海吉玛基因股份有限公司)。检测丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)和总胆红素(TBIL)试剂盒(北京利德曼生化技术有限公司)。检测超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和丙二醛(MDA)试剂盒(南京建成生物工程研究所)。抗-actin抗体(PTG)、抗NF-κB和抗IL-1β抗体(Abcam)。BCA蛋白浓度测定试剂盒(Beyotime Biotechnology)。
1.2 慢病毒介导的miR-203过表达和ALD大鼠模型的建立[5]取60只SD大鼠,随机分为A组:即ALD组,B组:即NC-miRNA/ALD和C组:即miR-203/ALD。在建立ALD大鼠模型前,在B组大鼠,使用胰岛素注射器通过尾静脉注射NC-miRNA慢病毒空质粒,作为阴性对照,在C组大鼠,注入miR-203慢病毒表达质粒。在病毒感染后第1 d,给予各组大鼠随意饮用5%酒精,连续3 d,第4 d换成10%酒精,以后每隔1 w增加2%酒精浓度,直至达到22%酒精。自饮用22%酒精开始,给予54%酒精2 mL.d-1分3次灌胃,连续8 w。
1.3 大鼠肝组织miR-203水平检测 在造模8 w,麻醉处死大鼠,取肝组织,置于10%福尔马林溶液中固定,行石蜡包埋、切片、HE染色,并在光镜下观察。另取肝组织,采用TaKaRa MiniBEST Universal RNA Extraction Kit提取RNA,采用TaqMan Small RNA Assays行miR-203逆转录反应,再采用Realtime PCR法检测,采用2-ΔΔCt法计算miR-203水平。正向引物序列:5’GUGAAAUGUUUAGGACCACUAG-3’,反向引物序列:5’-CCAGUGGUUCUUAACAGUUCAAC-3’。
1.4 肝组织匀浆SOD、CAT和MDA检测 在造模8 w处死大鼠,取新鲜的肝组织匀浆,采用ELISA法检测。
1.5 肝组织IL-1β和细胞核NF-κB蛋白表达检测 另取肝组织,分别采用细胞核提取试剂盒或普通组织裂解液裂解肝组织,低温离心,取上清液采用BCA试剂盒进行蛋白定量,配胶,采用Western Blot法检测,经琼脂糖凝胶电泳,转膜,封闭,加一抗4℃过夜,加二抗孵育2 h,显影,进行半定量分析。

2 结果
2.1 各组ALD大鼠血生化指标变化的比较 C组动物血清AST、ALT和TBIL水平显著低于B组(P<0.05,表1)。

表1 各组大鼠血清生化指标比较
与其他两组比,①P<0.05
2.2 两组大鼠肝组织miR-203水平比较 在构建ALD模型8 w末,经Realtime PCR法检测发现,C组大鼠肝组织miR-203水平为(2.8±0.1),显著高于B组【(1.3±0.5),P<0.05】,表明慢病毒介导的miR-203过表达ALD大鼠模型成功建立。
2.3 各组肝组织病理学表现比较 A组大鼠肝细胞坏死、空泡变性,有炎性细胞浸润;B组动物肝组织与A组表现相似;C组大鼠肝小叶内偶见肝细胞坏死,有少量的炎性细胞浸润(图 1),结果表明miR-203过表达对于ALD大鼠肝组织损伤有明显的保护作用。
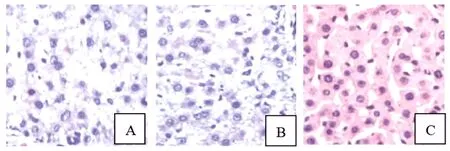
图1 三组大鼠肝组织形态学观察(HE,×400)
2.4 各组大鼠肝脏组织SOD、CAT和MDA水平比较 C组肝组织SOD和CAT水平显著高于,而MDA水平显著低于B组或A组(P<0.05,表2),说明miR-203过表达能显著提高肝组织的抗氧化能力,从而减轻肝损伤。

表2 各组大鼠肝组织SOD、CAT和MDA水平比较
与其他两组比,①P<0.05
2.5 各组大鼠肝组织NF-κB和IL-1β表达情况的比较 经Western Blot检测结果表明,A组和B组肝组织NF-κB和IL-1β蛋白表达水平均显著增强,说明导入空载体质粒对于肝损伤无明显影响。与B组比,C组肝组织IL-1β蛋白和NF-κB蛋白表达明显减弱(图2,表3),说明miR-203过表达后可能通过抗氧化和抗炎作用机制对肝组织起到了保护作用。
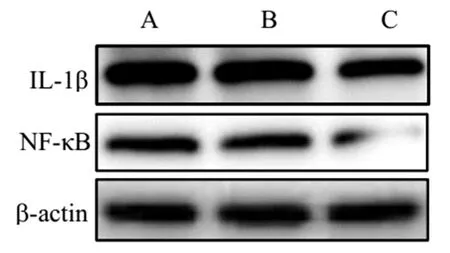
图2 各组肝组织NF-κB和IL-1β蛋白表达比较

表3 各组大鼠肝组织IL-1β和NF-κB蛋白比较
与其他两组比,①P<0.05
3 讨论
MiRNA是现代分子生物学领域里研究的热点[6]。随着研究的深入,miR-203的作用逐渐被发现被认知[7-10],miR-203在皮肤上皮组织生理、病理过程中有着重要的作用。MiR-203具有诱导细胞分化、促进细胞自噬、细胞凋亡和抑癌等作用,其在各种疾病中的具体作用都有待进一步阐明[11-14]。MiRNA203在ALD发病过程中的作用鲜有报道。有研究表明,miR-203对胃癌细胞的迁徙和细胞凋亡均有影响,能够促进胃癌细胞的凋亡,有抗胃癌的作用[15]。本研究表明,通过慢病毒转染大鼠miR-203,在大鼠肝脏组织中出现miR-203过表达,并且miR-203过表达后对于肝组织的病理损伤也能起到一定的保护作用。
一般将ALD分为急性和慢性肝损伤,严重酗酒或长期大量饮酒都会造成ALD。ALD的具体发病机制比较复杂,目前比较公认的发病机制有:乙醇及其代谢产物对肝脏有直接的毒副作用,乙醇还会诱导细胞发生氧化应激以及脂质过氧化,细胞在氧化应激的状态下会产生一些内毒素、细胞因子和炎性介质等介导的炎性反应。乙醇可能会使细胞缺氧,进而导致细胞损伤。但是,目前尚未有具体明确的致病机制[16]。在肝脏受到损伤时,ALT和AST会从细胞内渗出,释放到血液中。血清ALT、AST和TBIL水平升高在一定程度上能够反映肝细胞损伤的程度[17]。为了考察miR-203对ALD大鼠肝损伤的影响,我们检测了各组动物血清ALT、AST和TBIL水平,结果C组大鼠血清ALT、AST和TBIL水平比B组显著下降,提示miR-203具有保护肝细胞的作用,减轻了ALD动物肝细胞的损伤。ALD的损伤是很多因素共同导致的结果,其中还包括氧化应激反应、炎症、细胞凋亡、缺氧、细胞因子作用等。在ALD个体,乙醇会改变肠粘膜的通透性,引起胃粘膜损伤,进而抑制SOD和CAT的酶活性,并增加MDA的产量[18]。SOD、CAT和MDA是与细胞氧化应激相关的指标,为了进一步探讨miR-203对肝损伤的作用,我们又检测了肝组织损伤后一些指标的变化,结果发现C组与B组比,肝组织匀浆CAT和SOD含量明显升高,提示miR-203具有提高机体抗氧化能力。与B组相比,C组大鼠肝组织MDA含量显著降低(P<0.05)。MDA作为膜脂质过氧化物最重要的终产物,其含量反映了机体脂质过氧化程度,间接反映肝细胞的受损程度。乙醇过量会诱导NF-κB等转录因子的磷酸化和核转位,促使一些细胞因子的释放,如IL-1β和IL-6等。NF-κB是细胞中重要的转录因子,与炎性介质的转录表达和免疫反应的调控相关。当细胞处于正常状态时,NF-κB在胞浆中处于非活性状态,当细胞受到一些外部刺激如缺氧、氧化应激、炎症反应时,NF-κB均可被激活[19,20]。NF-κB会从胞浆中进入细胞核,从而使细胞核NF-κB明显增多。核NF-κB激活后会激活其他信号通路的相关蛋白,进而引起级联放大效应,会使人体出现更多的后续反应。为了考察miR-203的抗炎作用机制,我们采用Western Blot法检测了促炎因子IL-1β和核转录因子NF-κB水平,结果C组大鼠肝细胞NF-κB和IL-1β表达显著低于B组,实验结果提示miR-203与NF-κB和IL-1β相关的炎症反应有关。
综上所述,miR-203过表达对ALD动物肝损伤有明显的保护作用,其可能是通过抗氧化和抗炎作用,从而对ALD起到了保护作用。
