基因多态性检测对指导阿司匹林、氯吡格雷和西洛他唑应用于高危脑梗死治疗的有效性研究
2020-04-27江铮魏锋陈朋蒋小玲俞晓岚徐丽群黄美华
江铮 魏锋 陈朋 蒋小玲 俞晓岚 徐丽群 黄美华
【摘要】 目的:探讨基因多态性检测对指导阿司匹林、氯吡格雷和西洛他唑对治疗高危脑梗死患者是否具有临床意义。方法:本研究选取2017年10月-2018年10月在福州市第二医院住院的高危脑梗死患者,随机分为试验组(100例)和对照组(100例)。试验组通过基因多态性检测后推荐的药物治疗,对照组用目前指南中推荐的用药方法,于3、6、12個月后各观察1次,比较两组终点事件的发生率。结果:试验组12个月内发生终点事件发生率为0、1%、3%,明显低于对照组的12%、14%、15%,两组比较差异有统计学意义(P<0.05)。结论:基因多态性检测对指导临床医师选择阿司匹林、氯吡格雷和西洛他唑这三种我国目前最常用抗血小板聚集药物治疗高危脑梗死患者具有重要意义。
【关键词】 基因多态性检测 脑梗死 指导 阿司匹林 氯吡格雷 西洛他唑
[Abstract] Objective: To investigate whether genetic polymorphism detection has clinical significance in guiding Aspirin, Clopidogrel and Cilostazol in the treatment of patients with high-risk cerebral infarction. Method: Patients with high-risk cerebral infarction (without cerebral embolism) admitted to Fuzhou Second Hospital from October 2017 to October 2018 were randomly divided into experimental group (100 cases) and control group (100 cases). The experimental group received the recommended drug treatment after the genetic test, and the control group used the recommended method of administration in the current guidelines. Observed once every 3 , 6 and 12 months later,and then compare the incidence of endpoint events between the two groups. Result: The incidence of end point events within 3, 6, 12 months in the experimental group were 0, 1%, 3%, significantly lower than 12%, 14%, 15% in the control group, the differences were statistically significant (P<0.05). Conclusion: According to the above experiments, the detection of gene polymorphism is of great significance in guiding clinicians to select Aspirin, Clopidogrel and Cilostazol, three drugs most commonly used in China to treat high-risk cerebral infarction patients.
我国是一个卒中大国,据估算,我国每年新发脑血管病患者有200万人之多,死于脑卒中的患者也高达150万人[1]。而缺血性卒中是最常见的脑卒中类型,约占全部脑卒中的60%~80%[2]。中国缺血性卒中复发率高,危害也更大。目前急性缺血性脑卒中病死率已跃居我国居民死因的首位[3]。有统计中国缺血性卒中患者1年整体复发率为16%,高危患者[采用卒中风险评分量表(Essen stroke risk score,ESRS)进行评价,3~9分为高危患者]为20%,而复发性卒中具有更高的致残率、更高的死亡率[4]。由于针对血管性疾病[如缺血性卒中(CVD),冠状动脉疾病(CAD),外周动脉疾病(PAD)]患者使用的抗血小板聚集药物治疗后可能出现的“抵抗”现象[5],抗血小板聚集药物不能完全防止患者发生血栓并发症,国内外研究发现[6-7]:基因的多态性(SNPs)与“抵抗”密切相关,由于“抵抗”现象存在,有部分患者在用药后仍然发生缺血性脑卒中、心肌梗死、猝死等不良事件。本研究通过随机对照试验探讨基因多态性检测对指导阿司匹林、氯吡格雷和西洛他唑在治疗高危脑梗死患者中是否具有实用性,现报道如下。
1 资料与方法
1.1 一般资料
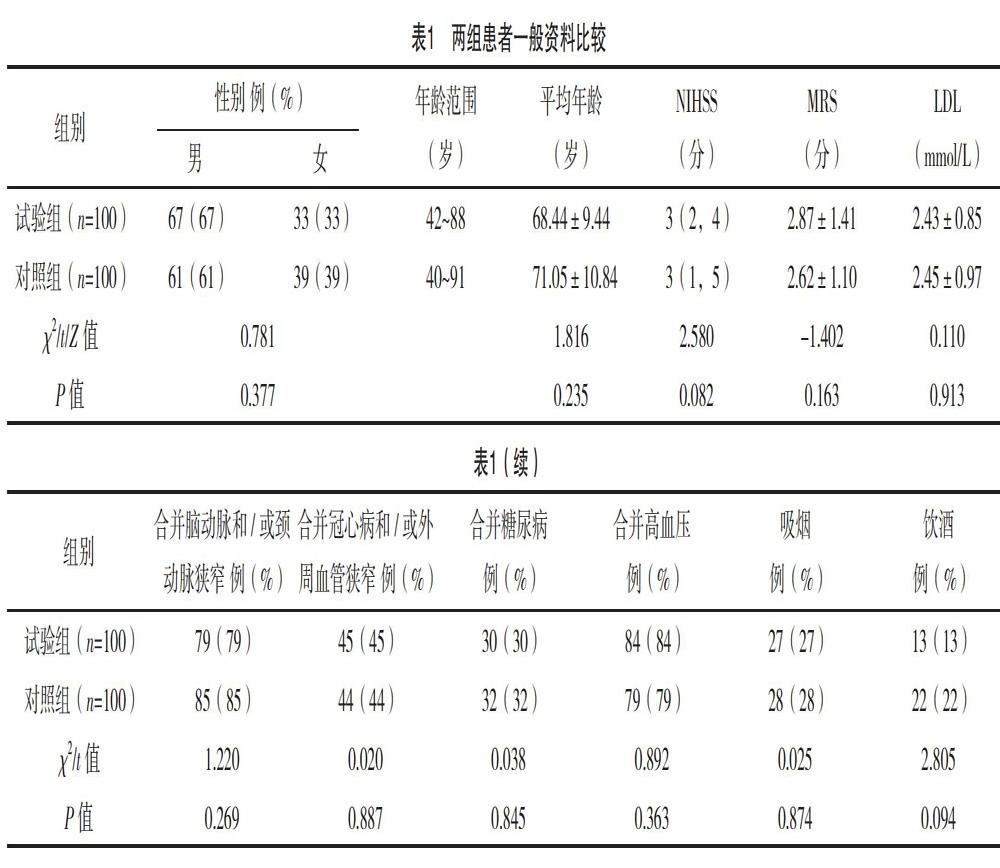
本研究选取2017年10月-2018年10月在福州市第二医院住院的脑梗死患者200例,纳入标准:符合1995年全国第四届脑血管病学术会议拟定的急性脑血管病诊断标准,并经头部CT和/或MRI检查确诊为脑梗死,且ESSEN评分>3分的高危患者[8];均为福州市汉族人口;无明显肝肾功能异常或者长期服用利尿剂病史。排除标准:影像学检查提示为出血性卒中;既往有房颤史或心电图和/或Holter提示心房颤动或阵发性心房颤动者;既往有心脏瓣膜病史或现经心脏彩超检查发现有风湿性心瓣膜病变者;脑梗死发病机制为心源性脑栓塞患者;血液系统、自身免疫性疾病或恶性肿瘤患者;三种药物均抵抗的患者。随机分为试验组(100例)和对照组(100例)。两组患者性别、年龄、NIHSS评分、MRS评分、LDL水平及合并脑动脉和/或颈动脉狭窄、合并冠心病和/或外周血管狭窄、合并高血压、糖尿病、吸烟、饮酒等一般资料比较,差异无统计学意义(P>0.05)。
1.2 方法
试验组基因检测方法及两组患者的药物选择:采用基因panel进行飞行时间-核酸质谱系统检测,通过基因检测后推荐的药物治疗,如三个药均没有抵抗,则依据目前指南中推荐的用药方法:如阿司匹林(生产厂家:拜耳医药保健有限公司,国药准字J20171021)抵抗或出血可能性大,而氯吡格雷没有抵抗,则选用氯吡格雷[生產厂家:赛诺菲(杭州)制药有限公司,国药准字J20130083]75 mg/d;如氯吡格雷抵抗,而阿司匹林没有抵抗,则选用阿司匹林100 mg/d;如阿司匹林及氯吡格雷均有抵抗,而西洛他唑(生产厂家:浙江大冢制药有限公司,国药准字H10960014)没有抵抗,则选用西洛他唑100 mg,2次/d。
对照组采用目前指南中推荐的用药方法,根据《中国缺血性卒中和短暂性脑缺血发作二级预防指南2014》,阿司匹林100 mg/d或氯吡格雷75 mg/d单药治疗均可以作为首选抗血小板药物,西洛他唑100 mg,2次/d可作为阿司匹林和氯吡格雷的替代药物。另外依据个体化选择原则,高危患者首选氯吡格雷,无须进行基因检测。
同时两组仍然予降脂(他汀类)、降压、降糖及改善生活方式等治疗。
1.3 观察指标
比较两组终点事件发生率。主要终点:致死性或非致死性缺血性卒中、短暂性脑缺血发作(TIA)、心肌梗死、不稳定型心绞痛、心力衰竭、冠脉介入治疗、血管性死亡。次要终点:出血性卒中、消化道出血、无法耐受的消化道不适症状(如腹泻、腹痛、腹胀等)、持续性血尿、持续性鼻出血。于3、6、12个月内各观察1次,如有终点事件发生,再询问其终点事件发生的具体过程及具体时间。
1.4 统计学处理
应用SPSS 19.0 for Windows统计学软件进行数据处理,尺度变量年龄、MRS、LDL等符合正态分布的计量资料以(x±s)表示,进行独立样本t检验,尺度变量NIHSS符合偏态分布,以中位数M(P25,P75)表示,采用秩和检验,分类变量中,合并脑动脉和/或颈动脉狭窄、合并冠心病和/或外周血管狭窄、合并糖尿病、合并高血压、吸烟、饮酒等计数资料以率(%)表示,组间比较采用字2检验,以P<0.05为差异有统计学意义。
2 结果
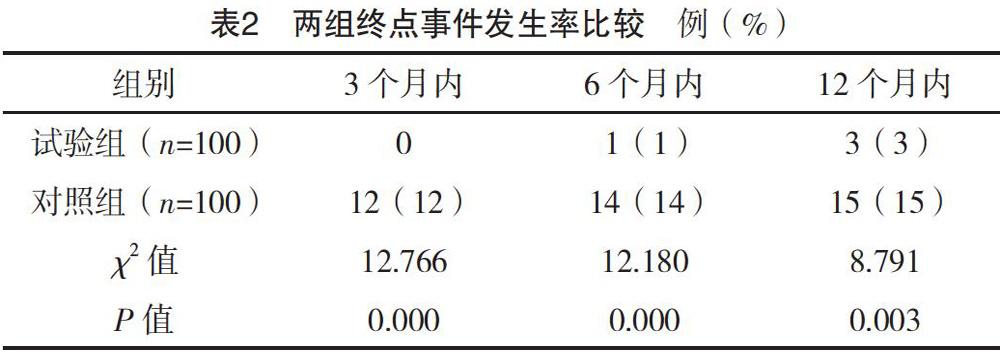
两组患者均未出现出血性卒中、消化道出血、无法耐受的消化道不适症状(如腹泻、腹痛、腹胀等)、持续性血尿、持续性鼻出血等次要终点事件,试验组患者在3、6、12个月内终点事件的发生率明显低于对照组,差异有统计学意义(P<0.05),见表2。
3 讨论
过去30年里,我国脑卒中发病率持续增长,随着社会老龄化和城市化进程的不断加快,脑卒中发病率急剧攀升,据推测,2030年我国脑血管病事件发生率将比2010年升高约50%[9-10]。脑卒中是我国成年人致死、致残的首位病因[11]。脑卒中分为出血性脑卒中和缺血性脑卒中两大类,2010 年全球缺血性脑卒中发病约1 156万例,损失3 938万伤残调整生命年( disability adjusted of life years,DALYs) ,疾病负担沉重[12]。阿司匹林、氯吡格雷和西洛他唑是我国临床上最常用的三种抗血小板药物,可有效地降低血栓栓塞性疾病的发生。目前,阿司匹林及氯吡格雷已经成为抗血小板聚集治疗的基石,是各种指南推荐、临床上最常用的动脉硬化性心血管病(ASCVD)抗栓治疗方案。
阿司匹林抗血小板聚集的机制是通过对环氧酶(COX)-1的作用直接抑制血栓素A2(TXA2)合成,抑制血小板黏附聚集活性。国外一些研究显示,对阿司匹林的响应因人种的不同而有所差异,在健康的高加索人群和非洲人群中,对阿司匹林抵抗率在0.266~0.762[13]。现有文献[14-15]研究发现,GPⅡb/GPⅢa,GPⅠa/GPⅡa,GPⅥ、GPⅠba、COX-1和COX-2、P2Y1、P2Y12等基因的突变与阿司匹林的抵抗有一定的关联性。
氯吡格雷主要经CYP2C19代谢活化后发挥抗血小板效应。有研究证实了在氯吡格雷治疗的急性缺血性卒中/TIA患者中,携带CYP2C19等位基因功能缺失的患者比未携带的患者,发生卒中和复合血管事件的风险更高[16]。据相关研究统计,85%的高加索人和几乎100%的东亚人种的相关弱代谢遗传缺陷是CYP2C19*2和CYP2C19*3两个基因位点突变所致,与氯吡格雷的抵抗具有显著相关性[17]。大多数的国内外研究均以服药后ADP诱导的最大血小板聚集率较基线水平下降小于10%,定义为氯吡格雷抵抗,也有研究则将氯吡格雷治疗后残余有活性的血小板数量>70%,定义为氯吡格雷抵抗[18]。国外有文献[19]报道服用氯吡格雷后抵抗的发生率为4%~31%。
西洛他唑,其化学名称为6-[4-(1-环己基-1H-戊四唑-5-基)丁氧基]-3,4-二氢-2(1H)-喹诺酮,亦可抑制血小板聚集,具有抗栓作用。CYP3A5基因编码细胞色素P450 3A5。CYP3A5基因多态性影响个体对西洛他唑的代谢能力。CYP3A5*1/*1双体型的个体相比于CYP3A5*3/*3对西洛他唑的代谢能力增强;CYP3A5*1/*3的个体相比于CYP3A5 *3/*3对西洛他唑的代谢能力增强,而相比于CYP3A5*1/*1对西洛他唑的代谢能力减弱。在CYP3A5基因型为*3/*3(CC)的个体中,CYP2C19基因的多态性影响西洛他唑的代谢活性[20]。
药物基因学的最终目标是改进药物的功效和安全性,从而可以采用药物基因学进行指导治疗和预防。目前美国FDA和我国食品药品监督管理局(CFDA)都已批准了一系列的个体化用药基因诊断试剂盒。这些试剂盒基本都是对人DNA样本进行基因检测。美国FDA已批准在140余种药物的药品标签中增加药物基因组信息,涉及的药物基因组生物标记物42个[21]。2015年我国制定了《药物代谢酶和药物作用靶点基因检测技术指南》,同样通过检测药物作用靶点,指导临床医生合理用药。
本次研究结果显示:试验组患者在3、6、12个月内终点事件的发生率明显低于对照组,差异有统计学意义(P<0.05),分析为基因检测后推荐的药物治疗比目前指南中推荐的用药方法可以更有针对性地给药,因而可以有效地控制病情。本次研究基因位点更多,更能准确地评价基因多态性对“抵抗”的影响。同时采用MassArray质谱检测技术来揭示与抗血小板药物“抵抗”相关的基因和高频突变位点。该方法较传统PCR方法检测灵敏度高、特异性好,且Array技术的可延展性的特征、数据准确性更高、更经济及高效等优点,也明显优于传统的Sanger PCR测序法和实时荧光PCR法。同时基于基因多态性的检测针对的是遗传物质DNA,并非其他生理生化指标,所以相比现有的体外血小板聚集实验,更加客观,稳定,成本更低廉,只需检测一次,无须实时跟踪检测。
文献[22]回顾2005-2013年的15篇队列研究,包括美国、英国、芬兰、日本、韩国、中国六个国家的数据,脑卒中的1年复发率为3.0%~17.7%,我国报道的复发率为12.7%~17.7%,处于较高水平,芬兰的复发率最低(3.0%)。本研究发现对照组12个月内终点事件的发生率为15%,与我国脑卒中复发现状接近,试验组患者通过基因检测后服用推荐的药物治疗,12个月内终点事件的发生率为3%,接近于其他的发达国家的最低水平,在3、6、12个月内主要终点事件的发生率均较对照组低。
综上所述,基因多态性检测对指导临床医师在选择阿司匹林、氯吡格雷和西洛他唑这三种我国目前最常用抗血小板聚集药物治疗高危脑梗死患者方面有重要意义,可为基因检测应用于指导治疗风险最大、治疗窗最窄的脑梗死患者的抗血小板药物的治疗方案提供试验数据和理论依据,便于筛查氯吡格雷及阿司匹林抵抗的高危人群,指导医生个体化精准用药,避免不良事件发生,具有重大的社会效益和经济效益。
参考文献
[1]吴江,贾建平,崔丽英,等.神经病学[M].第2版.北京:人民卫生出版社,2010:166-167.
[2]中华医学会神经病学分会脑血管病学组急性缺血性脑卒中指南撰写组.中国急性缺血性脑卒中诊治指南2010[J].中华神经科杂志,2010,43(2):146-152.
[3]中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国缺血性脑卒中风险评估量表使用专家共识[J].中华神经科杂志,2016,49(7):519-525.
[4] Meng X,Wang Y,Zhao X,et al.Validation of the Essen Stroke Risk Score and the Stroke Prognosis Instrument Ⅱ in Chinese patients[J].Stroke,2011,42:3619-3620.
[5]崔嬋娟,乔蕊,张捷.抗血小板药物“治疗无反应”的研究进展[J].检验医学,2015,30(12):1257-1262.
[6] Fitzgerald R,Pirmohamed M.Aspirin resistance:Effect of clinical,biochemical and genetic factors[J].Pharmacology & Therapeutics,2011,130(2):213-225.
[7] Buonamici P,Marcucci R,Migliorini A,et al.Impact of Platelet Reactivity After Clopidogrel Administration on Drug-eluting Stent Thrombosis[J].Journal of the American College of Cardiology,2007,49(24):2312-2317.
[8]全国第四届脑血管疾病学术会议.各种脑血管疾病诊断要点[J].中华神经科杂志,1996,29(6):379.
[9] Anthony S K, Elizabeth C,Natalie T C.Global Stroke Belt:Geographic Variation in Stroke Burden Worldwide[J].Stroke,2015,46(12):3564-3570.
[10] Moran,A,Gu,D,Zhao,D,et al.Future Cardiovascular Disease in China:Markov Model and Risk Factor Scenario Projections From the Coronary Heart Disease Policy Model-China[J].Circulation Cardiovascular Quality & Outcomes,2010,3(3):243-252.
[11]王陇德,刘建民,杨弋,等.我国脑卒中防治仍面临巨大挑战——《中国脑卒中防治报告2018》概要[J].中国循环杂志,2019,34(2):6-20.
[12] Derrick A B,Rita V K,Suzanne B,et al.The Global Burden of Ischemic Stroke:Findings of the GBD 2010 Study[J].Global Heart,2014,9(1):107-112.
[13] Levy K D,Pratt V M,Skaar T C,et al.FDAs draft guidance on laboratory-developed tests increases clinical and economic risk to adoption of pharmacogenetic testing[J].J Clin Pharmacol,2015,55(7):725-727.
[14] Faraday N,Yanek L R,Mathias R,et al.Heritability of platelet responsiveness to aspirin in activation pathways directly and indirectly related to cyclooxygenase-1[J].Circulation,2007,115(19):2490-2496.
[15] Hankey G J,Eikelboom J W.Aspirin resistance[J].Lancet,2006,367(9510):606-617.
[16] Pan Y,Chen W,Xu Y,et al.Genetic Polymorphisms and Clopidogrel Efficacy for Acute Ischemic Stroke or Transient Ischemic Attack:A Systematic Review and Meta-Analysis[J].Circulation,2017,135(1):21-33.
[17]蔡泓敏,陈珲,赵冠人,等.CYP2C19基因多态性与氯吡格雷抗凝作用的相关性研究[J].中国药物应用与监测,2013,10(5):254-257.
[18] Yang J,Yang Z.Research status of clopidogrel resistance on CYP2C19 gene polymoiphism [J].Journal of Clinical Cardiology(China),2012,28(6):163-165.
[19]柳亚敏,刘乃丰.氯吡格雷反应变异性的临床及基因学研究进展[J].中华心血管病,2010,38(8):759-762.
[20] Yoo H D,Park S A,Cho H Y,et al.Influence of CYP3A and CYP2C19 genetic polymorphisms on the pharmacokinetics of cilostazol in healthy subjects[J].Clin Pharmacol Ther,2009,86(3):281-284.
[21] Levy K D,Pratt V M,Skaar T C,et al.FDAs draft guidance on laboratory-developed tests increases clinical and economic risk to adoption of pharmacogenetic testing[J].J Clin Pharmacol,2015,55(7):725-727.
[22]唐美蓮.中国脑卒中住院患者危险因素分布特征、首发患者四年累积复发率及其影响因素的研究[D].北京:首都医科大学,2016:56-57.
(收稿日期:2019-11-08) (本文编辑:郎序莹)
