胰腺多形性未分化肉瘤:病例报告与文献回顾
2020-04-27王子航孟兴凯张俊晶
王子航,孟兴凯,张俊晶
(内蒙古医科大学附属医院 肝胆外科,内蒙古 呼和浩特 010000)
多形性未分化肉瘤(undifferentiated pleomorphic sarcoma,UPS),既往称为恶性纤维组织细胞瘤(malignant fibrous histiocytoma,MFH)是一种间叶源性恶性肿瘤,占所有软组织肉瘤的20%以上,多发生于四肢、躯干及腹膜后[1]。发生于胰腺的UPS极为罕见。国内、外虽有报道,但多以个案形式报道,缺少大宗病例资料进行分析。现就内蒙古医科大学附属医院肝胆外科收治的1例胰腺UPS并结合国内外文献以探讨其诊疗与预后。
1 资料与方法
1.1 病例资料
患者 男 42岁,既往体健,以“反复上腹部疼痛2月余”入院。入院辅助检查:肿瘤标记物:CEA 0.60 ng/mL,CA1-99 24.46 ng/mL,CA-125 7.00 ng/mL,入院时血红蛋白,凝血,生化,肝功正常。腹部增强CT(图1A):胰腺体部占位,考虑良性可能。上腹部MRI(图1B-C)提示:胰腺颈部可见一类圆形长T1、混杂T2信号影,DWI呈不均匀高信号影,大小约3.4 cm×3.1 cm,病变边界尚清,增强扫描:病变成轻度不均匀强化。主胰管通畅,未见扩张。
完善术前准备后于2018年3月13日行剖腹探查及肿瘤切除术,术中超声刀离断胃结肠韧带后,胰腺上方第17组淋巴结肿大,直径约为1.5 cm,完整切除后送病理。肠系膜上动脉 左侧胰腺中段实质可见肿物,直径约3.5 cm,胰腺肿物远侧胰腺实质质硬,考虑为胰腺炎所致,胰头处实质质软,未触及异常。距肿物近、远端1 cm处完整切除肿物后送快速冰冻切片2次 ,均考虑为交界性肿瘤,术中与家属沟通后,行胰腺中段切除术、胰肠双吻合术[2](图2) 。术后淋巴结石蜡切片及免疫组化显示:(第17组淋巴结)淋巴组织增生,部分结构有破坏。苏木精-伊红染色法(HE)(图3A)及免疫组化结果支持UPS诊断,并侵袭神经纤维。 考虑患者年轻、肿瘤恶性程度高,加之其他方式方法缺乏或效果不明确,与家属沟通后,加行手术区域扩大切除术。于术后1个月再次行胰体尾联合脾脏切除术,二次术后4个月因肿瘤复发转移死亡(图3B)。
1.2 文献回顾
检索Pubmed、万方数据库,以“胰腺”、“恶性纤维组织细胞瘤或多形性未分化肉瘤”为检索词,经过查重,剩余31篇[1,3-32]。其中男19例,女12例;中位年龄55.1岁,按病理类型分为:巨细胞型9例,黏液型5例,多形性型17例。按发生部位则分为:胰头1 3 例,胰体尾1 2 例,胰体2 例,胰尾2 例,全胰腺2 例(表1)。其临床表现大多表现为软组织肿块进行性增大,进展较快,常伴有压迫症状,可伴有恶心呕吐,上腹部不适、腹胀,体质量减轻;根据肿瘤的发生部位,可伴有黄疸。
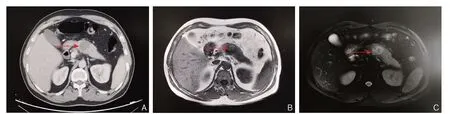
图1 术前影像学资料 A:上腹部CT 示胰腺体部占位,考虑良性可能(红色箭头示肿瘤位置);B:T1WI 可见胰颈部一类圆形病变,边界尚清(红色箭头示肿瘤位置);C:T2WI 可见胰颈部一类圆形病变,边界尚清,增强扫描呈不均匀强化的占位(红色箭头示肿瘤位置)Figure 1 Preoperative imaging data A: Upper abdominal CT scan showing occupying lesion in the body of the pancreas, which considered to be a benign lesion (the red arrow showing the tumor); B: A round-like lesion in the neck of pancreas from T1WI, with a relatively clear boundary (the red arrow showing the tumor); C: A round-like lesion in the neck of pancreas from T2WI, with a relatively clear boundary, and heterogeneous enhancement displayed by the enhanced scanning (the red arrow showing the tumor)
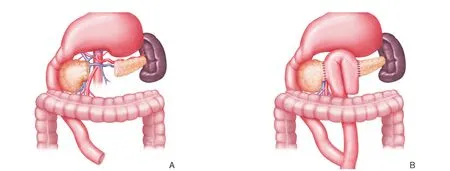
图2 手术方法示意图 A:胰腺中段切除术;B:胰肠双吻合术Figure 2 Schematic pictures of the procedure A: Middle segment pancreatectomy; B: Side-to-side anastomosis of the jejunal loop with the remaining pancreatic head and pancreatic body
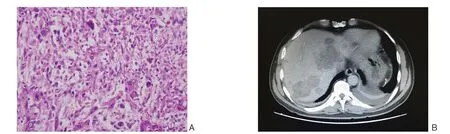
图3 术后资料 A:胰腺病理切片(HE×400);B:肝脏的多发转移瘤Figure 3 Postoperative data A: Pathological section of pancreatic tissue (HE ×400); B: Multiple liver metastases
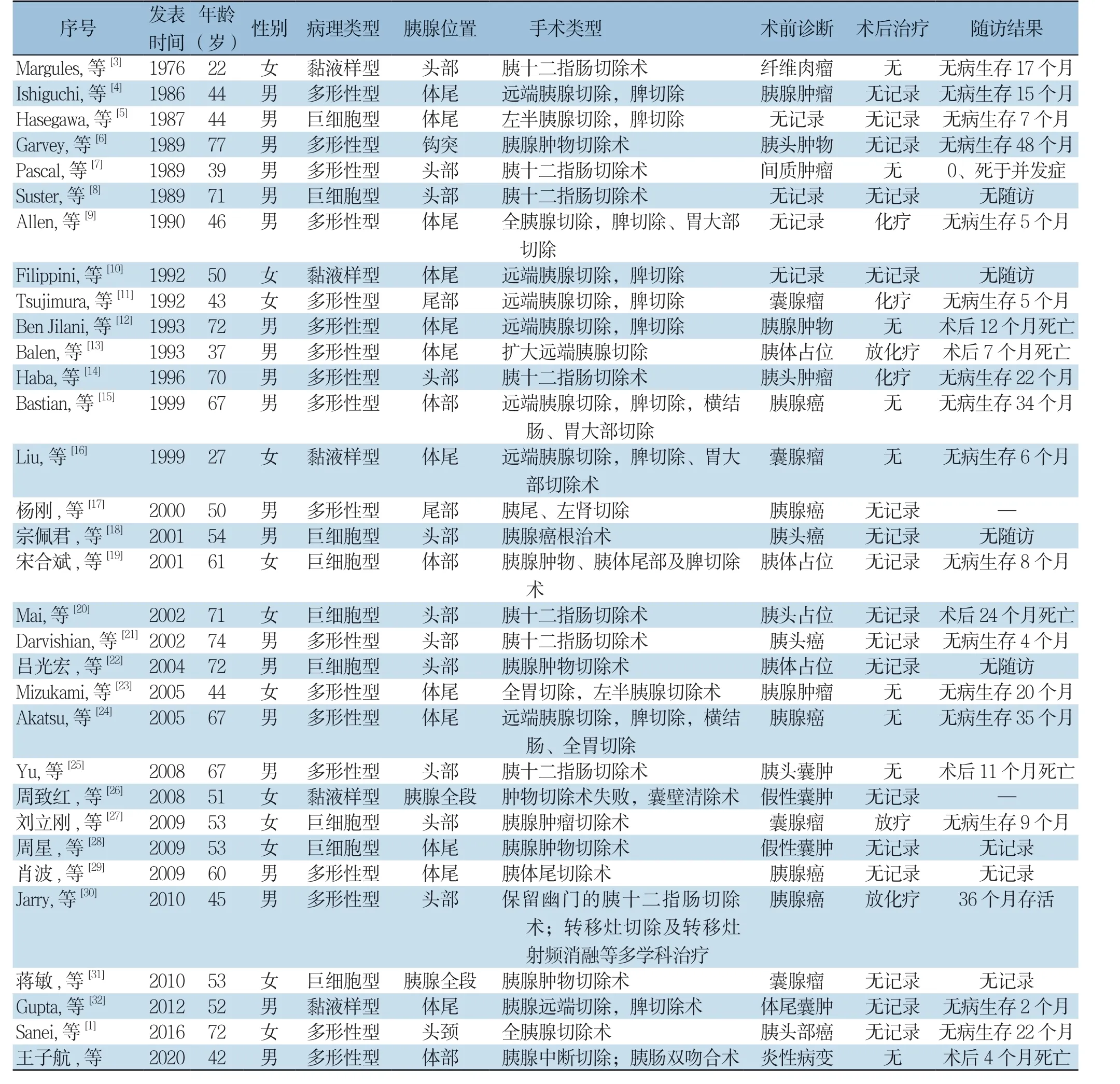
表1 32 例胰腺UPS 患者的临床资料Table 1 Clinical data of the 32 patients with pancreatic UPS
2 讨 论
UPS曾被称为MFH,指具有席纹状或车辐状排列生长方式的、由组织细胞分化而来的一组软组织肿瘤[33]。发生在胰腺上的UPS罕见。正如前言所述,大多以个案报道形式展现,通过检索权威数据库,加上我院病例共有32例,其起源、发病机制至今不明,相信随着病例数积累,会逐渐揭开UPS的神秘面纱。
原发于胰腺的UPS病理特征与机体其他部位的UPS的相同。大多数病例多以多形性肿瘤为主,以细胞学和细胞核多形性为特征。其中多形性,纤维母细胞,组织细胞样细胞和异型巨细胞以不同比例混合存在[30]。2 0 0 2 世界卫生组织将M F H在病理学上分为3类:⑴ 多形性型;⑵ 炎性型;⑶ 巨细胞型,并将黏液样型从中剔除[34]。本组数据显示,多形性型18例(56%),巨细胞型9例(28%),黏液样型5例(16%)。胰腺UPS临床表现多样,无特异性,这已在发表的文献里得到支持。影像学检查尤其是腹部CT检查和腹部MRI的检查有助于肿块的定位,其他检查如B超、X线等应用受限,纵观文献报道,结合本院病例,影像学表现是无特征性的,影响疾病的正确诊断,32例患者中术前无1例考虑胰腺UPS。我院腹部增强CT:胰腺体部占位,考虑良性。上腹部MRI提示:考虑胰颈部囊腺瘤。而文献回顾每一个病例都有个各自的影像学特点。所以,胰腺UPS在没有获取组织前诊断较为困难,这也可能和其他成分复杂、比例不同有关。
病理组织学检查仍是确诊该病的金标准,B超引导下穿刺活检术可提高术前诊断的准确性[35]。但为防止肿瘤的扩散和针头植入,不建议常规进行术前活检。对于不能手术,需要放疗或化疗的患者,可进行穿刺行病理学检查[36]。免疫组织化学检查主要作用是帮助排除其他常见肉瘤。主要与原发于胰腺的UPS相做鉴别[24,35,37-38]:⑴ 脂肪肉瘤;⑵ 平滑肌肉瘤;⑶ 神经母细胞瘤。上述的肿瘤均有特异性的标志物,可以通过免疫组化相作鉴别。对于免疫组化有必要指出的是,波形蛋白(vimentin)为间叶细胞的肿瘤标记物,而组织细胞性标志物(如a1-AT、lysozyme、CD68)对UPS诊断帮助意义则不大[35]。然而陈涛等[39]在报道指出了,对于波形蛋白及巨噬细胞(CD68)则是诊断UPS的极为重要的标志物,结合我院该患者免疫组化波形蛋白(弥漫3+)及CD68均显示为阳性,也支持陈等的观点。
国内外对于手术切除方式、术后是否进行放化疗及放化疗的疗效如何也未有相关的报道。有研究[40]认为:UPS属于软组织肉瘤,其具有局部浸润性生长、容易复发、区域淋巴结和血行转移相对较少的独特生物学行为,而在胰腺原发UPS可遵循软组织肉瘤的治疗原则,但我们从现有的病例发现,胰腺UPS可能恶性程度更高于其他部位的,这可能与胰腺本身环境有关。现有病例生存期最短4个月,是来自笔者单位患者,该患者生存时间较短的原因,笔者考虑由于以下几点因素造成:⑴ 未在术前行内镜超声引导穿刺病检,肿瘤型不类明确;⑵ 术中肿瘤的肉眼观及冰冻结果无法准确辨别肿瘤类型;⑶ 首次手术不彻底,未进行根治性切除;⑷ 二次手术前未进行详细的评估是否全身治疗或多学科讨论。手术选择的方式根据肿物所在的位置而定,位于胰头部选择胰腺十二指肠切除,位于胰体尾部选择胰体尾联合脾脏切除,全胰腺都有应选择全胰切除。笔者角度,不建议肿物局部切除,早期、完整切除,对于非胰头肿瘤以获得R0切除应是手术治疗的核心。笔者资料中首先采取胰腺中段切除,初衷是考虑患者年轻,保留胰腺功能,加之术前影像学检查、术中2次冷冻快速病检报告支持良性或者低度恶性诊断,故行使胰腺中段切除、胰肠双吻合术。术后石蜡切片、免疫组化确诊时,患者再次手术已然发生转移,给我们留下了过多思考。
对于胰腺UPS治疗,关键在于早期发现,及时治疗。除手术外,有文献报道采用放疗可能对胰腺UPS有一定的疗效,刘立刚等[27]为1例术后患者行放疗,随访周期内未见肿瘤复发。在其他部位发生UPS,有研究[41]发现,无法完整切除肿瘤或者是无法取得切缘阴性的情况下,放疗则是一种重要的辅助治疗手段。放疗也是具有高危复发因素软组织肉瘤有效的辅助治疗手段,可降低肿瘤的局部复发率[42],但由于目前胰腺UPS术后放疗例数非常有限,其他部位UPS治疗是否适用胰腺,尚缺乏大样本数据支持。对于已经转移的胰腺UPS,术后化疗因病例数少加之随访周期短,其效果亦不明确。在其他软组织肉瘤综合治疗方面,术后给予化疗的患者术后生存时间较未化疗的患者普遍延长,并且对于此类患者的化疗方案上查阅文献后,大多数将多柔比星及异环磷酰胺作为一线用药[27,33,40,43],而在胰腺UPS应采取何方案,已有的文献来看,均在探索与尝试。Jarry等[30]在文章中所提患者在第1次手术后11个月发生肝和肺转移,患者接受了化疗、放疗和右肝切除联合术中射频消融术的多学科治疗。在多学科治疗下,患者完全康复,并在术后25个月内保持无病状态,然仅为个案报道。来自其他临床报道并未显示明显优势[9, 11, 13]。
总之,胰腺UPS为高度恶性肿瘤,无明显特异性临床表现,极易发生转移及复发,预后差。完整手术切除治疗为目前最有效的治疗手段,术后给予放化疗可能能够改善患者的生存周期,尚需临床进一步验证。
