达氏鲟2种胰岛素样生长因子的克隆及其对饥饿胁迫的响应
2020-04-23陈叶雨赖见生宋明江
陈叶雨,刘 亚,赖见生,宋明江,龚 全
(四川省农业科学院水产研究所,四川 成都 611731)
【研究意义】胰岛素样生长因子(Insulin-like Growth Factor, IGF)是一类与胰岛素前体具有同源性的细胞增殖调控因子,由多种同源多肽组成,在细胞生长、分化、调节渗透压、繁殖、免疫应答和新陈代谢等过程中起着重要的作用[1-3]。自IGFs被发现具有生长调节的功能以来,IGF系统及其衍生功能也被相继发现和阐明,特别是IGFs参与肿瘤发生、发展及转移的分子网络越来越受到重视。【前人研究进展】1989年,Cao等[4]首次从鲑(Oncorhynchustshauytscha)中克隆得到IGF-1cDNA,随后金鱼(Carassiusauratus)[5]、银大麻哈鱼(Oncorhynchuskisutch)[3]、莫桑比克罗非鱼(Oreochromismossambicus)[6]、牙鲆(Paralichthysolivaceus)[7]、青鳉(Oryziaslatipes)[8]、虹鳟(O.mykiss)[9]、鲫(Carassiusaurat)[10]、哲罗鲑(Huchotaimen)[11]等IGF相关基因相继被克隆。随着研究深入,IGFs家族基因相继被发现,如斑马鱼(Daniorerio)性腺中存在IGF-1a、IGF-1b、IGF-2a和IGF-2b4种亚型[12-13],最近,家族基因IGF-3也在斑马鱼中被发现,且具有刺激生殖细胞分化、调节精巢和卵母细胞的发育等功能[14]。IGF-1和IGF-2主要通过IGF-1受体来刺激细胞反应,然而,其功能存在一定的差异[15]。IGF-1主要来源于肝脏,在生殖前期受生长激素GH调控,在鱼类肌肉生长和代谢中起到重要作用[16]。IGF-2参与卵黄的生成,主要作用于胚胎生长和发育阶段,不受生长激素调节[17]。【本研究切入点】达氏鲟,又名长江鲟,隶属鲟形目,鲟科,鲟属,为我国一级保护动物。受人为活动的影响,野生资源急剧下降,现阶段主要采取人工保育的方式进行种群的扩增[18]。虽然达氏鲟人工繁殖技术已获得突破,但其繁殖生理及生长特性的分子机理有待进一步挖掘。本研究通过克隆IGF-1和IGF-2基因,得到了其cDNA全长序列,并研究其在不同组织及饥饿胁迫作用下的表达模式。【拟解决的关键问题】本研究结果以期为进一步了解IGF-1和IGF-2在达氏鲟生殖生理和生长过程中的功能奠定基础,也为下一步良种选育提供理论依据。
1 材料与方法
1.1 实验材料
达氏鲟为四川省农业科学院水产研究所2018年繁殖的F2代,体重为(30±2)g。将实验鱼用MS-222进行麻醉,然后解剖。同时将心脏、肝脏、脾脏、肾脏、性腺、肌肉、肠、鳃、皮肤、眼、脑取出,液氮中速冻,然后置于-80 ℃冰箱保存。
1.2 RNA提取及cDNA合成
取上述组织30 mg左右于液氮中研磨,使用Trizol法提取总RNA,提取后取3 μl总RNA样品通过1.2 %琼脂糖凝胶电泳检测其质量和完整性,用超微量分光光度仪测定RNA样品的浓度和纯度。质量检测合格的RNA样品参照ReverTra Ace反转录试剂盒(TOYOBO, Japan)说明书合成第一链cDNA。
1.3 IFG-1和IFG-2基因克隆
利用本实验室前期达氏鲟转录组测序获得的unigene序列为基础(accession numbers SRR6167299, SRR6172670, SRR6173479, SRR6175 505, SRR6179331和SRR6179394),通过NCBI数据库进行比对分析,获得了达氏鲟IGF-1和IGF-2的cDNA全序列。为验证序列的正确性,分别在ORF上下游设计验证引物(表1),以反转录cDNA为模板进行PCR扩增,扩增产物连接载体后,送生工生物工程(上海)股份有限公司进行测序。
1.4 序列分析
运用Vecter NTI软件预测达氏鲟IGF基因的ORF,并推测其编码氨基酸序列,计算编码产物分子量和等电点;信号肽序列使用在线工具SignalP 4.0 (http://www.cbs.dtu.dk/services/SignalP/)进行预测。利用Cluxtal X将达氏鲟的IGF-1和IGF-2序列分别与其他物种的相应基因序列进行多重比对,利用Mega 6.0软件的Neighbor-joining法构建系统进化树。
1.5 组织表达分析
选取5尾健康达氏鲟,采用实时荧光定量PCR技术检测IGF-1和IGF-2基因在达氏鲟11个组织中的相对表达量。PCR反应体系为25 μl,包括5 μl稀释后cDNA(原始浓度稀释20倍),12.5 μl 2×SYBR Green Real-time PCR Master Mix,上下游引物各1 μl(10 μM,表1),灭菌双蒸水5.5 μl。PCR扩增程序为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,42个循环;最后70~95 ℃获取溶解曲线并确保扩增产物的特异性。选取β-actin作为内参基因,引物序列见表1。采用2-ΔΔCT法计算样品中IGF基因mRNA的相对表达量。
1.6 饥饿胁迫下达氏鲟IGF表达量的检测
选择75尾健康、活力好的达氏鲟进行饥饿实验,为期14 d,实验期间充氧,水温25~27 ℃。实验鱼分5组,每组3个平行,分别为对照组(饥饿0 d)、实验1组(饥饿1 d)、实验2组(饥饿3 d)、实验3组(饥饿7 d)和实验4组(饥饿14 d)。分别在饥饿实验的0、1、3、7和14 d采集肌肉、肠道及肝脏3个组织的样本,每个平行采集3尾。每尾样本取组织约30 mg进行液氮速冻,于-80 ℃冰箱保存。

表1 IGF基因克隆和荧光定量PCR检测所用引物
1.7 数据分析
采用平均值±标准误(Means±S.E.)表示实验数据,采用SPSS22.0软件处理结果。基于单因素方差分析基础上,采用Ducan多重比较法对组间差异进行检验,显著水平为0.05。
2 结果与分析
2.1 达氏鲟IGF-1和IGF-2克隆及序列分析
达氏鲟IGF-1基因的cDNA全长为2622 bp(GenBank序号为MK955784),见图1。其中,5′非编译区为292 bp,开放阅读框为489 bp,3′非编译区为1841 bp,3’UTR区域有明显的多聚腺苷酸化信号AATAAA序列。序列分析表明,达氏鲟IGF-1cDNA的ORF编码包括信号肽、成熟肽(B、C、A、D)和E区6个区域共162个氨基酸。去掉信号肽和E区域后,达氏鲟IGF-1包含71个氨基酸残基的成熟肽,可划分为B区(29个氨基酸)、C区(12个氨基酸)、A区(21个氨基酸)、D区(9个氨基酸),分子量为8.0 kDa,等电点(pI)为8.64。
达氏鲟IGF-2基因的cDNA全长为1821 bp(GenBank序号为MK955785),见图2。其中,5′非编译区为109 bp,开放阅读框为660 bp,3′非编译区为1052 bp,3’UTR区域有明显的多聚腺苷酸化信号AATAAA序。序列分析表明,达氏鲟IGF-2cDNA的ORF编码包括信号肽、成熟肽(B、C、A、D)和E区6个区域共219个氨基酸。去掉信号肽和E区域后,达氏鲟IGF-2包含70个氨基酸残基的成熟肽,可划分为B区(32个氨基酸)、C区(10个氨基酸)、A区(21个氨基酸)、D区(7个氨基酸),分子量为7.8 kDa,等电点(pI)为8.30。
2.2 系统进化分析
将达氏鲟的IGF-1和IGF-2分别和其他物种相应的IGF序列进行比对,采用Mega 6绘制系统进化树,如图3。结果显示,达氏鲟的IGF-1和IGF-2均可与其他物种的IGF亚型聚类,其中,IGF-1与波斯鲟聚为一支,IGF-2与史氏鲟聚为一支,表明在进化上与鲟形目的鱼类亲缘较近。
2.3 不同组织中IGFs的表达水平
达氏鲟IGFs在心脏、肝脏、脾脏、肾脏、性腺、肌肉、肠、鳃、皮肤、眼、脑组织中均有表达,其表达量在各组织中不尽相同(图4)。其中,IGF-1在眼睛中的表达量最高,显著高于其他组织(P<0.05),肝脏和性腺次之,在脾脏、鳃、肾脏中表达量较小,在皮肤中表达量最低。IGF-2在肝脏中的表达量最高,性腺次之,显著高于其他组织(P<0.05),在肠道、脾脏中表达量较小,同IGF-1类似,IGF-2在皮肤中的表达量最低。
2.4 饥饿胁迫下达氏鲟IGFs表达量的变化
达氏鲟肝脏、肠和肌肉组织中IGF-1和IGF-2mRNA表达量在饥饿期间出现不同的变化。饥饿1 d后,肝脏和肠道中的IGF-1呈现上升的趋势(图5),随后第3、7和14天时的表达量均显著下降(P<0.05)。而肌肉中的IGF-1在第3、7天时出现下降趋势,但相较于第0天的表达量无显著差异(P>0.05),饥饿14 d,其表达量开始出现了显著下降(P<0.05)。IGF-2在饥饿第1天后也出现上调表达的趋势(图6),但饥饿第3、7和14天时其表达量在所有检测的组织中与第0天相比均无显著差异(P>0.05)。

灰色阴影部分表示起始密码子,*表示终止密码子,方框内为多聚腺苷酸化信号The initiation codon was highlighted in light grey and termination codon was shown by * while the polyadenylation signal was in box

灰色阴影部分表示起始密码子,*表示终止密码子,方框内为多聚腺苷酸化信号The initiation codon was highlighted in light grey and termination codon was shown by * while the polyadenylation signal was in box
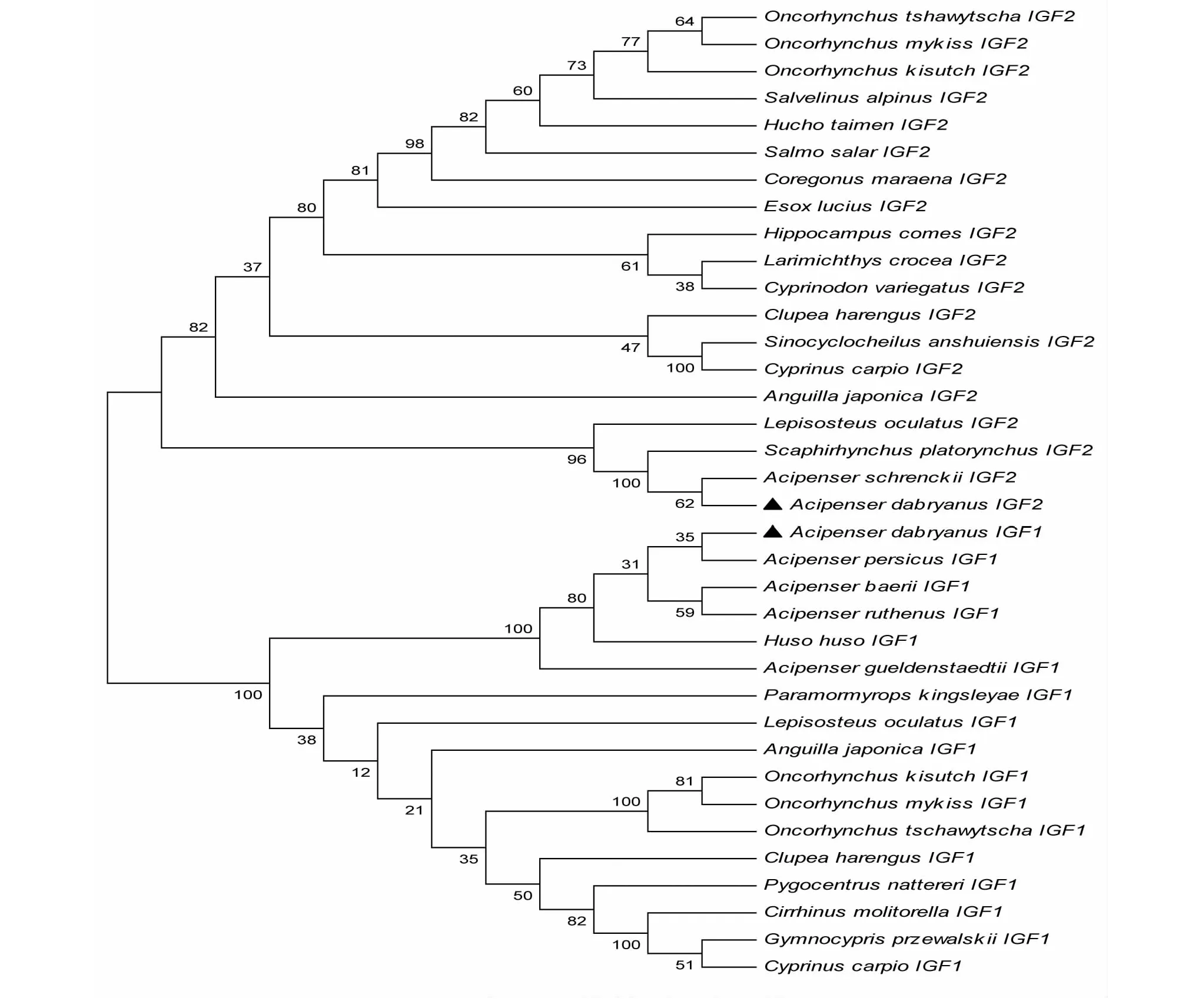
图3 达氏鲟IGFs与其他脊椎动物的系统发生树
3 讨 论
20世纪90年代以来,国内外学者已成功分离出鱼类的IGF-1和IGF-2基因cDNA序列[3-11]。研究发现,不同鱼类的IGF cDNA序列同源性高,蛋白质一级结构高度保守[19]。达氏鲟IGF-1和IGF-2由信号肽和B、C、A、D、E 5区组成,IGF-1和IGF-2的相似性为42.1 %。通过与其他鱼类的氨基酸多重对比,B、C、A、D保守性较高,信号肽及E区同源性较差。达氏鲟IGF-1与史氏鲟(A.schrenckii)、密西西比铲鲟(Scaphirhynchusplatorynchus)的同源性较高,均为96 %,与其他物种的同源性则为60 %左右。IGF-2与与欧鳇(Husohuso)、西伯利亚鲟(A.baeri)、小体鲟(A.ruthenus)、波斯鲟(A.persicus)的同源性较高,均在90 %以上,与其他物种的同源性为70 %左右。达氏鲟隶属鲟属,从构建的系统进化树可以看出,达氏鲟与史氏鲟、密西西比铲鲟、欧鳇、西伯利亚鲟、小体鲟、波斯鲟等IGF的同源性很高,与分类地位相近的鲟、鳇等出现在同一分支,与鲤形目、鲑形目等鱼类相距较远,这与其传统分类地位相一致。

不同字母表示差异达到显著水平The different letters stand for significant difference

图5 饥饿胁迫下不同组织中IGF-1的相对表达量

图6 饥饿胁迫下不同组织中IGF-2的相对表达量
一般情况下,IGFs对肌肉、脑、生殖系统、免疫系统、消化系统、生长等都有重要作用[20],其主要在肝脏中表达,在其他组织也有一定的表达[21]。本研究发现,IGF-1和IGF-2在肠、肝脏、肌肉、脑、皮肤、脾脏、鳃、肾脏、心脏、性腺和眼睛中均有表达,也充分证明IGFs在达氏鲟中是一个广泛表达的基因。近年来研究表明,IGF-2主要与动物的胚胎生长和发育相关,IGF-1主要负责动物的胚后生长。Manfred[22]等研究发现,莫桑比克罗非鱼大部分器官组织都能分泌IGF-1,如肝、胰、胃、肠、肾、生殖腺、脑、心和眼等,这些器官和组织通过自分泌、旁分泌方式分泌IGF-1,然后通过IGF-1调节来发挥生物效应。2007年,Otteson[22]等发现IGF-1和IGF-1R在视网膜中表达,并显著高于其它组织,外源的GH能显著提高靶组织中IGF-1的表达量,并提高视网膜原始细胞扩增。本研究中,IGF-1在达氏鲟眼睛中表达量最高,推测其可能参与到达氏鲟眼睛视网膜的发育过程中。其次,IGF-1在肝脏中也有较高的表达,但肠、皮肤、脾脏、鳃、肾脏中的表达量低,这与其他硬骨鱼中IGF-1的表达模式相似,说明IGF-1主要由肝脏参与合成,少数可由其他器官产生和分泌[24-25]。IGF-2在鱼类的多组织中表达,是控制动物生长和脂肪沉积的重要基因之一。不同鱼类各组织IGF-2的表达量不尽相同,其中,鲤(Cyprinuscarpio)、半滑舌鳎(Soleasenegalensis)、金头鲷(Sparusaurata)等鱼类中肝脏的IGF-2表达量最高,鳜(Sinipercachuatsi)在脑中表达量最高,三长棘赤鲷(Pagrusauriga)在鳃和心脏中表达量最高[26]。IGFs是生长轴和生殖轴相交联的关键因子,性腺中也存在生长激素生长调控轴和一些性腺局部的调节因子,准确调控卵巢发育与成熟的变化。Cao[4]等研究发现,鱼类IGF-2参与鱼类性腺发育过程,能诱导鱼类卵母细胞成熟和颗粒细胞的增殖与分化。林权卓[23]等通过对双棘黄姑鱼的研究发现,IGF-2在各组织中均广泛表达,在卵巢成熟期的IGF-2表达量较高,具有促进卵巢成熟的作用。Sharon[21]等研究发现,IGF-2在卵泡层和卵母细胞均有表达,更多的参与动物繁殖旁分泌/自分泌系统。Gentil等[27]通过观察虹蹲性周期发现,IGF-2参与卵黄的生成,在鱼类生长发育中具有重要生理作用。本研究中,IGF-2在不同组织中出现一定的差异表达,除肝脏以外,该基因在性腺的表达量显著高于其他组织,由于本实验所用达氏鲟样本正处于早期性腺分化阶段,所以推测IGF-2可能参与到达氏鲟生殖细胞发育和早期性腺分化等途径中。
饥饿条件下,鱼类的激素分泌、糖源合成代谢[28]、脂肪代谢[29]和能量收支[30]会发生一定的改变。IGFs的表达和活性与营养状况呈正相关的关系,鱼类在受到饥饿胁迫时GH和IGF-1会迅速进行反馈调节。沈文英等[31]分析了饥饿和恢复投喂条件下,异育银鲫肝脏IGF-1表达量的变化,发现饥饿期肝脏IGF-1mRNA表达量呈下降趋势,恢复投喂后血液中的IGF-1迅速恢复到对照组水平。Wood等[32]研究发现,营养状况通过调节IGF的转录来实现对IGF的调控,长期饥饿将导致血液中IGF-1水平的持续降低。本研究结果显示,在饥饿条件下,肝、肠和肌肉组织中的IGF-1总体呈下调表达的趋势,与斜带石斑鱼(Epinepheluscoioides)[33]、红点鲑(Salvelinusalpinus)[34]、斑点叉尾鮰(Ictaluruspunctatus)[35]的研究结果相似。饥饿时间与IGFs的表达也存在一定的关系,尼罗罗非鱼[36]在饥饿7 d后,肝胰脏mRNA表达丰度明显降低,异育银鲫(Carassiusauratusgibelio)[31]在饥饿第14天后IGFs表达显著降低,大口黑鲈(Micropterussalmoides)[37]在禁食3周后,肝脏中的IGF-1mRNA水平显著低于对照组。然而,与以往鱼类研究不同的是,本研究发现IGFs的表达量在饥饿短时间内出现小幅度的上升,随后逐渐下降,这与小鼠在48 h内的IGF-1mRNA表达量变化趋势一致[38]。除此以外,本研究还发现,肝脏和肠道的IGF-1表达量在饥饿第3天开始就出现显著下降,而肌肉中的IGF-1表达量在第14天时才开始显著下降,推测达氏鲟IGF-1在肌肉中对于饥饿胁迫的响应时间要慢于肝脏和肠道。而达氏鲟IGF-2在饥饿胁迫下的表达模式与IGF-1存在较大差别。在饥饿第1天时,IGF-2在检测的各组织中均迅速上调表达,但在随后的第3天开始就下降到初始表达水平,随后其表达量与第0天相比均无显著差异,到饥饿第14天时也无显著下降,推测IGF-2可能不参与达氏鲟饥饿胁迫响应的途径中。IGF-1和IGF-2对饥饿胁迫的不同响应模式也进一步说明IGF-1和IGF-2在达氏鲟中行使着不同的生物学功能。
4 结 论
本研究首次克隆了达氏鲟IGF-1和IGF-2两种胰岛素样生长因子的cDNA全长序列,并分析了其组织分布和在饥饿胁迫下的表达模式。研究发现饥饿胁迫会显著影响达氏鲟IGF-1mRNA的表达水平,而IGF-2的表达模式整体无显著变化,推测该2种胰岛素样生长因子在达氏鲟中发挥着不同的生物学功能。IGFs是一类重要的生长调控因子,本研究可作为达氏鲟生长调控、营养调控与基因表达模式关系的研究基础,如今后把该基因作为主效功能基因用于分子标记辅助育种,将更好的促进该物种的选育与保护。
