硫酸根自由基氧化氮杂环化合物效能及机理分析
2020-04-22张智春岳秀萍段燕青高艳娟
张智春 ,岳秀萍 ,段燕青 ,高艳娟
(1.太原理工大学环境科学与工程学院,山西太原030006;2.山西建筑职业技术学院,山西太原030600)
氮杂环化合物广泛存在于焦化、造纸、制药等行业,是具生物毒性、难降解的有机污染物,包括喹啉类化合物、吡啶类化合物、吲哚类化合物及其衍生物等,对环境和人体健康产生潜在的危害〔1〕。氮杂环化合物不易受微生物代谢的破环,对微生物呈现不同程度的毒性,使得水体或土壤中杂环化合物的生物处理效果受到极大限制〔2〕。
高级氧化法是常见的处理难生物降解有机物的方法之一。其中硫酸根自由基氧化法可在宽泛pH范围内启动,氧化大多数有机物并使其有效分解〔3〕。硫酸根自由基氧化法最常见和有效的激活方式有过渡金属激活、热激活、碱激活、活性炭激活、紫外激活等,而价格最低和效率最高的是零价铁(ZVI)激活〔4〕。笔者采用ZVI激活过硫酸盐产生硫酸根自由基()氧化氮杂环有机物,分析了硫酸根自由基对氮杂环有机物的氧化效率和影响因素,确定最佳反应条件,并通过分子轨道理论和Guassian09软件研究酸性条件下反应速率加快的原因。
1 实验部分
1.1 试剂与设备
ZVI(粒径≤0.1 mm,质量分数≥98%),天津致远化学试剂有限公司;Na2S2O8(质量分数≥99%)、吡啶(体积分数≥98%)、喹啉(体积分数≥98%)、吲哚(质量分数≥98%),H2SO4(体积分数≥98%)、NaOH(质量分数≥99%),天津市恒兴化学试剂制造有限公司;甲醇,色谱纯。所有试剂均未经纯化直接使用,实验用水由Millipore超纯水制备设备提供,电阻率保持在18.2 MΩ/cm。
LC-20高效液相色谱仪,日本岛津公司;数显恒温六联磁力搅拌水浴锅,常州金城富威实验仪器厂。实验所用玻璃定量容器均用重铬酸钾-浓硫酸配制的溶液浸泡,随后用去离子水反复冲洗后干燥使用。
1.2 实验过程
实验采用受广泛认可的零价铁作激活剂激活过硫酸钠。为避免热激活和碱激活造成干扰,实验均在常温下进行,溶液pH≤9.0。
所有实验均在(25±0.2)℃下250 mL锥形瓶中进行。反应液体积为100 mL,用恒温磁力搅拌水浴锅对溶液进行控温和搅拌,用0.1 mol/L的H2SO4和0.1 mol/L的NaOH溶液调节反应液的初始pH。
实验过程反应式见式(1)。

在3个已知浓度的污染物溶液中先溶解相同物质的量的Na2S2O8,充分搅拌后,投加相同质量浓度的过量ZVI,以确保Na2S2O8充分反应。
(1)配制母液:取0.5 L超纯水,分别加入一定量吡啶、喹啉、吲哚,搅拌均匀后继续加超纯水定容至1 L,配制成0.000 2 mol/L的吡啶、喹啉、吲哚母液。每次实验时取出母液50 mL,加入50 mL超纯水,配制成0.1 mmol/L的待反应溶液。
(2)在预设实验条件下,将待测溶液和过硫酸钠以一定物质的量加入,放置在恒温磁力搅拌水浴锅中搅拌均匀,最后加入活化剂。加入活化剂后反应正式开始。
(3)在预设时间间隔内取出4 mL反应溶液,加入盛有0.5 mL甲醇的容积为5 mL的聚乙烯瓶中(去离子水洗涤),用0.45 mm PTFE的注射器吸取2 mL,由0.45 mm针式过滤器过滤后,用高效液相色谱仪测定吡啶、喹啉、吲哚浓度。测定前需根据已知浓度的标准溶液做标准曲线。根据标准曲线确定吡啶、喹啉、吲哚的实际浓度。
(4)高效液相色谱仪配备1个二极管阵列双波长紫外检测器和 1 个 XDB-C18(250 mm×4.6 mm,8 nm)反相柱(美国安捷伦ZORBAX Eclipse),柱温30℃。流动相为水和甲醇的混合物,体积比为40∶60。流速设置为1.0 mL/min,紫外检测器波长设置为254 nm(吡啶)、217 nm(喹啉)和 270 nm(吲哚)。 没有特殊说明,本实验进样量均为1 mL。
2 结果与讨论
2.1 氮杂环化合物去除
用0.1mmol/L的H2SO4将反应初始pH调至7.0±0.2,在温度为25℃,反应时间为 30 min,吡啶、喹啉、吲哚均为 0.1 mmol/L,Na2S2O8浓度统一为 2 mmol/L(浓度比为 20∶1),ZVI添加量为 1 g/L(17.8 mmol/L),过量ZVI采用钕磁铁回收的实验条件下,考察吡啶、喹啉、吲哚的浓度变化情况,结果见图1。
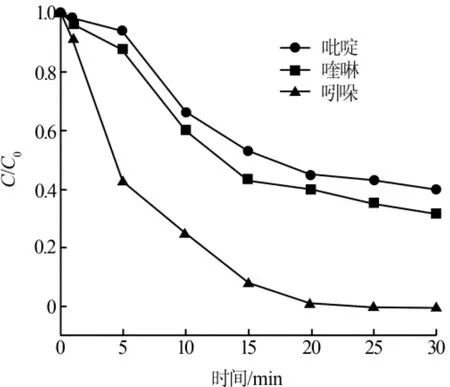
图1 吡啶、喹啉、吲哚的浓度变化
由图1可见,相同的初始浓度下各反应物去除率不同,去除率最高的是吲哚,达99%,其次为喹啉,最高达68%;吡啶去除率最低,为60.2%。
吡啶和喹啉属于较稳定的类苯结构,N原子和两个C原子以sp2杂化轨道成键,另一个p轨道的电子参与形成稳定的大π键,另一个p轨道上的孤对电子未参与成键,形成p-π共轭结构,电负性大,表现为吸电子芳香体系,因此六元环的含氮杂环上亲电取代难,亲核取代易〔5〕。喹啉分子中还存在1个电子云密度相对均匀的苯环,因此亲电反应可发生在苯环。
吲哚分子由吡咯环和苯环稠和而成,吡咯环为五中心六电子结构,N原子的孤对电子参与形成大π键,为富电子芳香体系,因此易被氧化,可发生亲电反应。
自由基与有机物反应时,一般有脱氢反应、亲电加成反应和电子转移3种途径〔5〕。而对于稳定性较强的氮杂环有机物,共轭键的电子云密度越大,越利于亲电加成,通过自由基链式反应使底物中的共价键发生均裂,生成新的有机自由基。硫酸根自由基与吡啶、喹啉和吲哚的反应均为亲电加成反应,降解程度受分子结构稳定性的影响,最终降解率顺序为吲哚>喹啉>吡啶。
2.2 影响因素
2.2.1 氧化剂浓度的影响
实验中ZVI添加量为1 g/L(17.8 mmol/L),确保反应中ZVI始终过量,余量ZVI用钕磁铁吸收,反应初始pH用0.1 mol/L的H2SO4和0.1 mol/L NaOH调节为7.0±0.2,温度为25℃,反应时间均为30 min,考察氮杂环化合物的去除率随氧化剂Na2S2O8变化情况,结果见图2。
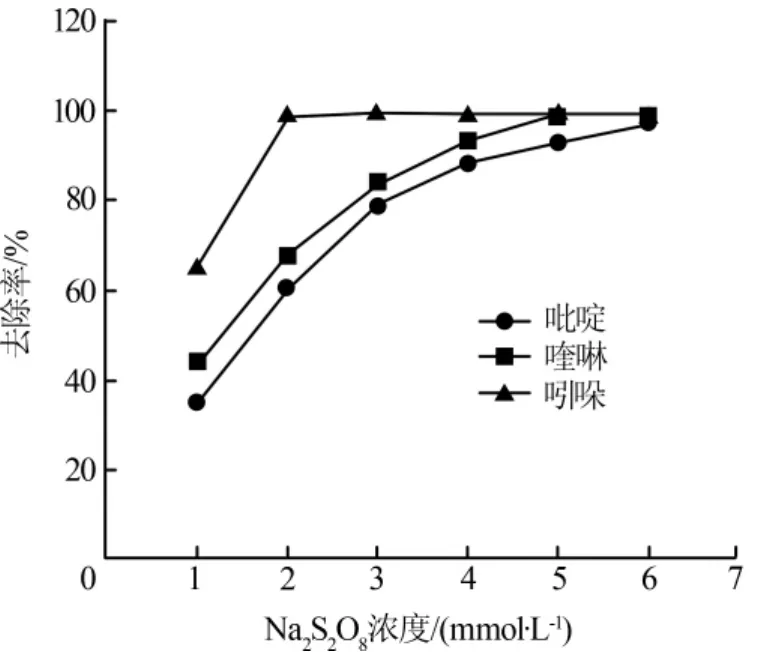
图2 Na2S2O8浓度对去除率的影响
由图2可见,随着Na2S2O8浓度的增加,吡啶、喹啉和吲哚的去除率均显著增加。Na2S2O8浓度为2 mmol/L时,吲哚即被完全去除;Na2S2O8浓度为 5 mmol/L时,喹啉被完全去除;Na2S2O8浓度为6 mmol/L时,吡啶才被完全去除。实验中ZVI始终过量,Na2S2O8浓度增加意味着溶液内生成的快速增加,可快速氧化分解污染物。但值得注意的是,Na2S2O8从2 mmol/L提高至4mmol/L时,喹啉和吡啶的去除率并未增加至原来的2倍,这是因为吡啶和喹啉被攻击开环后,原苯环或类苯环结构中稳定的大π键断裂,形成含直链双键或三键的有机物,而直链上的双键和三键均能与自由基快速反应〔6〕,与溶液中的目标污染物竞争自由基,因而降低了目标污染物的去除率。
2.2.2 初始pH的影响
在吡啶、喹啉、吲哚溶液初始pH分别为(2.0±0.2)、(3.0±0.2)、(4.0±0.2)、(5.0±0.2)、(6.0±0.2)、(7.0±0.2),Na2S2O8和 ZVI添加量分别保持 2 mmol/L、1 g/L(17.8 mmol/L),温度为25℃,反应时间为30 min的实验条件下,考察初始pH对目标污染物去除率的影响,结果见图3。
如图3所示,吡啶、喹啉的降解率均随pH的降低而升高,初始pH为2.03时,吡啶、喹啉和吲哚的去除率分别为84.6%、91.4%、99.6%,此时吡啶和喹啉的去除率高出中性条件(初始pH为7.11)下的去除率(28.8%、25.2%)。 这意味酸性条件下,氧化氮杂环化合物有更高的化学反应速率。此外,无论pH如何变化,吲哚去除率一直保持在99%以上,这可能是因为吲哚结构中不存在大π键,在中性pH下即可快速反应,因此酸性条件下变化不明显。
溶液中OH-浓度较高时,具有高氧化电位的(2.6~3.1 eV)将优先与 OH-反应产生羟基自由基(·OH)〔6〕。Chenju Liang 等〔7〕研究了活化过硫酸盐的过程,并用化学探针识别技术识别了反应体系中自由基的类型,得出结论:pH为7.0或更低时,为主要活性物种,碱性条件下主要的活性物种为和·OH, 证实氧化降解反应在酸性条件更有利。反应中始终保持pH≤(7.0±0.2),也是确保溶液中的高活性自由基以为主。

图3 溶液初始pH对去除率的影响
2.3 酸性溶液中的反应机理分析
铁基激活剂(ZVI和Fe2+)在激活过硫酸盐氧化有机污染物的反应过程中会释放大量H+,使溶液pH明显降低〔9〕,其氧化产物Fe3+在水中会结合OH-形成水合铁,使溶液pH降低〔10〕。如喹啉氧化,见式(2)。实验结果表明,反应完毕溶液pH均<3.2。
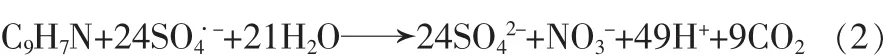
化学反应中,当产物浓度增加,一般认为会抑制正向反应的进行。但大多数有机污染物与硫酸根自由基的反应在酸性条件下降解更快〔11〕,其原因可用分子轨道理论解释。在酸性溶液中,H+首先贴合氮杂环化合物的N原子形成N-H+正离子,吸引带负电荷的O 原子最外层 p 轨道有 1 个未成对电子,拥有单电子占位轨道(SOMO),处于激发态的自由基很不稳定,需要迅速找到电子受体或电子供体形成稳定基态。而C—N键相邻C原子由于N的强吸电子效应,电子云密度变弱,整个分子的最高占位轨道(HOMO)和最低未占位轨道(LUMO)之间的能隙变大。此时自由基的SOMO自发跃迁,氮杂环化合物被攻击发生断键,的自由电子与C原子的共用电子对形成共价键。由于极性较强,很快从开环的C原子上掉落。
吲哚分子结构为9原子10π电子共轭体系,由于N原子的孤电子对参与形成共轭键,没有多余孤对电子结合H+,且吲哚中的N原子电子对参与共轭后吸电子效应消失,难以形成质子化结构。
用 Guassian09(Revision E.01)计算吡啶、喹啉、吲哚分子及质子化后的分子结构能量,用M06-2X/6-311+G(d,p)水平进行几何优化和频率分析,得到吡啶、喹啉的分子轨道能级,如图4所示。
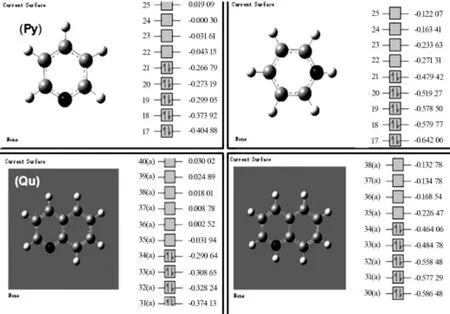
图4 质子化后吡啶和喹啉的MOs轨道计算
则吡啶和喹啉在中性及碱性溶液中的带隙能极差为:
E(吡啶)0∶〔-0.043 15-(-0.266 79)〕×27.211 9=6.085 669 eV
E(喹啉)0∶〔-0.031 94-(-0.290 64)〕×27.211 9=7.039 72 eV
吡啶和喹啉在酸性溶液中的带隙能极差为:
E(吡啶)1∶〔-0.271 31-(-0.479 42)〕×27.211 9=5.663 1 eV
E(喹啉)1∶〔-0.226 47-(-0.464 06)〕×27.211 9=6.465 3 eV
可见,在酸性溶液中,质子化的具有稳定结构的氮杂环化合物的带隙能极差均不同程度地降低,在分子间综合作用力下处于不稳定状态,易发生能级跃迁;更容易与自由基等处于激发态的(拥有SOMO轨道)物质发生化学反应而被氧化。
3 结论
采用ZVI激活过硫酸盐释放硫酸根自由基,氧化降解吡啶、喹啉和吲哚等含氮杂环化合物。结果表明,分子结构稳定的吡啶较难氧化,喹啉次之,吲哚最易被去除。吡啶、喹啉和吲哚初始浓度均为0.1 mmol/L,Na2S2O8和 ZVI添加量分别为 2 mmol/L、1 g/L(17.8 mmol/L)时,去除率分别为 60.2%、68%、99%。保持ZVI过量,Na2S2O8浓度越高、pH越低,降解效率越高。
用 Guassian09(Revision E.01)计算吡啶和喹啉原态分子及质子化后的分子结构能量,用M06-2X/6-311+G(d,p)水平进行几何优化和频率分析,认为酸性溶液中氮杂环化合物由于N原子吸电子发生质子化,分子HOMO和LUMO能级差降低,更易被氧化降解,可为难生化物质的氧化降解提供理论基础。
