TRAb在Graves病诊治中的变化及与甲状腺功能、用药剂量及时间的相关性
2020-04-22刘晓相刘玉盒高晓燕陈慧
刘晓相,刘玉盒,高晓燕,陈慧
(兰州大学第二医院内分泌代谢科,兰州 730030)
Graves病是一种常见的器官特异性自身免疫性疾病,是甲状腺功能亢进最常见的病因。Graves病每年发病率为(20~50)/10万,大约3%的女性和0.5%的男性终身患有Graves病[1]。Graves病的发病涉及甲状腺结构免疫耐受的破坏,甲状腺自身免疫与针对各种甲状腺抗原的自身抗体存在有关,包括促甲状腺激素受体抗体(thyrotropin receptor antibodies,TRAb)、甲状腺过氧化物酶抗体和抗甲状腺球蛋白抗体,其中TRAb在Graves病的发病过程以及病情评估中起关键作用[2-3]。TRAb在Graves病治疗过程中及治疗后的变化是Graves病病理生理学的重要方面。本研究旨在观察新诊断的Graves病患者接受抗甲状腺药物治疗过程中其血清TRAb阳性率及滴度的变化规律,分析药物治疗过程中TRAb滴度与甲状腺功能、药物剂量、治疗时间的相关性,为临床诊治工作提供参考。
1 资料与方法
1.1一般资料 选择2016年12月至2018年8月兰州大学第二医院内分泌代谢科收治的32例新诊断的Graves病患者为研究对象,其中男8例,女24例,年龄10~64岁,平均(37±13)岁。
1.2诊断与排除标准
1.2.1诊断标准 ①具有临床甲状腺功能亢进症状和体征;②经触诊及甲状腺超声证实甲状腺弥漫性肿大,少数病例可无甲状腺肿大;③血清促甲状腺激素(thyroid stimulating hormone,TSH)水平降低,甲状腺激素水平升高;④眼球突出和其他浸润性眼征;⑤胫前黏液性水肿;⑥TRAb或甲状腺刺激抗体阳性。其中①②③项为诊断必备条件,④⑤⑥项为诊断辅助条件[4]。
1.2.2排除标准 ①接受131I治疗或甲状腺切除术后复发者;②合并心、肝、脑、肾等疾病及高血压、糖尿病、感染、肿瘤、精神疾病、下丘脑及垂体疾病等;③存在外科手术、严重创伤等应激性刺激;④检测甲状腺功能1个月内服用含碘药物、避孕药、抗癫痫药物、抗精神病药物、多巴胺、糖皮质激素等;⑤合并其他自身免疫性疾病;⑥妊娠及哺乳期妇女;⑦有甲状腺疾病家族史;⑧回答不可靠,检查治疗不配合,依从性差,中途转向131I治疗或手术治疗。
1.3治疗方法 初治期:新诊断的Graves病患者给予甲巯咪唑(methimazole,MMI)(德国Merck KGaA)15~30 mg/d治疗。每4周复查一次血清甲状腺激素水平。减药期:一旦患者症状消失,血清甲状腺激素水平恢复正常,MMI的剂量开始减少,每2~4周减药1次,每次减量5~10 mg/d。每4周复查一次血清甲状腺激素水平。维持期:药物剂量减至最低有效剂量,即MMI为5~10 mg/d,检测血清甲状腺激素水平仍能维持正常时开始维持治疗,每2个月复查一次血清甲状腺激素水平,治疗时间达到6个月后每4~6个月复查一次血清甲状腺激素水平。总疗程为12~18个月。
1.4观察指标及检测方法 比较初治期、减药期、维持期的甲状腺功能[TSH、游离三碘甲腺原氨酸(free triiodothyronine,FT3)、游离甲状腺素(free thyroxine,FT4)]及TRAb,并计算初治期及减药期的药物剂量及治疗时间。分析治疗过程中TRAb滴度与甲状腺功能、药物剂量、治疗时间的相关性。所有患者采血前禁食12 h,次日清晨08:00~11:00采集空腹静脉3 mL,采用化学发光法检测(ADVIA Centaur系列,美国西门子医学诊断股份有限公司)血清TSH(正常参考范围0.55~4.78 kU/L)、FT3(正常参考范围3.5~6.5 pmol/L)、FT4(正常参考范围11.5~22.7 pmol/L);采用化学发光法(深圳市新产业生物医学工程股份有限公司的Maglumi化学发光测定仪及配套试剂)检测血清TRAb(正常参考范围0~1.5 IU/L)。

2 结 果
2.1治疗过程中血清TRAb阳性率及滴度的变化 新诊断的32例Graves病患者接受MMI治疗初治期、减药期、维持期的TRAb阳性率分别为84.3%(27/32)、75.0%(24/32)、65.6%(21/32)。血清TRAb滴度在初治期、减药期、维持期分别为7.73(2.74,15.28) IU/L、5.08(1.49,9.21) IU/L、2.27(1.26,5.75) IU/L,三个时期TRAb滴度比较差异有统计学意义(χ2=47.688,P<0.001),减药期与维持期的血清TRAb滴度低于初治期,维持期低于减药期(均P<0.05);27例血清TRAb滴度呈下降趋势,3例(9.4%)患者血清TRAb滴度变化不明显或呈上升趋势。
2.2治疗过程中患者血清TSH、FT3、FT4水平的变化 三个时期TSH、FT3、FT4水平比较差异有统计学意义(P<0.01),维持期TSH高于初治期和减药期,维持期和减药期FT3、FT4低于初治期(P<0.05),见表1。
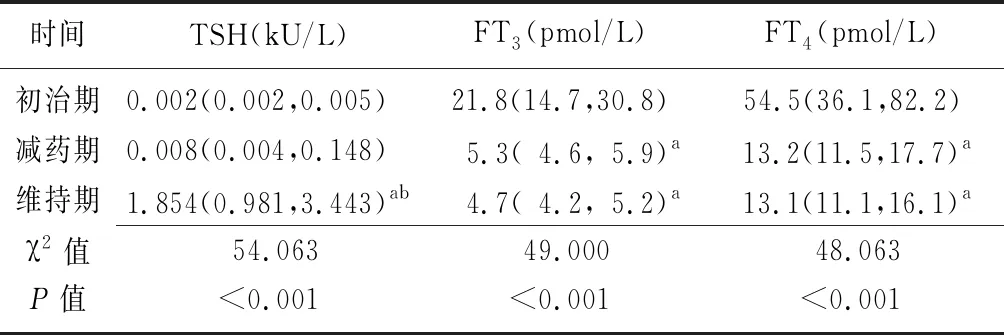
表1 治疗过程中血清TSH、FT3、FT4水平比较 [n=32,M(P25,P75)]
TSH:促甲状腺激素;FT3:游离三碘甲腺原氨酸;FT4:游离甲状腺素;a与初治期比较,P<0.05;b与减药期比较,P<0.05
2.3治疗过程中血清TRAb滴度与TSH、FT3、FT4水平的相关性分析 Spearman秩相关分析结果显示,初治期、减药期、维持期血清TRAb滴度与TSH、FT3、FT4之间均无相关性(P>0.05),见表2。

表2 治疗过程中血清TRAb滴度与TSH、FT3、FT4的相关性分析 (n=32)
TRAb:促甲状腺激素受体抗体;TSH:促甲状腺激素;FT3:游离三碘甲腺原氨酸;FT4:游离甲状腺素
2.4初治期及减药期血清TRAb滴度与药物剂量及治疗时间的相关性分析 初治期、减药期的药物剂量分别为(1.46±0.58) g、(1.62±0.62) g,治疗时间分别为(1.68 ±0.57)个月、(2.85±0.75)个月。 Spearman秩相关分析结果显示,初治期血清TRAb滴度与药物剂量呈低度正相关(r=0.363,P=0.041),与治疗时间无相关性(r=0.301,P=0.094);减药期血清TRAb滴度与药物剂量和治疗时间呈显著正相关(r=0.679,P=0.001;r=0.640,P=0.001)。
3 讨 论
针对促甲状腺激素受体的自身免疫是Graves病的关键致病因素,结果引起TRAb升高。新诊断的Graves病患者血清TRAb阳性率为80%~100%[5]。Graves病的治疗方式包括抗甲状腺药物(antithyroid drug,ATD)、手术及131I治疗3种,ATD因在短时间内使甲状腺功能恢复正常、几乎不引起甲状腺功能减退、在避免辐射暴露和侵入性手术的同时改善免疫紊乱等优点被患者和临床医师普遍接受,其主要作用是通过干扰甲状腺过氧化物酶介导的甲状腺球蛋白酪氨酸残基碘化来抑制甲状腺激素的合成[6-7]。TRAb在Graves病患者血清中的滴度与Graves病的病程密切相关[8]。
新诊断的Graves病患者接受ATD治疗后,自身免疫异常逐渐缓解,血清TRAb滴度逐渐下降,其缓解的机制可能为ATD对免疫系统造成的直接或间接影响[9-10]。ATD的直接免疫抑制作用被认为是最可能的缓解机制[6],Graves病患者的总辅助、抑制/细胞毒性和活化的T细胞数显著降低,在服用ATD后总辅助细胞和调节/细胞毒性T细胞的数量增加,并逐渐恢复正常[11]。Ochi等[12]报道,当Graves病患者接受ATD治疗时,由于其类似于还原剂的还原作用而使促甲状腺激素受体与甲状腺刺激抗体结合失效,血清中的甲状腺刺激抗体对甲状腺细胞不起刺激作用,但其生物活性不受影响,虽然ATD被认为通过免疫抑制作用降低Graves病患者血清甲状腺刺激抗体水平,但没有证据表明能引起任何具体的免疫功能障碍,因为ATD在甲状腺外没有免疫抑制作用,其作用仍有争议。然而,有研究发现,Graves病的缓解可能与患者的免疫调节功能恢复有关,而不是与ATD直接相关,因为无论使用ATD还是手术治疗Graves病,当患者甲状腺功能恢复正常时,两种治疗方法的缓解率相近,两者引起的TRAb下降程度几乎完全一致[13]。甲状腺功能亢进本身对自身免疫有直接的影响,当接受ATD治疗后,甲状腺功能亢进被控制,甲状腺功能恢复正常,自身免疫功能紊乱逆转[13-14]。
本研究结果显示,随着ATD治疗时间的推移,从初治期到减药期,再到维持期,TRAb阳性率从84.3%降至75.0%,再降至65.6%,血清TRAb滴度呈显著下降趋势,表明甲状腺功能亢进患者进入维持期后甲状腺功能虽然恢复正常状态,但仍有一部分患者TRAb滴度较高,而整个治疗过程中约9%的患者血清TRAb滴度变化不明显或呈上升趋势。Laurberg等[15]在一项为期5年的前瞻性研究中发现,71例Graves病患者大部分治疗6个月后血清TRAb水平较治疗前明显下降,治疗1年后血清TRAb水平逐渐下降到正常参考范围上限,大约5%的患者治疗前显示较高水平的TRAb,而接受药物治疗后TRAb轻度下降或未下降,约10%的患者随访5年后TRAb仍显示阳性。Nalla 等[16]研究报道,Graves病患者无论接受ATD还是手术治疗,治疗过程中TRAb均呈下降趋势,新诊断的Graves病患者治疗1年后血清中仍可检测到TRAb呈阳性,尽管绝大多数患者血清TRAb显示下降,但有12%的患者在治疗过程中血清TRAb水平保持不变或有所升高。ATD治疗后停药时的TRAb水平与Graves病患者的预后相关,停药期间TRAb阳性的Graves病患者复发风险较高[17]。美国甲状腺协会指南建议,ATD治疗12~18个月后,若监测甲状腺功能仍维持正常,通常建议检测TRAb水平,若TRAb水平正常表明该患者有可能获得缓解,可以停药,复发率为20%~30%,若TRAb滴度仍持续高水平状态,其复发率接近80%~100%,可以选择继续使用ATD治疗或改用其他治疗方法[18]。
本研究结果还显示,Graves病患者血清TRAb滴度在初治期与药物剂量存在低度正相关,与治疗时间无相关性,而在减药期与药物剂量及治疗时间呈正相关。TRAb水平越高提示免疫紊乱越严重,可能需要更大剂量的药物和更长的治疗时间,TRAb从阳性转为阴性可能意味着Graves病患者ATD治疗后免疫紊乱减轻[17,19]。国内一项临床研究观察Graves病患者接受ATD治疗后血清TRAb滴度的变化,将患者血清TRAb滴度按高低程度不同进行分组,分析其治疗期滴度变化,结果显示随着TRAb滴度逐渐升高,ATD治疗的时间越长,治疗所需药物总量逐渐增大,且高低滴度之间有差异[20],本研究结果与上述研究结果[20]大部分一致。
章清华等[21]研究Graves病发病时及在抗甲状腺药物治疗过程中TRAb和甲状腺过氧化物酶抗体的变化,结果显示TRAb与甲状腺功能之间无相关性。Graves病患者接受ATD治疗过程中,FT3、FT4水平逐渐下降并恢复正常,被抑制的TSH逐渐升高至正常水平,而血清TRAb滴度与甲状腺功能之间无相关性。本研究结果与上述报道[2,21]一致。虽然在整个治疗过程中随着甲状腺功能的逐渐恢复,TRAb整体水平逐渐下降,但是TRAb滴度与TSH、FT3、FT4之间无明显相关性。TRAb和TSH均与促甲状腺激素受体结合,但TSH受甲状腺激素负反馈的影响,TRAb滴度在Graves病患者中存在个体差异,少数患者在治疗过程中TRAb滴度并未见明显下降,仍呈上升趋势。
综上所述,新诊断的Graves病患者接受MMI治疗过程中TRAb滴度呈下降趋势,TRAb滴度越高,所需治疗时间越长,用药剂量越大。因此,在考虑停药时不仅要参照甲状腺功能,还需要结合TRAb水平。
