Rucaparib在卵巢癌中的研究进展
2020-04-22江思思孔露阳王嘉宁王红莉郭军威嘉兴学院医学院浙江嘉兴314000
江思思,孔露阳 ,王嘉宁,王红莉,郭军威,徐 营 (嘉兴学院医学院,浙江 嘉兴 314000)
卵巢癌是最常见的妇科生殖系统肿瘤,虽然在妇科肿瘤中发病率不是最高,但死亡率一直位居榜首,因此针对卵巢癌的新型有效药物或治疗策略备受研究者关注。聚腺苷二磷酸核糖聚合酶 (PARP) 抑制剂是一类新型靶向治疗药物,其主要通过影响DNA复制,进而介导肿瘤细胞自噬与死亡,美国FDA已批准 PARP抑制剂 Rucaparib用于BRCA突变卵巢癌患者的单药治疗。本文将对Rucaparib的作用机制、临床研究、未来发展进行介绍。
1 PARP及Rucaparib简介
聚ADP核糖聚合酶〔poly(ADP-ribose)polymerase,PARP〕于1963年被首次报道,是一种依赖DNA的聚腺苷酸合成核酶的核蛋白,其参与基因转录、炎症、有丝分裂、细胞死亡和代谢等多种细胞生理过程[1]。其中PARP-1占PARP活性的90%,被认为是DNA碱基切除修复和DNA单链断裂修复的关键分子[1-2]。因PARP在DNA修复中的重要作用,PARP抑制剂(PARPi)能有效抑制肿瘤细胞的DNA损伤修复,促进肿瘤细胞发生凋亡,为肿瘤治疗提供新思路。目前批准上市用于临床治疗和正处于临床试验阶段的PARPi主要有talazoparib、olaparib(奥拉帕利)、veliparib(维利帕尼)、niraparib(尼拉帕利)、rucaparib(芦卡帕利)等。
Rucaparib(原名CO-338、AG-14699和pf-01367338)分子式C19H18FN3O,分子量421.36,化学结构式如图1,是PARP1/2/3的有效抑制剂,由Clovis生物科技公司开发,商品名为Rubraca[3]。目前的研究表明Rucaparib具有“合成致死性”,同时PARPi与化疗药物结合治疗具有良好的协同作用,不仅能提高灭瘤能力,同时还降低耐药率[4]。Rucaparib虽然不是药物效价上最强的PARPi,但在足够的治疗窗口中,相较而言其对非肿瘤细胞的毒性最小[5]。
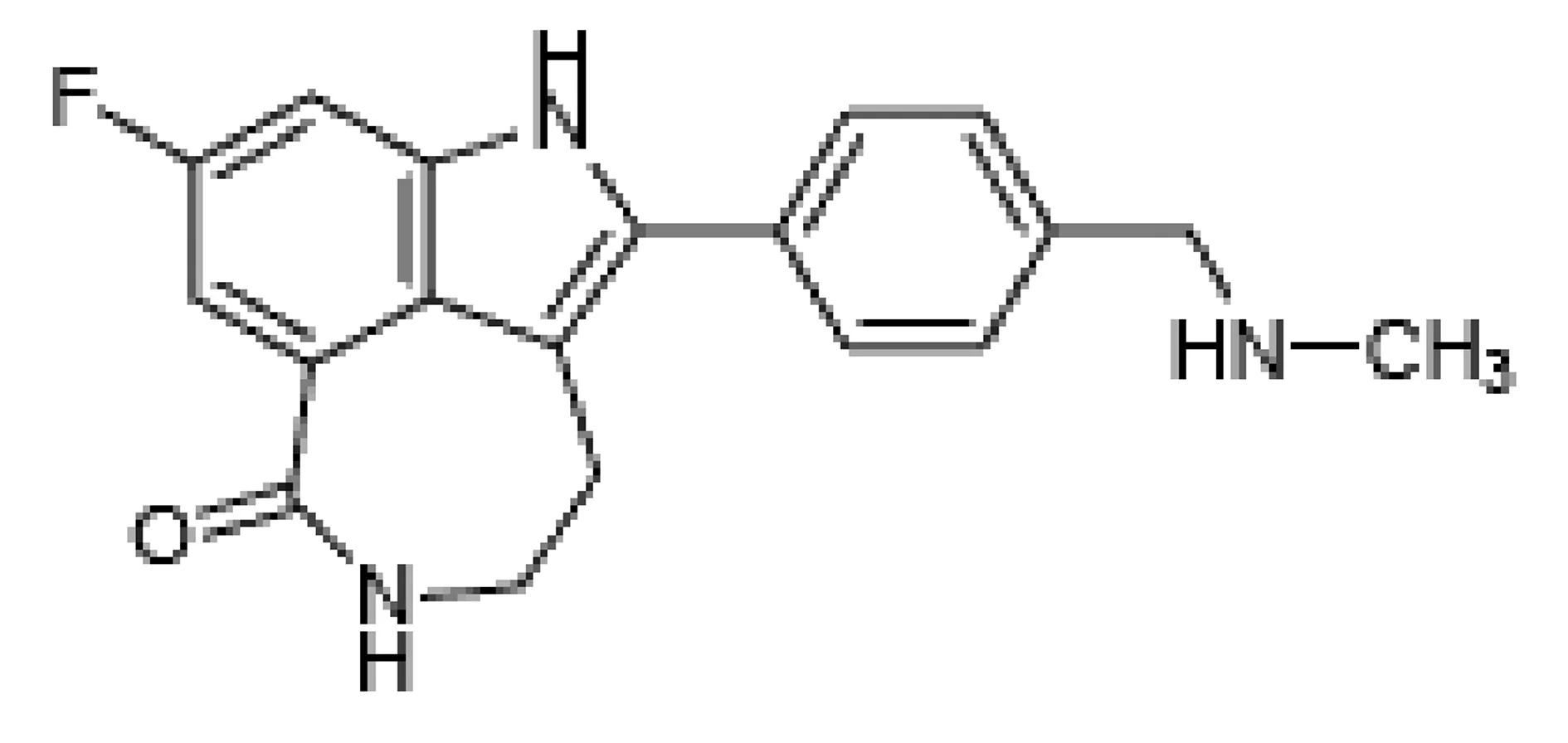
图1 Rucaparib化学式
2 PARP生理作用与PARPi的药物机制
2.1PARP的生理作用:PARP 家族共有 17 个亚型,其中PARP-1表达最丰富且最具特异性,本段即以PARP-1为例介绍PARP作用机制(图2)。
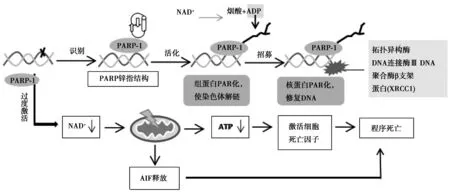
图2 PARP-1生理作用
2.1.1介导DNA修复:PARP-1在结构上主要分为三部分:识别DNA单链损伤位点并与之结合的锌指结构域,富含谷氨酸的自我修饰域,含有CAT催化结构的NAD+ 结合域[6]。当DNA发生损伤时,PARP-1通过锌指结构域与DNA受损部位结合后形成构象异构激活自身催化活性;激活后的PARP-1以NAD+为ADP供体,在多种蛋白质底物上形成聚ADP-核糖(也称“PAR 化”),产生多种生物学效应,如核心组蛋白的“PAR 化”可改变核染色质结构,使染色质解旋;拓扑异构酶、DNA连接酶Ⅲ、DNA聚合酶β和支架蛋白(XRCC 1)等DNA修复蛋白的募集和“PAR 化”可使其激活并最终修复DNA损伤。值得指出的是,“PAR 化”是一种可逆的、生物进化保守的蛋白质转录后修饰过程,一旦DNA修复完成,蛋白的“PAR 化”即会被特定酶所清除,并使 PARP-1恢复活性,寻找下一个DNA 断裂点[7]。
2.1.2介导细胞自噬与死亡:另一方面,PARP-1若在DNA损伤后被过度激活,导致NAD+ 耗竭,细胞能量衰竭,可致细胞死亡[8]。其特征是NAD+ /ATP的耗竭、钙失衡、线粒体功能障碍和细胞凋亡诱导因子的释放,同时PARP-1又是细胞凋亡核心成员胱天蛋白酶(caspase)的切割底物,可作为细胞凋亡的标记分子。由此可见,PARP-1在DNA损伤修复与细胞凋亡中都发挥着重要的作用。
2.2PARP抑制剂(PARPi)的抗癌机制:PARPi抗癌机制包含许多,如染色质重塑、转录调控、血管生成、肿瘤转移等[9],但主要是合成致死和捕获机制(图3)。
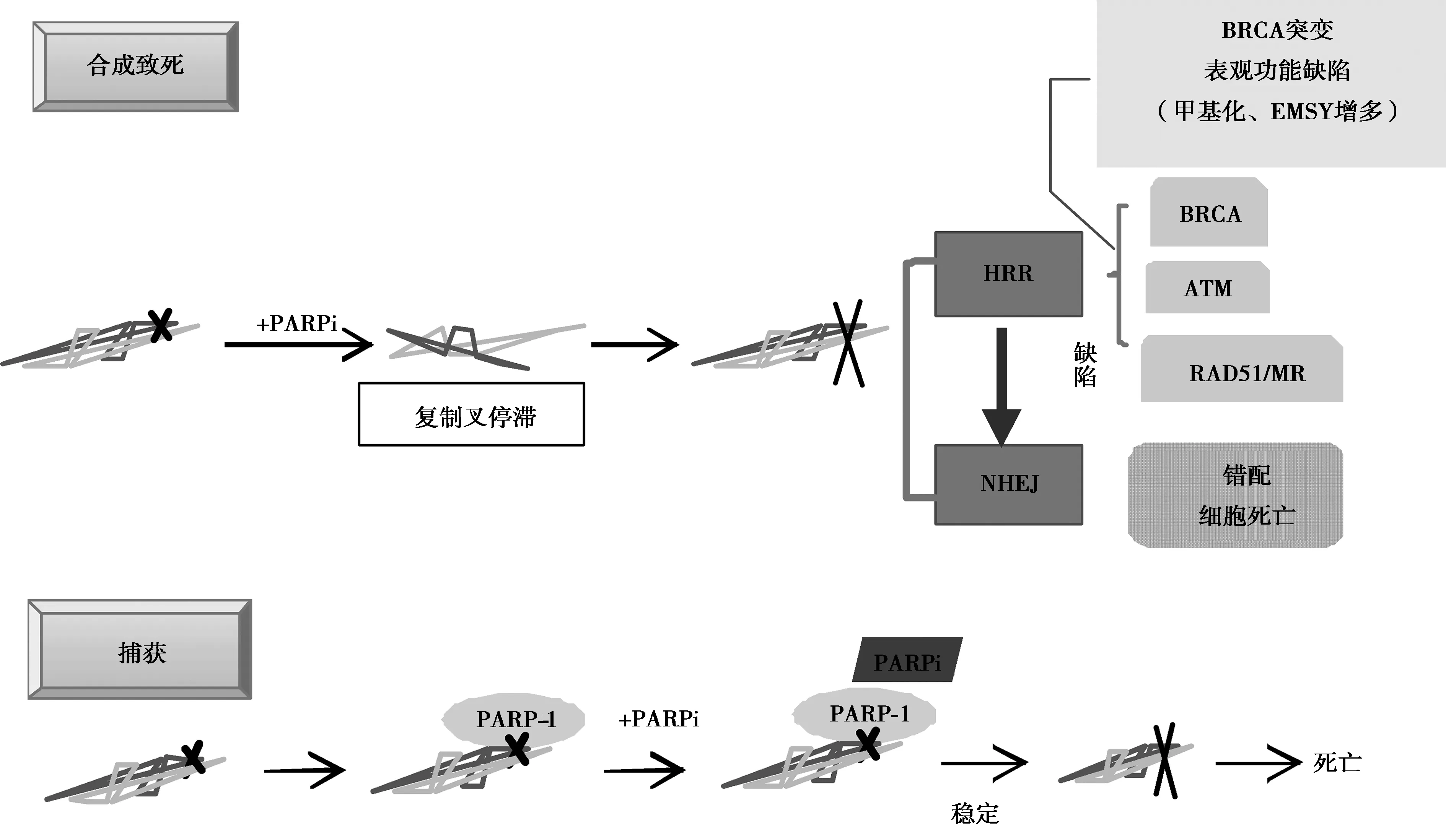
图3 PARPi作用机制
2.2.1合成致死:DNA链由于体内外多种因素可引起断裂,主要分为单链断裂(SSB)和双链断裂(DSB)。SSB能迅速以双链DNA完整链为模板重新合成,其经典的修复方式为碱基切除修复(BER)。但DSB在原位修复的几率很小,通常认为DSB与细胞致死性有直接的联系,其主要的修复方式为高忠实性的同源重组修复(homologous recombination repair,HRR)和可存在一定错配的非同源末端连接的重组修复(Non-homologous End Joining,NHEJ)。NHEJ方式修复的DNA序列可存在一定差异,可使细胞出现功能障碍,甚至死亡。
由PARP-1的生理作用可知,PARP-1在细胞内承担着重要的SSB修复作用,PARP-1的抑制可导致SSB修复失败,持久性SSB 使DNA复制叉的停滞和崩溃而形成DSB。若同一细胞中存在同源重组修复缺陷(HRD),如BRCA表达量减少或ATM、CHK1/2、PALB2、PAD51、PTEN等HRR相关基因缺陷[10],DSB会倾向忠实性低的NHEJ修复途径,易致染色体不稳定、细胞周期阻滞或凋亡。在该过程中,若只有HRR通路阻滞或PARP抑制两者中一者存在,细胞存活可几乎不受影响,但当两者同时存在,即可导致细胞死亡,此即合成致死理论(synthetic lethality)[6]。该理论为目前PARPi药物对肿瘤细胞高度选择性和高效致死性的主流机制学说。
2.2.2捕获:前文中提到PARP-1以NAD+ 为ADP供体,使靶蛋白“PAR化”。而目前已知的 PARPi化学结构均与NAD+中的烟酰胺结构相似,PARPi可以此结合到PARP-1的 NAD+ 结合袋,使PARP-1形成构象异构,从而抑制PARP-1从DNA损伤处释放。之后便与“合成致死”机制殊途同归,由于 DNA-PARP复合物长期存在,细胞长期处于 S 期,持久性SSB可导致DNA复制叉的停滞和崩溃而形成DSB,促进细胞死亡。该过程被称为 DNA-PARP 复合物的“捕获(trapping)”,目前临床PARPi捕获 DNA 的能力大小为 talazoparib≥niraparib > olaparib = rucaparib≥veliparib[11-12]。
3 临床前和临床研究
2016年12月美国食品和药物管理局(FDA)批准Rucaparib用于治疗携带有害生殖细胞BRCA(GBRCA)或体细胞BRCA(SBRCA)突变的高级别卵巢癌(high-grade ovarian cancer,HGOC)患者。下文即对 Rucaparib相关临床试验作一归纳总结(表1)。
临床前实验中,Rucaparib在BRCA突变以及其他HR相关基因敲除(eg, RAD51, FANCM, PALB2, ATR)的细胞系、异种移植物中显示出良好的减瘤活性,以此确认了合成致死假说[13],另一条机制“PARP诱捕作用”也在临床前实验中被发现[14]。Ihnen M等[15]在体外实验中证明Rucaparib与化疗药物有协同作用。Wilson RH等[16]在Ⅰ期临床试验(NCT01009190)中研究PARPi与化疗药物的协同作用,发现化疗与PARPi联合使用会导致毒性增加。同时药物代谢动力学表明,Rucaparib的半衰期为12 h,生物利用度良好(36%),不受静脉化疗的影响。
Ⅰ/Ⅱ期临床试验中,NCT00664781以BRCA突变类型(BRCA1/2)和肿瘤类型(卵巢癌)将患者分为4组,静脉间断vs.持续给予单药Rucaparib。结果表明连续用药、卵巢癌、长PFI(platinum-free interval,末次铂类药物化疗给药时间与肿瘤进展的时间间隔)患者受益最大[17]。另一临床试验Study10(NCT01482715)在于确定PR2D和Rucaparib初步疗效,共分为三部分。第一部分递增药量(92 mg od - 600 mg bid),确定PR2D为 600 mg bid。第二部分研究Rucaparib对gBRCAmut、铂敏感/不敏感HGOC患者的疗效,2A部分选取的42位患者在每天服用两次600 mg rucaparib 之后,客观缓解率(ORR)达到了60%(25/42患者),反应期中位数(DOR)为7.8个月[18],2B部分的结果仍在等待中。第三部分研究大剂量片剂Rucaparib(300 Mg)在g/sBRCAmutHGOC患者的药物代谢动力学和安全性,该部分结果尚未公开[19]。
Ⅱ期临床试验中,ARIEL2(NCT01891344)是一项多中心、两部分的开放研究,旨在评估Rucaparib在复发HGOC中的作用。第一部分的队列分为3组:①BRCA突变(BRCAmut)组、②BRCA野生型和高LOH(BRCAwt/LOHhigh)组、③BRCA野生型和低LOH(BRCAwt/LOHlow)组。第一组患者中,RECIST(实体肿瘤的反应评价标准)客观缓解率为80.0%(32/40患者),中位DOR为11.2个月,中位无进展生存期(PFS)为12.8个月;第二组患者中,RECIST总体反应率为28.0%(23/82患者),中位DOR为11.0个月,中位PFS为5.7个月;第三组患者中,根据RECIST 1.1的ORR为10.0%(7/70患者),中位DOR为5.8个月,中位PFS为5.2个月。结果表明LOH是预测BRCA野生型肿瘤对Rucaparib反应的有力指标,敏感性为78%。但部分BRCAwt/LOHlow患者也可从PARPi中受益,而LOH对该部分患者预示作用不佳。此外,该实验还在血浆样本中检测到循环肿瘤DNA(ctDNA)TP53突变,提示ctDNA作为预测因子的可能性[20]。
Ⅲ期临床试验中,ARIEL 3(NCT01968213)是一项多中心、随机、双盲、安慰剂对照的第三阶段研究,评估Rucaparib作为维持治疗的有效性和安全性。将铂敏感HGOC患者以HRD状况、倒数第二铂基化疗、放射治疗前PFI(6~12个月vs.12个月)和对最后一次铂基治疗反应进行分层。实验确认在铂敏感、复发性卵巢癌患者中,PARPi作为化疗后维持治疗,安全有效[21]。其他正在进行的临床试验有ARIEL2第2部分(NCT01891344),旨在探讨Rucaparib在PFI中的作用,并进一步评估LOH评分在筛选敏感人群中的作用;ARIEL4(NCT 02855944)是第一个将Rucaparib与标准化疗方案相对照,比较疗效和安全性的临床试验。若该试验结果阳性,将有充分证据证明Rucaparib能够成为BRCA突变的复发性晚期卵巢癌患者除化疗外的另一有效选择。
4 未来发展和小结
尽管目前对卵巢癌的认识及治疗取得了较大进展,但因其症状出现较晚,死亡率仍高居不下。手术联合化疗的传统疗法虽有效,但复发和耐药一直是困扰临床的难题。Rucaparib作为PARPi中的一种新药,可对复发性晚期卵巢癌患者进行维持治疗,但其长期不良反应还未明确。除能抑制PARP1/2/3外,对其他酶也有一定的抑制作用,这也是Rucaparib的特殊之处,但此特性在临床方面还未得出明确结论。目前Rucaparib虽已批准上市,但在卵巢癌治疗应用中仍面临着许多挑战:①上市时间短,潜在的长期毒性、长期不良反应和继发性致癌作用尚不明确,需要进一步的临床试验和上市后的随访数据;②目前为止所进行的实验并未显著显示0S(总生存期)的延长[22];③Rucaparib对于卵巢癌的最佳治疗策略尚未确定[23];④仍需探索更加成熟敏感的生物标志物,预测卵巢癌患者对Rucaparib治疗的反应[24];⑤对Rucaparib有效人群的筛选方法需要进一步的改进与简化。随着研究的深入,相信一些正在进行的临床试验结果会让人拭目以待。
表1 Rucaparib临床试验

期别实验对象条件结论Ⅰ期NCT01009190实体瘤iv/oral+不同化疗方案良好生物利用度,不受静脉化疗影响Ⅰ期/Ⅱ期NCT006647811卵巢癌(gBRCAmut+ukBRCA)iv 4-18mg/m2×5d q3wRP2D为18 mg/m22间断vs连续iv 18 mg/m2oral 92 mg od -600 mg bid1、连续用药,卵巢癌,长PFI获益最大2、最大耐受剂量为600 mg bid,连续21 dStudy 101实体瘤oral 40~500 mg od/240~840 mg bid1、最大耐受剂量为600 mg bid2、可空腹食用2A HGOC+gBRCAmut+2-4基础化疗+铂敏感oral 600 mg bid对卵巢癌+HGOC+gBRCA+铂敏感患者效果良好B HGOC+gBRCAmut+2-4基础化疗+铂敏感/不敏感//3实体瘤、g/sBRCAmut高剂量片剂(300 mg)Ⅱ期ARIEL21HGOC+≥1基础化疗+铂敏感(BRCAmut,BRCAwt/LOHhigh,BRCAwt/LOHlow)oral 600 mg bid每28天1、LOH是BRCAwt肿瘤对Ruca-parib反应的优良预测指标,敏感性为78%3、ctDNA有望成为另一预测指标2HGOC+3-4基础化疗+铂敏感/不敏感//Ⅲ期ARIEL3/HGOC+铂敏感(BRCAmut,HRD,ITT)oral 600 mg bid vs 安慰剂,每28天1、铂敏感卵巢癌复发后维持治疗有良好疗效2、PARPi对非BRCAmutHRD也有效3、部分BRCAwt/LOHlow患者也可受益,但LOH预示作用不佳
缩写: iv, 静脉注射; RP2D(recommended Phase II dose)第二阶段推荐剂量; g(germline)生殖细胞; mut(mutant)突变; uk(unknown)未知; wt(wild-type)野生型; LOH(loss of heterozygosis)杂合性缺失; q3w, 每3周; od,1次/d; bid,1次/2 d; ITT(intention-to-treat population)期望治疗人群
