红椎林中正红菇生境的土壤肥力及真菌多样性特征
2020-04-22任奎瑜赵久成王帅帅张传进庞师婵杨尚东
任奎瑜,赵久成,郭 霜,王帅帅,张传进,庞师婵,杨尚东*
(1.广西大学农学院植物科学国家级实验教学示范中心,广西 南宁 530004;2.广西钦州市农业科学研究所,广西 钦州 535000)
【研究意义】正红菇(Russulavinosa)是真菌门(Eumycota)担子菌亚门(Basidiomycotina)层菌纲(Hymenomycetes)担子菌亚纲(Homobasidiomycetes)伞菌目(Agaricales)红菇科(Russulaceae)红菇属(Russula)食用菌,又名红椎菌、红菌,是一种与楮树、栲树、椎木等的根系共生的菌根类真菌,在红(白)椎林和特定的气候、环境和土壤条件下才能生长[1-4]。正红菇是一种十分珍贵的食用菌,含有丰富的蛋白质、多糖、维生素和酶等,味道鲜美,具有提高免疫力、抗辐射、养血壮体、护肤美颜、防癌抗癌及延缓衰老等多种保健功效[5-7]。但由于生长环境特殊和相关技术限制,正红菇仍处于野生繁殖状态,未见大规模人工培育的报道。广西钦州市灵山县高李村位于浦北西侧,盛产正红菇,林地以红椎、马尾松、桉树和荔枝等树木为主。正红菇发生于红椎林,而相同区域的马尾松林、桉树林和荔枝园却无法长出正红菇,其根本原因尚不可知。因此,分析正红菇生长繁殖与其着生林地土壤环境特征之间的关系,对人工栽培正红菇或人为措施提高正红菇产量具有重要意义。【前人研究进展】广西红椎林生长的红菇属真菌主要有葡酒红菇(Russulavinosa)、鳞盖红菇(Russulalepida)、血红菇(Russulasangninea)和蔷薇色红菇(Russularosacea)[1,8]。韦仕岩等[8]调查发现,红椎林内植被组成较简单,主要分为乔木层、灌木层、草本层和地被物层,其中地被物层分布范围较窄,仅在坡间的小溪两侧出现一些地衣和苔癣植物;正红菇仅发生于红椎林间,椎树以外的植被只发挥生态调节作用。曾广宇等[9]研究显示,有机质含量丰富、质地疏松、透气保湿性好、pH 4.5左右、肥力中等的土壤有利于正红菇菌根的形成与发展,土壤肥力低的红椎林地块出产的正红菇菇柄细而长,菌盖薄且小,菌的等级与价格偏低,而施用有机肥可有效提高正红菇的产量和品质。近年来,虽然人们对菌根菌与植物的共生生物学特性研究取得了长足的进展,但许多认知仍停留在表面现象上,缺乏将菌根菌与宿主植物作为一个整体的相关研究,对菌根菌子实体形成的生理生化知识匮乏,导致人工条件下孢子不易萌发,菌丝体培养困难,难以形成子实体,而且大多数外生菌根菌难以用人工栽培方法建立与宿主之间的共生关系,导致至今仍无法进行人工栽培[10-11]。已有研究发现,植物根圈促生微生物不仅能提高外生菌根菌对植物根部的侵染效率[12],还能与外生菌根菌互作,从而改善土壤肥力并促进植物对养分的吸收[13]。【本研究切入点】目前,针对红椎林土壤优势微生物类群及相应肥力状况及正红菇生长繁殖与其着生林地土壤环境特征关系的研究鲜见报道。【拟解决的关键问题】基于传统实验方法和现代高通量测序技术,分析红椎林土壤的生物学性状及真菌多样性特征,揭示正红菇着生环境的土壤肥力和真菌优势菌群等特征,为正红菇的人工栽培及人为提高正红菇产量和品质提供技术支撑。
1 材料与方法
1.1 试验地概况
采样地位于广西钦州市灵山县高李村(东经109°16′31″,北纬22°12′30″),地形以丘陵为主,属亚热带季风气候,雨量充沛,阳光充足,年均气温21.7 ℃,年无霜期平均348 d,年均降水量1658 mm,且多集中在夏季。
1.2 试验材料
试验材料于2018年10月在灵山县高李村采集。分别采集红椎林土壤(A区域)、马尾松林土壤(B区域)、桉树林土壤(C区域)和荔枝园土壤(D区域)。取样时去除土壤表层杂质,采集各树种根系附近3 cm的土壤。采用随机取样法,每个树种选3棵树,每棵树取1个土壤样本,装入无菌封口袋并标记。样品带回实验室后,分为2部分,一部分置于室内自然风干,用于理化性状分析;另一部分过10目筛网,分别用于生物学性状和土壤真菌多样性分析。
1.3 试验方法
1.3.1 土壤可培养微生物数量测定 土壤可培养微生物数量采用稀释平板法[14]测定,其中,细菌使用牛肉膏蛋白胨琼脂培养基培养,真菌采用马丁氏琼脂培养基培养,放线菌采用改良高氏1号培养基培养。
1.3.2 土壤C、N、P循环相关酶活性测定β-葡糖苷酶(β-Glucosidase)采用Hayano[15]的方法测定,磷酸酶(Phosphodiesterase)采用Tabatabai[16]的方法测定,氨肽酶(Aminopeptidase)采用Ladd[17]的方法测定。
1.3.3 土壤微生物生物量测定 土壤微生物生物量C采用氯仿熏蒸提取法测定,土壤微生物生物量P采用氯仿熏蒸提取—磷钼蓝比色法测定,土壤微生物生物量N采用氯仿熏蒸提取——茚三酮比色法[18]测定。
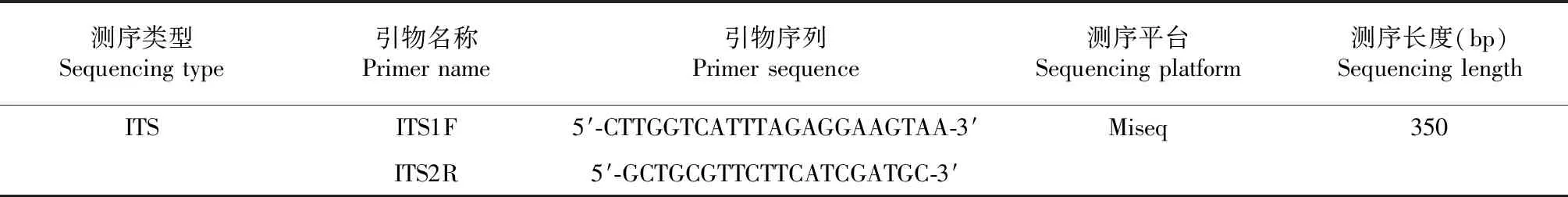
表1 测序类型及引物序列Table 1 The sequence type and primer sequence
1.3.4 土壤真菌多样性分析 土壤真菌多样性分析由上海美吉生物医药科技有限公司使用Miseq[19]平台进行高通量测序,测序类型与引物序列见表1。
测序流程:首先通过基因组DNA抽提后,1.0 %琼脂糖凝胶电泳基因组DNA。利用ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)引物对特定片段进行PCR扩增:95 ℃预变性3 min;进行27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s);72 ℃后延伸10 min;最终保温10 ℃直至扩增结束。凝胶回收试剂盒切胶回收PCR产物,Tris-HCl缓冲液洗脱,2.0 %琼脂糖电泳检测,氢氧化钠变性,产生单链DNA片段。
1.3.5 构建物种群落柱形图和土壤物种组成Venn图 利用上海美吉生物医药科技有限公司提供的数据分析平台I-Sanger进行多样性在线分析并构建物种群落柱形图和土壤物种组成Venn图,分析土壤真菌门水平和属水平的群落多样性,探究不同区域土壤真菌群落的结构与优势菌群特征。
1.4 统计分析
试验数据采用Excel 2013和SPSS 21.0进行统计分析。
2 结果与分析
2.1 红椎林土壤的生物学性状特征
2.1.1 红椎林土壤的可培养微生物数量 由表2可知,A区域土壤的可培养细菌和放线菌数量均显著高于B、C和D区域土壤(P<0.05,下同),可培养真菌数量也以A区域最高,但与B、C和D区域土壤差异不显著(P>0.05,下同)。此外,B区域的可培养细菌数量显著高于C和D区域,可培养放线菌数量高于C和D区域,但差异不显著。说明红椎林土壤的可培养细菌与放线菌数量明显高于马尾松林、桉树林和荔枝园,而可培养真菌数量无显著差异。
在那一刻,她感受到内心一块沉静的凹陷。她从未见过故乡春梅。此刻她知道,它从未远离。它是她身体内部的骨骼和血肉。它不会消失,她的存在就是它在世间存活的凭据并且将继续延续。
2.1.2 红椎林的土壤酶活性 由表3可知,A区域土壤的β-葡糖苷酶活性显著高于B、C和D区域,B、C和D区域土壤的β-葡糖苷酶活性以D区域最高且显著高于B和C区域;土壤磷酸酶活性以C区域最高,A区域次之,D区域最低,但4个区域间无显著差异;土壤氨肽酶活性以C区域最高,显著高于其他区域,而A区域土壤的氨肽酶活性最低,且显著低于其余区域。说明红椎林土壤较马尾松林、桉树林和荔枝园土壤具有更高的β-葡糖苷酶活性,更低的氨肽酶活性。

表2 不同林(园)区土壤的可培养细菌、真菌和放线菌数量Table 2 The amount of cultivable bacteria,fungi and actinomycetes in different forest soils
注:同列数据后不同小写字母表示差异显著(P<0.05),下同。
Note:Different lowercase letters in the same column represented significant difference. The same as below.

表3 不同林(园)区的土壤酶活性Table 3 Soil enzyme activities in different forest soils

表4 不同树种根际土壤的微生物生物量C、N和P含量Table 4 Soil microbial biomass C,N and P content in rhizosphere soil of different forests (mg/kg)
2.1.3 红椎林的土壤微生物生物量C、N、P含量 由表4可知,土壤微生物生物量C含量以D区域最高,显著高于其他3个区域,C区域的土壤微生物生物量C含量最低,A区域次之,但A、B和C区域间无显著差异;土壤微生物生物量N含量以B区域最高,显著高于A、C和D区域,A区域的土壤微生物生物量N含量次之,但与C和D区域无显著差异;土壤微生物生物量P含量以D区域最高,显著高于A、B和C区域,C区域的土壤微生物生物量P含量最低,A区域次之,但A、B和C区域间无显著差异。说明在4种林(园)中,红椎林的土壤微生物生物量C、N、P含量总体上均处于中等偏低水平。
2.2 红椎林的土壤真菌多样性特征
2.2.1 土壤真菌的Alpha多样性分析 稀疏曲线可反映样品群落的多样性,即检验测序深度可反映其所包含的微生物多样性。从图1可看出,当测序数据量达50 000时,各样品的稀疏曲线趋于平缓,说明测序数据量合理,完全可反映样品中真菌菌群的多样性信息,而继续测定更多的数据量仅会产生少量新的OTU(Operational taxonomic units,一种分类水平,按序列之间的相似性进行聚类而形成的分类单元)。
Alpha多样性指数能反映群落的丰富度和多样性特征,Shannon指数与Simpson指数是衡量微生物多样性的指数之一。由表5可知,不同林(园)区土壤的真菌多样性Shannon指数、丰富度Ace指数和Chao指数均以D区域最高,且显著高于A、B和C区域,而Simpson指数以A区域最高,且显著高于B、C和D区域;各区域土壤真菌的多样性Shannon指数排序为D区域>C区域>B区域>A区域,与Simpson指数排序相反。说明红椎林的土壤真菌多样性较低,与其他3种人工林相比结构相对单一。

图1 不同林(园)区土壤真菌OTU数量的稀疏曲线Fig.1 Rarefraction curve of OTU with fungi indifferent forest soils
2.2.2 土壤真菌优势群落分析 基于门分类水平发现,所测样品由5个优势真菌门组成,分别为Basidiomycota(担子菌门)、Ascomycota(子囊菌门)、Zygomycota(接合菌门)、Rozellomycota和未分类的真菌菌门(图2)。其中,A区域中优势真菌类群占比大于1.0 %的优势菌门主要由担子菌门、子囊菌门和接合菌门组成,以担子菌门所占比例最大,为92.25 %,其次为子囊菌门和接合菌门;而B区域的真菌优势菌群组成与A区域存在差异,占比组成大于1.0 %的优势真菌门除担子菌门和子囊菌门真菌与A区相同外,未分类的真菌菌门占比达18.53 %;C区域真菌优势菌群占比组成大于1.0 %的优势菌门由担子菌门、子囊菌门、接合菌门和未分类的真菌菌门组成;D区域真菌优势菌群占比组成大于1.0 %的优势菌门最多,分别由担子菌门、子囊菌门、接合菌门、Rozellomycota和未分类的真菌门组成(表6)。说明红椎林土壤中担子菌门真菌具有高占比,是主要优势菌门,而其余3个区域土壤呈现更多样的优势菌门。

表5 不同林(园)区的土壤真菌Alpha多样性指数Table 5 Alpha diversity index of fungi in different forest soils
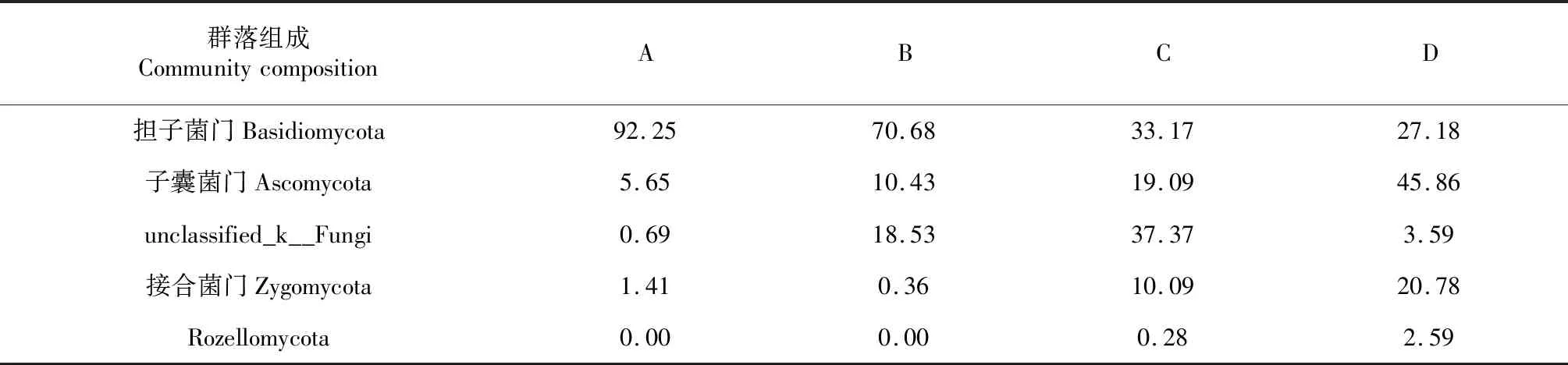
表6 不同林(园)土壤中真菌门分类水平优势菌群组成占比Table 6 Percent of dominant community on phylum level of fungi in different forest soils (%)

图2 不同林(园)区土壤真菌门分类水平的群落相对分布Fig.2 Relative distribution of community on phylum level of fungi in different forest soils
2.2.3 土壤真菌群落分析结果 物种Venn图主要用于统计多个样本中所共有和独有的OTU数目,可直观地表现不同林(园)区土壤真菌属分类水平组成的相似性及重叠情况。结果(图4)发现,在属分类水平上,A区域含有真菌属145个,B区域含有真菌属118个,C区域含有真菌属220个,D区域含有真菌属276个,4种不同林(园)区土壤中有67个共有的真菌属,占全部真菌属的8.83 %;A区域有11个特有真菌属,占A区域总真菌属的7.59 %;B区域有8个特有真菌属,占该区域总真菌属的6.78 %;C区域有38个特有真菌属,占该区域总真菌属的17.27 %;D区域有100个特有真菌属,占该区域总真菌属的36.23 %。说明红椎林土壤的特有真菌数量在真菌属水平相对较少,与马尾松林、桉树林和荔枝园土壤真菌的相似性较大。
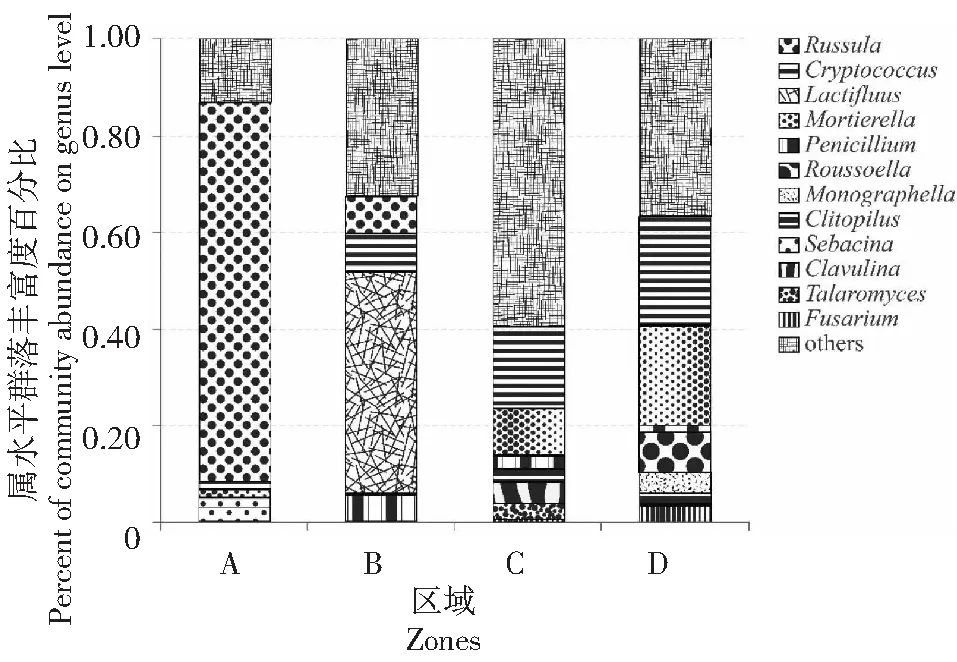
图3 不同林(园)区土壤真菌属分类水平的群落相对分布Fig.3 Relative distribution of community on genus level of fungi in different forests soils

表7 不同林(园)土壤中真菌属分类水平优势真菌属的组成占比Table 7 Percent of dominant community on genus level of fungi in different forest soils (%)
3 讨 论
细菌占整个土壤微生物群落的70 %~90 %,在维护土壤健康、拮抗土传病害及养分循环等方面发挥重要作用[20]。真菌在土壤微生物群落中所占比例仅次于细菌,可分解糖类、淀粉、纤维素、木质素和单宁等多种有机物,并参与腐殖质的形成和分解、进行氨化作用和硝化作用,尤其在酸性森林土壤有机质的转化中起重要作用[21]。本研究中,红椎林土壤中的可培养细菌、放线菌数量均显著高于其他3种林(园)区土壤,但可培养真菌数量与其他3种林(园)区土壤无显著差异,可能与红椎林中正红菇的出菇和生长需要更苛刻的环境条件有关,如专一的根系分泌物、空气、土壤温度、水分及适宜的土壤pH和碳氮比等,而微生物数量多的环境可能更有利于形成和维护正红菇出菇及生长所需的环境条件。
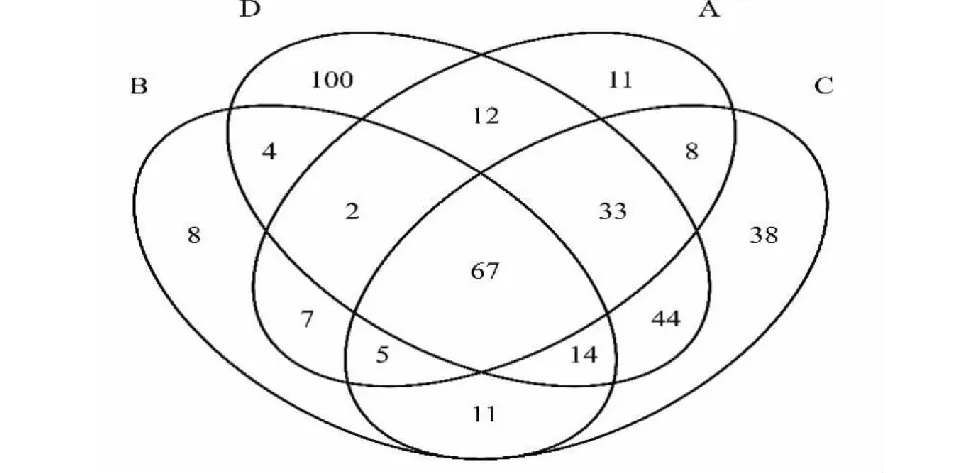
图4 不同林(园)区土壤真菌属分类水平的Venn图Fig.4 Diagram of Venn on genus level of fungi in different forest soils
土壤酶参与土壤中几乎所有有机物质和营养元素的循环[22],其活性不仅能指示土壤生态系统功能变化的多样性和稳定性[23],亦是评价土壤健康和肥力水平的重要指标[24]。本研究中,红椎林土壤中除磷酸酶活性与其他林(园)区土壤无显著差异外,β-葡糖苷酶活性显著高于其他3种林(园)区土壤,氨肽酶活性显著低于其他3种林(园)区土壤,表明与其他林(园)区土壤相比,红椎林土壤具有特异的碳、氮循环相关酶活性。该现象可能与正红菇的繁殖和生长均需适宜基质(土壤)碳氮比紧密相关,即自然界可能以自我调节的方式调控土壤中涉及碳、氮循环相关酶的活性以实现正红菇繁殖与生长所需的碳氮比。土壤微生物生物量C、N、P含量亦是衡量土壤质量、指示土壤肥力和作物生产力的一个重要指标[25]。红椎林土壤中的微生物生物量C、N、P含量在4种林(园)区土壤中处于相对较低的水平,不仅低于人为干扰频繁的荔枝园土壤,还低于以用材林为用途的马尾松林和桉树林,可能与对正红菇的生境特性缺乏科学认知,目前仍无科学管理良策,导致仅有天然产出而鲜有人为投入,从而出现指示红椎林土壤肥力状况的微生物生物量偏低的现象有关。
Shannon指数是用于衡量物种多样性的指数,Simpson指数表示在群落中随机抽样的个体属于同一物种的概率,也用来衡量物种多样性,Ace指数和Chao指数是衡量物种丰富程度的指数,数值的大小表示物种丰富度的高低。Ace和Chao指数越大,说明物种的丰富度越高;而Shannon 指数越大,Simpson指数越小,说明样品的物种多样性越高[26-28]。本研究基于高通量测序技术分析发现,4种林(园)区土壤中的真菌Alpha多样性以人为干扰最频繁的荔枝园土壤最高,可能与荔枝园在实际生产中进行更频繁的施肥紧密相关;红椎林土壤中的真菌Alpha多样性在另3种林区土壤中呈现低值,可能与其更为单一的优势真菌门属组成紧密相关。基于门分类水平发现,红椎林土壤中的优势真菌门虽然与其他3种林(园)区土壤相仿,主要由担子菌门、子囊菌门、接合菌门、Rozellomycota和未确定的门类组成,但不同门类真菌的占比差异明显。其中,担子菌门是红椎林土壤的主要优势真菌门类,组成占比达92.26 %,已有研究发现,大多数土壤真菌属于担子菌门或子囊菌门[29],但在用材林(马尾松林和桉树林)及荔枝园土壤中,担子菌门真菌的占比明显降低,呈现拥有更为多样的优势真菌门类。在属分类水平上,4种不同林(园)区土壤中虽然拥有相似的优势真菌属组成,但红椎林土壤中优势真菌属组成更简单,红菇属是红椎林土壤中的优势真菌属,占比达78.37 %;与之相比,马尾松林土壤中红菇属真菌的占比仅有7.58 %,而桉树林和荔枝园土壤中红菇属真菌占比为零。说明4种林(园)虽然具有相同的环境条件,但红椎林中能产出正红菇,而马尾松林、桉树林和荔枝园却无法长出正红菇的根本原因,应为红菇属真菌的繁殖与生长需要专一的共生体与特定环境。
4 结 论
不同林(园)土壤肥力状况不是正红菇长出与否的决定性因素;红椎林土壤中的担子菌门红菇属真菌数量显著高于马尾松林土壤,而桉树林和荔枝园土壤中红菇属真菌占比为零,即红椎林土壤具有富集担子菌门红菇属真菌的功能,且红菇属真菌的繁殖与生长需要专一的共生体与特定环境,是红椎林出产正红菇的根本原因。
