温室中患白粉病与健康草莓植株根际原核生物群落的比较研究
2020-04-22杨俊誉魏世杰苏代发张振荣陈杉艳罗志伟沈雪梅赖泳红ArslanJamil童江云崔晓龙
杨俊誉,魏世杰,苏代发,张振荣,陈杉艳,罗志伟,沈雪梅,赖泳红,Arslan Jamil,童江云*,崔晓龙*
(1. 云南大学生命科学学院,云南 昆明 650091;2. 昆明市农业科学研究院,云南 昆明 650034)
【研究意义】草莓(Strawberries)属于蔷薇科Rosaceae草莓属Fragaria植物,具有较高的营养价值和经济价值,据联合国粮食及农业组织(FAO)发布的权威数据(http://www.fao.org/faostat/en/#data/QC/visualize)显示,全世界草莓种植的面积和产量从1994-2016年呈逐年增加的趋势,而中国草莓种植的规模同样逐年扩大,且草莓产量稳居世界首位[1]。【前人研究进展】目前,草莓白粉病(Strawberry Powdery Mildew)已经成为危害中国草莓种植、严重影响草莓产量、品质和经济效益的主要真菌病害[2]。由于白粉病危害草莓的叶、花和果实,并在草莓果实的表面形成薄薄的白色菌丝层,而草莓果实是可直接食用的浆果,因此有害化学药剂的残留必然会导致食品安全问题和对人体造成的危害,所以高效的分离、筛选对草莓白粉病病原菌具有显著拮抗功能的植物益生菌,是实现未来草莓产业能绿色和可持续发展的重要途径[1,3]。【本研究切入点】根际(Rhizosphere)土壤被认为是植物的“第二基因组”,受植物根部分泌物、微生物和土壤三者的相互作用[4-5]。许多研究发现,植物病害的发生与根际微生物多样性存在一定的相关性,且病原菌在微生物多样性高的土壤中很难生存[6-7]。为此,研究根际微生物群落组成与结构变化为防治植物病害发生提供理论基础和生防原材料。传统的研究方法如平板培养法[8-9]、Biolog方法、磷脂肪酸生物标记法(PLFAs)、变性梯度凝胶电泳(DGGE)方法等[10]往往不能准确揭示土壤微生物的群落组成和结构。目前,高通量测序(High-throughput sequencing, HTS)技术由于操作简单、成本较低、测序速度快、测序通量大和结果可靠等优势,在微生物多样性群落结构研究中广泛应用。一些研究如赵帆等[11]、Li等[12]和Huang等[13]通过高通量技术揭示草莓连作过程中根际微生物由“细菌型”向“真菌型”转变,肖蓉等[7]发现健康草莓根际细菌群落多样性高于患炭疽病草莓根际。【拟解决的关键问题】有关草莓白粉病患病植株根际土壤微生物多样性的研究报道较少,采用高通量技术对温室大棚中草莓白粉病患病植株和健康植株根际土壤中的细菌多样性进行比较研究,可明确草莓白粉病患病对根际土壤原核微生物多样性的影响,从微生物生态学角度探讨对白粉病具有抑制作用的生物因子,为解释草莓白粉病的发生原理和构建科学有效的抗草莓白粉病有益菌的筛选方法提供理论依据。
1 材料与方法
1.1 样品采集
2017年3月在云南省昆明市西山区团结街道云南创农农业科技有限公司(北纬N25°04′9.00″,东经E102°32′12.00″)的温室大棚里采集草莓品种章姬(Akihime)为试材。大棚里有白粉病发病严重的和不发病的草莓植株。在发病区域内选取3处进行“S”形取样,共采集病株15株,整株挖出用无菌袋低温保存带回实验室,抖掉多余的根部土壤,用无菌毛刷刷取根部表面约2 mm的附着土壤,即根际土壤[14]。将15株发病植株根际土壤混合成1个样品置于50 mL无菌离心管中,发病植株根际土壤样品命名为DRZ。在发病区域相邻的健康区域以相同方法采集健康植株,健康植株根际土壤命名为HRZ,将所得样品保存于-80 ℃备用。
1.2 根际土壤微生物DNA的提取
称取根际土壤样品0.5 g,使用PowerSoil(Mobile Biometry, USA)土壤微生物DNA提取试剂盒,按试剂盒说明书进行根际土壤微生物DNA的提取,DNA样品于-20 ℃保存备用。
1.3 高通量测序分析
参照Machuca等[15]的方法,采用原核通用引物16S rRNA基因的V3~V4区(约430 bp),考虑同时对细菌和古菌进行分析与研究。将所有草莓根际土壤样品的基因组DNA分别用无菌去离子水稀释为1 ng/μl备用,并使用稀释完成的DNA进行高通量扩增子PCR。本研究中使用高效高保真酶和带Barcode的特异引物,以及New England Biolabs 公司的Phusion®High-Fidelity PCR Master Mix with GC Buffer进行25 μl体系的PCR扩增。
16S rRNA基因的V3~V4区原核通用引物为[15]:正向引物341F:5’-CCTAYGGGRBGCASCAG-3’; 反向引物806R:5’-GGACTACNNGGGTATCTAAT-3’. PCR扩增条件:95 ℃变性3 min;95 ℃变性30 s,50 ℃复性30 s,72 ℃延伸45 s,进行29个循环;最后72 ℃延伸10 min。将PCR扩增产物进行2 %的琼脂糖凝胶电泳检测,并用Qiagen公司提供的胶回收试剂盒对本研究中利用原核通用引物扩增出的目标条带进行切胶回收。随后的文库构建和文库质量检测分别使用TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒和Qubit及Q-PCR进行定量,最终使用HiSeq 2500 PE250进行测序,本研究中的所有样品均由天津诺禾致源科技股份有限公司完成测序。
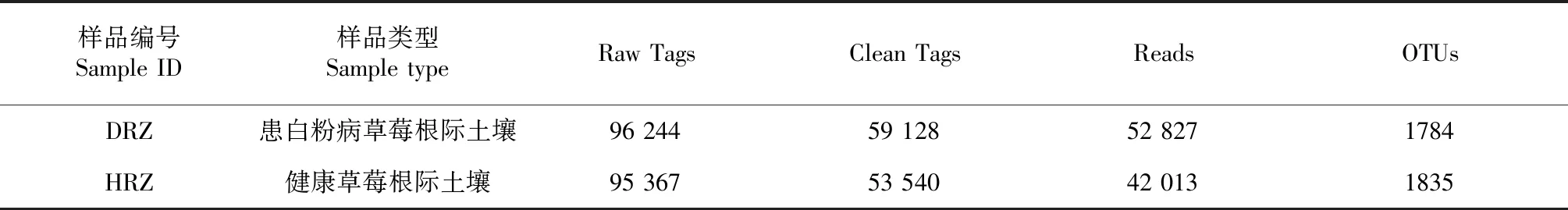
表1 草莓根际土壤微生物的序列信息Table 1 Sequence information of rhizosphere microorganism of strawberries
1.4 数据统计与分析
利用FLASH(V1.2.7)软件对每个样品的reads进行拼接,最终得到高质量的Tags数据(Clean Tags)。Tags数据的质控、过滤和嵌合体的剔除均由软件Qiime(V1.7.0)完成,最终获得有效数据(Effective Tags)。利用97 %的一致性(Identity)阈值将有效序列聚类成为OTU(Operational Taxonomic Unit),对OTU的筛选和分类通过Uparse 软件(Uparse v7.0.1001)完成[16-17]。物种注释是利用Mothur软件将OTU序列与Silva(http://www.arb-silva.de/)物种数据库进行比对分析,软件中相关的阈值设置为0.8~1;所有样品的OTU序列利用MUSCLE(Version 3.8.31)软件进行系统发育分析[17]。最终,所有草莓根际土壤样品均通过最少样本测序量进行抽平处理,然后进行相应的原核生物群落的Alpha和Beta多样性分析。并用Excel 2013和SPSS 20.0软件进行数据处理,利用上海美吉生物医药科技有限公司的I-Sanger云平台完成生物信息学数据分析(http://www.i-sanger.com/)。
Alpha多样性分析能反映草莓根际土壤中原核生物群落的丰富度和多样性,其中Coverage指数通过计算各个样本文库的覆盖率反映样本测序的深度和合理性,数值越高表明样本中序列被检测出的概率越高,测序结果越可靠[16-19]。Shannon指数和Simpson指均用于评估草莓根际土壤中原核生物群落多样性,其中Shannon指数值越大(或Simpson指数值越小),表明样品中原核生物群落多样性越高[17]。样品中原核生物群落的丰富度则通过Chao1指数和Ace指数来反映,而群落的组成则利用Heatmap图以不同颜色梯度呈现[17-19]。
2 结果与分析
2.1 草莓根际土壤样品测序质量评估
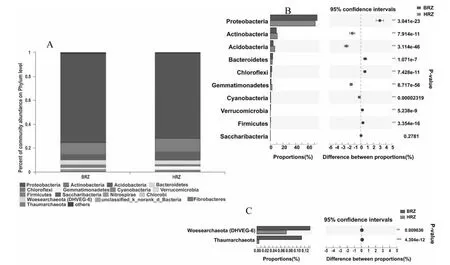
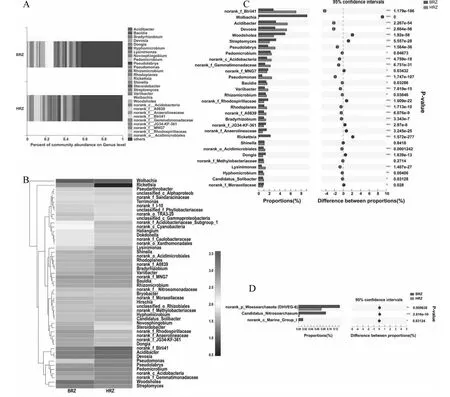
通过对草莓根际土壤微生物16S rRNA基因的V3-V4区(341F/806R)测序,所有样品原始序列总条数为191 611条,过滤优化处理后的总有效序列为112 668条。并用97 %相似度进行物种的OTU分类,所有样品的平均测序长度在420~460 bp。采集的患病草莓根际土壤样品的OTU数量低于健康样品(DRZ 参照文献[18]对所有样品选择相似度为97 %的OTU,进行最小样本序列数的抽平,利用高通量测序后各个样品的Alpha多样性指数(OTU的数量)构建草莓根际土壤样品的稀释曲线(图1)。结果表明,随测序量的加大,所有草莓样品的稀释曲线均趋向于平坦,表明本研究中所有样品的测序数据深度合理,测序结果能全面和真实的反映所有草莓根际土壤样本中原核生物群落和结构多样性的信息。 所有样品的Coverage指数均高于98 %,表明本研究中所有样品的测序结果能真实全面的反映草莓根际土壤中原核生物的多样性。患病草莓根际土壤微生物的Chao1指数和Ace指数分别为2074.2196和2111.9406,而健康草莓根际土壤微生物两者分别为2248.1385和2244.6361,患病样品的两者较健康样品分别减少了8.38 %和6.28 %,说明健康草莓的根际微生物群落丰富度较高;患病草莓根际微生物的Shannon指数和Simpson指数分别为5.6544和0.0143,而健康草莓根际微生物的两者平均值分别为5.7529和0.0106,患病样品的Shannon指数较健康样品减少了1.74 %,而Simpson指数增加了25.87 %。总体显示,所有的微生物群落丰富度和多样性指标均为患病样品(DRZ)小于健康样品(HRZ),说明健康草莓的根际微生物群落多样性高于患病样品。 图1 草莓根际土壤样品稀释曲线图Fig.1 Rarefaction curves of strawberry rhizosphere soil samples 表2 草莓根际土壤微生物群落丰富度和多样性Table 2 OTUs’ abundance and diversity of rhizosphere microorganism of strawberries 2.3.1 门分类水平的比较 草莓根际土壤样品以最小样本的测序量进行抽平优化,结合相似度为97 %的分类阈值利用RDP classifier贝叶斯算法对抽平后所有草莓根际土壤样品的OTU进行物种分类研究[20],并采用数据库Silva 128/16S数据库进行比对,将所有样本的OTU进行物种注释,共获得OTU个数为2631,涵盖了2域2界39门82纲161目326科600属的原核微生物。利用上海美吉生物医药科技有限公司的I-Sanger云平台完成了作图分析(http://www.i-sanger.com/)。根据各个样品在门分类水平物种所占比例(即物种的相对丰度)作图,将每个草莓根际土壤样品中物种相对丰度低于0.1 %的门类群合并为Others,结果如图2所示。图2A表示2个样品在门分类水平上的微生物菌群的组成和结构,共得到相对丰度大于0.1 %的门类有17种,按相对丰度由高到低分别为变形菌门Proteobacteria、放线菌门Actinobacteria、酸杆菌门Acidobacteria、拟杆菌门Bacteroidetes、绿弯菌门Chloroflexi、蓝藻门Cyanobacteria、芽单胞菌门Gemmatimonadetes、疣微菌门Verrucomicrobia、厚壁菌门Firmicutes、Saccharibacteria等,除细菌门类外,还检测到古菌的门类:奇古菌门Thaumarchaeota和乌斯古菌门Woesearchaeota(DHVEG-6),但相对丰度较低。图2B表示健康草莓根际土壤样本(HRZ)和患病样本(DRZ)在门分类水平上相对丰度Top 10的群落组成,进行Fisher’exact test比较,结果表明患病样本BRZ中变形菌门(P<0.01)、拟杆菌门(P<0.01)、绿弯菌门(P<0.01)、疣微菌门(P<0.01)和厚壁菌门(P<0.01)均显著高于健康样本HRZ,而患病样本(BRZ)中放线菌门(P<0.01)、酸杆菌门(P<0.01)、蓝藻门(P<0.01)和芽单胞菌门(P<0.01)均显著低于健康样本HRZ,2个样本中Saccharibacteria(P= 0.27> 0.05)没有显著变化。图2C表示古菌门类在2个样本中的差异,患病样本(DRZ)中奇古菌门(P<0.01)和乌斯古菌门(P= 0.02<0.01)均显著高于健康样本(HRZ)。说明,从门的水平上讲,在健康草莓根际土壤样本和患病样本群落结构中,群落种类大致相同,群落组成比例发生显著改变。虽然变形菌门、放线菌门、酸杆菌门和拟杆菌门均为两者的优势菌群,但相对丰度存在显著差异,同时首次发现了患病植株根际土壤中古菌门类菌群组成比例显著高于健康植株。 2.3.2 属分类水平的比较 为进一步解释草莓根际微生物群落的变化,从属水平进行分析发现,健康样本HRZ和患病样本BRZ群落组成种类基本相同,但群落组成比例存在明显差异(图3)。图3A表示2个样品在属分类水平群落结构和群落比例,其中样本丰度占比低于1 %的菌群合并为Other。健康样品HRZ的微生物群落主要为Other(44.5 %)、norank序列(17.23 %)、Acidibacter(5.42 %)、Devosia(5.29 %)、Pseudolabrys(3.12 %)、木洞菌属Woodsholea(2.84 %)、假单胞菌属Pseudomonas(2.5 %)、链霉菌属Streptomyces(2.07 %)、土微菌属Pedomicrobium(2.44 %)、红游动菌属Rhodoplanes(1.55 %)等,而患病样本BRZ的微生物群落主要为Other(43.21 %)、norank序列(13.96 %)、沃尔巴克氏体属Wolbachia(9.12 %)、木洞菌属(4.98 %)、链霉菌属(3.29 %)、Acidibacter(3.25 %)、Devosia(3.11 %)、土微菌属(2.23 %)、立克次体属Rickettsia(2.23 %)等。因此,2个样本在属分类水平上的群落结构基本相同。图3B表示2个样本群落Heatmap图,选择样本中物种丰度前50的物种进行分析,根据物种丰度的相似性进行聚类,通过颜色的变化反映2个样本在属分类水平上群落组成的相似性和差异性,表明沃尔巴克氏体属和立克次体属在患病样本BRZ中相对丰度极高,而在健康样本HRZ中相对丰度最少。图3C表示2个样品进行Fisher’exact test比较,并展示了2个样本中物种相对丰度前30的菌群,其中患病样本BRZ中物种相对丰度显著高于健康样本HRZ的菌群有沃尔巴克氏体属(P<0.01)、木洞菌属(P<0.01)、链霉菌属(P<0.01)、立克次体属(P<0.01)和Dongia(P<0.01)等;患病样本BRZ中物种相对丰度显著低于健康样本HRZ的菌群有Acidibacter(P<0.01)、Devosia(P<0.01)、Pseudolabrys(P<0.01)、土微菌属(P= 0.047<0.05)、假单胞菌属(P<0.01)、Bauldia(P= 0.03<0.05)、Variibacter(P<0.01)、Rhizomicrobium(P= 0.039<0.05)、红游动菌属(P<0.01)、慢生根瘤菌Bradyrhizobium(P<0.01)等。健康样本HRZ中绝大部分的菌群相对丰度均显著高于患病样本BRZ。图3D表示古菌在属分类水平物种相对丰度的变化情况,由于古菌在2个样本中相对丰度较低,单独对古菌类群进行比较分析,结果表明患病样本BRZ中Candidatus_Nitrosoarchaeum(P<0.01)、norank_p_Woesearchaeota(DHVEG-6)(P<0.01)和norank_c_Marine_Group_I(P= 0.03<0.05)(简称norank类群)等古菌类群均显著高于健康样本HRZ。 A:样品群落结构图;B:物种相对丰度Top 10比较图;C:2个样本古菌属群落比较图A: Sample community structure map; B: Comparison of species relative abundance Top 10; C: Comparison of archaeal communities between two samples图2 原核生物门分类水平的群落比较Fig.2 Comparison of prokaryotic community at phylum level 利用高通量测序技术对16S rRNA基因V3-V4高变区的原核生物通用引物341F/806R进行测序分析,检测了温室大棚中患白粉病草莓根际与健康草莓根际原核生物群落多样性。在97 %的相似度水平下共获得OTU个数为2631,涵盖了2域2界39门82纲161目326科600属的原核生物的群落信息。测序结果表明,同时检测到细菌类群和古菌类群的群落信息,并首次阐述了温室中患白粉病草莓根际与健康草莓根际细菌类群和古菌类群的群落多样性。 在患白粉病的温室大棚中,同时存在患病植株和健康植株,研究表明患病草莓根际土壤微生物(包括细菌和古菌)的Shannon指数、Simpson指数、Chao1指数和Ace指数等多样性指数值均低于健康植株根际土壤。患病样本(BRZ)和健康样本(HRZ)在门分类水平上得到的优势菌群均为变形菌门、酸杆菌门、放线菌门和拟杆菌门,其中变形菌门在2个样本中的相对丰度均为最高。同时还检测到在2个样本中均包含两个古菌门类:奇古菌门和乌斯古菌门,患病植株根际土壤中古菌门类菌群显著高于健康植株。因此,2个样本门分类水平菌群组成大致相同,但相对丰度存在显著差异。许多研究表明,健康植株根际土壤微生物数量多、多样性高,如:肖蓉等[7]以健康草莓根际与患炭疽病草莓根际为研究对象,发现健康草莓根际细菌群落组成和多样性指数显著高于患病根际土。赵帆等[11]和Li等[12]揭示不同连作草莓根际细菌和真菌多样性的发生显著变化。 在属分类水平上,健康样本(HRZ)的优势菌属为norank类群、Acidibacter、Devosia、Pseudolabrys、木洞菌属、假单胞菌属等,而患病样本(BRZ)的优势菌属为norank类群、沃尔巴克氏体属、木洞菌属、链霉菌属、Acidibacter、Devosia等,2个样本在属分类水平上的细菌群落组成和结构发生了明显变化,同时还检测到患病样本中的古菌在属分类水平上的群落丰度显著低于健康样本。因此,草莓根际土壤细菌类群和古菌类群多样性降低、群落结构改变是草莓白粉病发生的病因之一。 A:样品群落结构图;B:物种相对丰度Top 50的Heatmap图;C:2个样本群落比较图;D:2个样本古菌属群落比较图A:Sample community structure map; B: A Heat map of the relative abundance of species Top 50; C: Comparison of two sample communities; D: Comparison of archaeal communities between two samples图3 原核生物属分类水平的群落比较Fig.3 Comparison of prokaryotic community at genus level 国内外研究表明,假单胞菌属的细菌具有拮抗、固氮、溶磷和产IAA等丰富多样的促生和抗菌功能,在农业生产中得到广泛应用[5, 7]。武哲等[21]从土样中分离得到放线菌菌株1706,通过分子鉴定该菌株为利尻链霉菌Streptomycesrishiriensis,利用其发酵滤液对草莓白粉病防效达81.25 %,是防治草莓白粉病的潜在生防菌株。实验中假单胞菌属在健康样本(HRZ)中占2.5 %,而在患病样本(BRZ)中占0.66 %,健康植株根际土壤含量显著高于患病植株样本(P<0.01)。因此,根据纯培养的方法,可以从健康样本中选择性培养假单胞菌属细菌,从中筛选防治草莓白粉病的拮抗菌,为生防菌的筛选提供一条捷径。链霉菌属在健康样本中含量显著低于患病样本(P<0.01),说明有更多的链霉菌属参与了草莓白粉病的防御工作,作为具有防治草莓白粉病的潜在生防菌属,将为生物防治提供有效的生防材料。此外,还有古菌类群被检测出来,虽然含量较少,但在2个样本中的含量却具有显著差异,因此,在解释和阐述草莓白粉病发生和生防机制时可以考虑其作用。 值得注意的是,沃尔巴克氏体属和立克次体属在患病草莓根际土壤中被检查出来,含量分别为9.12 %和2.23 %,而在健康样本中含量分别为0.03 %和0.01 %,差异显著且在健康样本中含量极少。有研究表明,沃尔巴克氏体属能与现阶段地球上存在的1000~3000万种昆虫种类中66 %以上的昆虫种类共生,它可能是节肢动物共生微生物中分布范围最广,感染丰度最大的类群[22-23]。在温室大棚中,很少有风或强气流的流动,不具备白粉病传播扩散的条件,但在温室大棚中,能观察到不同区域爆发白粉病。因此,与昆虫共生的沃尔巴克氏体属含量的变化,说明可能昆虫作为病害的传播媒介,导致草莓白粉病的传播。所以,在温室大棚中进行草莓白粉病防治时,应考虑昆虫传播病害的潜在危害。立克次体属是一类具有传播和引起人类与其它脊椎动物疾病的胞内共生菌,其中能引起脊椎动物疾病的立克次体属细菌,其部分生活史是在节肢动物体内完成[24]。因此,从食品安全的角度考虑,患白粉病的草莓植株不应用于动物饲料及其它生产加工用途,草莓果实也不应加工成产品供人类食用。同时研究发现2个样本中存在大量的norank类群,目前的数据库中无法获取该部分序列的分类学信息,推测该部分序列可能是一些新的微生物类群,因此,还需使用其它的技术手段进一步鉴定,从中获取有用的潜在微生物资源。 温室中患白粉病草莓植株根际土壤原核生物多样性显著低于健康草莓根际土壤(P<0.01),两者根际的细菌类群和古菌类群的群落结构发生显著变化,究其原因是草莓根际原核生物多样性降低、群落结构的改变;而假单胞菌属和链霉菌属可作为防治草莓白粉病的潜在生防资源;温室中,昆虫扮演了草莓白粉病传播者的角色;同时,患白粉病的草莓果实应禁止供人类和动物食用。2.2 草莓根际土壤微生物多样性分析


2.3 草莓根际土壤微生物物种组成分析
3 讨 论
4 结 论
