海南番木瓜炭疽病病原菌鉴定及其防治药剂筛选
2020-04-22周子骞高兆银洪小雨李春霞胡美姣
周子骞,李 敏,高兆银,王 义,洪小雨,李春霞,胡美姣*
(1. 中国热带农业科学院环境与植物保护研究所,海南 海口 571101;2. 宣化科技职业学院,河北 张家口 075100;3. 华中农业大学植物科学技术学院,湖北 武汉 430070;4. 海南大学热带农林学院,海南 海口 570228)
【研究意义】番木瓜 (Caricapapaya) 俗称木瓜,又名乳瓜、番瓜、万寿果,素有“岭南果王”之誉,属番木瓜科 (Caricaceae)番木瓜属 (Carica)[1],为多年生常绿软质小乔木。在我国主要产区有海南、广东、广西、云南、福建和台湾等省区[2]。番木瓜炭疽病则是番木瓜种植区主要病害之一,特别是在果实成熟采摘期及贮运期间由其引起的果腐尤为严重。【前人研究进展】目前国外已报道引起番木瓜炭疽病的病原真菌有Colletotrichumacutatum、C.brevisporum、C.capsici、C.demetium、C.magna以及C.truncatum等[3-6],国内已报道的有辣椒炭疽菌(C.capsici)和胶孢炭疽菌(C.gloeospcrides)[7-8]。【本研究切入点】为了明确海南番木瓜炭疽病主要病原菌的类型及筛选适宜的防治药剂,根据病原菌的形态特征,结合r DNA-ITS序列的测序,对该病的病原菌进行分离鉴定,并进行了防治杀菌剂的室内筛选。【拟解决的关键问题】旨在为番木瓜炭疽病的病原识别及科学防治奠定基础。
1 材料与方法
1.1 材料
番木瓜果实主要来自海南省海口市南北水果市场和三亚、儋州等地番木瓜果园,在室温下贮存待其成熟发病;健康果实采自三亚番木瓜果园,挑选新鲜、无损伤、大小成熟度一致的转色期健康果实。
1.2 方法
1.2.1 病原微生物的分离与纯化 从典型炭疽病症状果实的病健交界处取大小约3 mm×3 mm的组织块,用0.1 %升汞酒精消毒30 s左右,用无菌水冲洗3~5次,将组织块置于PDA平板上,待菌落长出后挑取边缘菌丝进行纯化,将获得纯化的菌株进行编号[9]。
1.2.2 病原微生物的致病性测定与病原菌再分离 根据柯赫氏法则,参考何凡等人[10]的方法稍作修改,采用刺伤接种法,对分离的40株病原菌进行致病性测定。把健康果实置于保鲜盒中,用接种针刺伤(直径约5 mm)果实,将培养4 d的菌饼接种到果实上,以接种空白的PDA块为对照,用蘸有无菌水的脱脂棉覆在菌饼上24 h后取下,每个处理接种3个果实,每果实接种6个点,观察发病情况,记录病斑大小,分析致病性强弱。对发病果实再次进行病原菌分离,比较分离前后得到的病原菌的菌落形态、色泽、菌丝及孢子等特征是否一致。试验重复3次。根据病斑大小评价致病力,评价标准为:平均病斑直径:≥20 mm为强致病性,20~10 mm为中等致病性,≤10 mm为弱致病性。
1.2.3 数据分析 采用SPSS19.0 对病斑直径数据进行方差分析。
1.2.4 病原菌鉴定 ① 形态学鉴定:从2种典型症状各筛选出1株强致病菌,分别为C1菌株和G1菌株。将纯化后的2菌株转接到PDA平板上,于28 ℃恒温培养箱培养,每日观察,记录菌落培养特征,显微镜菌丝形态、产孢结构以及分生孢子形态、颜色、大小等特征。② 分子生物学鉴定:采用CATB法提取供试C1菌株和G1菌株的总DNA,采用引物ITS1和ITS4对供试菌株基因组DNA进行PCR扩增,扩增产物由青岛派森诺基因科技有限公司进行测序。测序结果经GenBank中相关菌株的ITS序列进行同源性比较。根据同源性大小结合形态学特征最后鉴定供试菌株的种类[11]。
1.2.5 17种杀菌剂对2菌株的室内毒力测定 ① 供试杀菌剂见表1。②测定方法。采用生长速率法。参考张焱能等人的研究方法[12-15]并适当改进,在培养4 d后的供试菌株菌落边缘取菌块(直径0.5 cm)分别移至浓度为0.1、1.0和100.0 μg/mL含药培养基平板上,然后置于(28±0.5)℃的恒温培养箱中恒温培养3 d后,根据2菌株在不同浓度含药培养基上的生长情况和抑菌率大小,将每种杀菌剂设置5个质量浓度梯度,每质量浓度3个处理,测量菌落大小,计算抑菌率。试验重复3次求平均抑菌率,并以质量浓度的对数值(x)和抑菌率的几率值(y)求毒力回归方程,计算相关系数、EC50值,比较供试17种杀菌剂对2株炭疽菌的毒力大小。
抑菌率(%)=(对照菌落直径-0.5)-(处理菌落直径-0.5)/对照菌落直径-0.5
2 结果与分析
2.1 炭疽病症状、病原菌分离及致病性测定
2.1.1 症状 番木瓜炭疽病的典型发病症状主要有2种,一是在受害果实果面初期出现圆形水渍状小斑点,后期病斑扩大,病斑中央凹陷,其上呈现许多黑色颗粒;二是在受害果实果面初期出现圆形、椭圆形的水渍状斑点,后期病斑扩大,中央凹陷,其上呈现出赭红色的孢子;2种炭疽菌危害果实后,严重时病斑扩展至整个果面,凹陷部果肉硬化(图1)。
2.1.2 病原菌的分离纯化 从2种典型的炭疽病病果上分离病组织,移至PDA培养基上,于28 ℃恒温培养箱中黑暗培养,得到2种形态不同的菌落。一种菌落边缘整齐,产生黑色素使培养基变黑色,菌落灰褐色,气生菌丝稀疏,表面密生黑色颗粒并呈轮纹状排列;另一种菌落边缘整齐,灰白色,气生菌丝白色绒毛状,表面产生粉红色孢子堆。
2.1.3 病原菌的致病性 研究结果表明,供试的40株病原菌对番木瓜果实均具有一定的致病性,而对照未发病,第一种症状分离的18株病原菌,菌株间致病力存在显著差异(P<0.05),其中,C1菌株为强致病力菌株,占该症状分离菌株数的5.56 %,5株为中等致病力菌株,占27.78 %;第二种症状分离的22株病原菌,菌株间致病力存在显著差异(P<0.05),其中,G1和G8为强致病菌株,菌株数占该症状分离菌株数的9.09 %,8株为中等致病力菌株,占36.36 %,强、中致病力菌株见表2。将C1菌株和G1菌株接种发病后的病斑再分离,得到的病原菌与原病原菌的菌落形态一致,因此认定这2种病原菌(代表菌株为C1和G1)为番木瓜炭疽病的病原菌(图1)。

表1 17种供试杀菌剂Table 1 17 kinds of test fungicides
注:悬浮剂为SC,乳油为EC,可湿性粉剂WP,水分散粒剂为WG,微乳剂为ME,水乳剂为EW,可溶粒剂为SG。

表2 炭疽病不同菌株对番木瓜果实的致病力测定Table 2 Pathogenicity of different isolates to papaya fruit
注:不同小写字母表示P<0.05水平下显著性差异(F-text)。
Note: Values followed by different lowercase letters within each column indicate significantly different at 0.05 levels byF-test.
2.2 病原菌鉴定
研究表明,C1菌株在PDA培养基上生长较慢(图2),生长速度为1.22~1.38 cm/d;初为灰白色,菌落近圆形,后期菌丝呈灰褐色,其上有有许多黑色颗粒呈轮纹状分布;分生孢子盘上密生刚毛,刚毛黑色,顶端渐尖,基部膨大;分生孢子梗无色、圆柱形、瓶体式产孢;分生孢子镰刀型,略弯,无色,单孢,两端钝形, 大小为2.21~4.81 μm×17.12~28.92 μm。G1菌株在PDA培养基上生长较快,生长速度为2.08~2.13 cm/d;气生菌丝初期为白色绒毛状,菌落圆形且边缘整齐,后期菌丝呈灰白色絮状,菌落上有赭红色的分生孢子堆;分生孢子盘上产生黑色刚毛,顶端渐尖少数顶端呈乳突状;分生孢子梗无色、圆柱形、瓶体式产孢;分生孢子圆柱形,无色,单孢,可见一或两个油球,两端钝圆,大小为2.58~7.21 μm×7.42~17.71 μm。
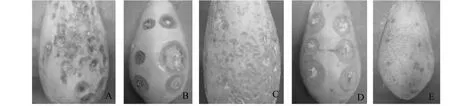
A、C:炭疽病自然发病症状;B、D:分别是C1菌株和G1菌株接种症状;E:对照A,C: Anthranose natural symptoms with C1 and G1; B,D: Symptoms of pathogens C1 and G1; E:CK图1 番木瓜炭疽病症状Fig.1 Anthranose Symptoms of papaya
测序结果显示C1菌株(登录号:KP784422)与辣椒炭疽菌(Colletotrichumcapsici)的同源性达到99 %,而G1菌株(登录号:MH265979)与胶孢炭疽菌(C.gloeospcrides)的同源性也达到了99 %。分别将2个序列在NCBI上进行BLAST比对发现C1菌株和辣椒炭疽菌(C.capsici)、G1菌株和胶孢炭疽菌(C.gloeospcrides)的同源性分别都达到了99 %。另外选取同源性高低不同的菌株进行多重序列比较,并做系统发育分析,结果表明C1 菌株与辣椒炭疽菌(C.capsici)遗传距离最小,聚为一类,G1菌株与胶孢炭疽菌(C.gloeospcrides)遗传距离最小聚为一类(图3)。在结合C1菌株和G1菌株的形态学特征,确定C1菌株为辣椒炭疽菌(C.capsici),G1为胶孢炭疽菌(C.gloeospcrides)。

A:C1菌株在PDA上的菌落形态;B:分生孢子;C:分生孢子盘、刚毛及分生孢子;D:G1菌株在PDA上的菌落形态;E:分生孢子;F:分生孢子盘、刚毛及分生孢子A:Colony morphology of pathogen C1 on PDA; B:Conidia; C: Conidia disk, bristles and conidia; D: Colony morphology of pathogen G1 on PDA; E: Conidia; F: Conidia disk, bristles and conidia图2 病原菌形态特征Fig.2 Morphological characteristics of anthracnose pathogens
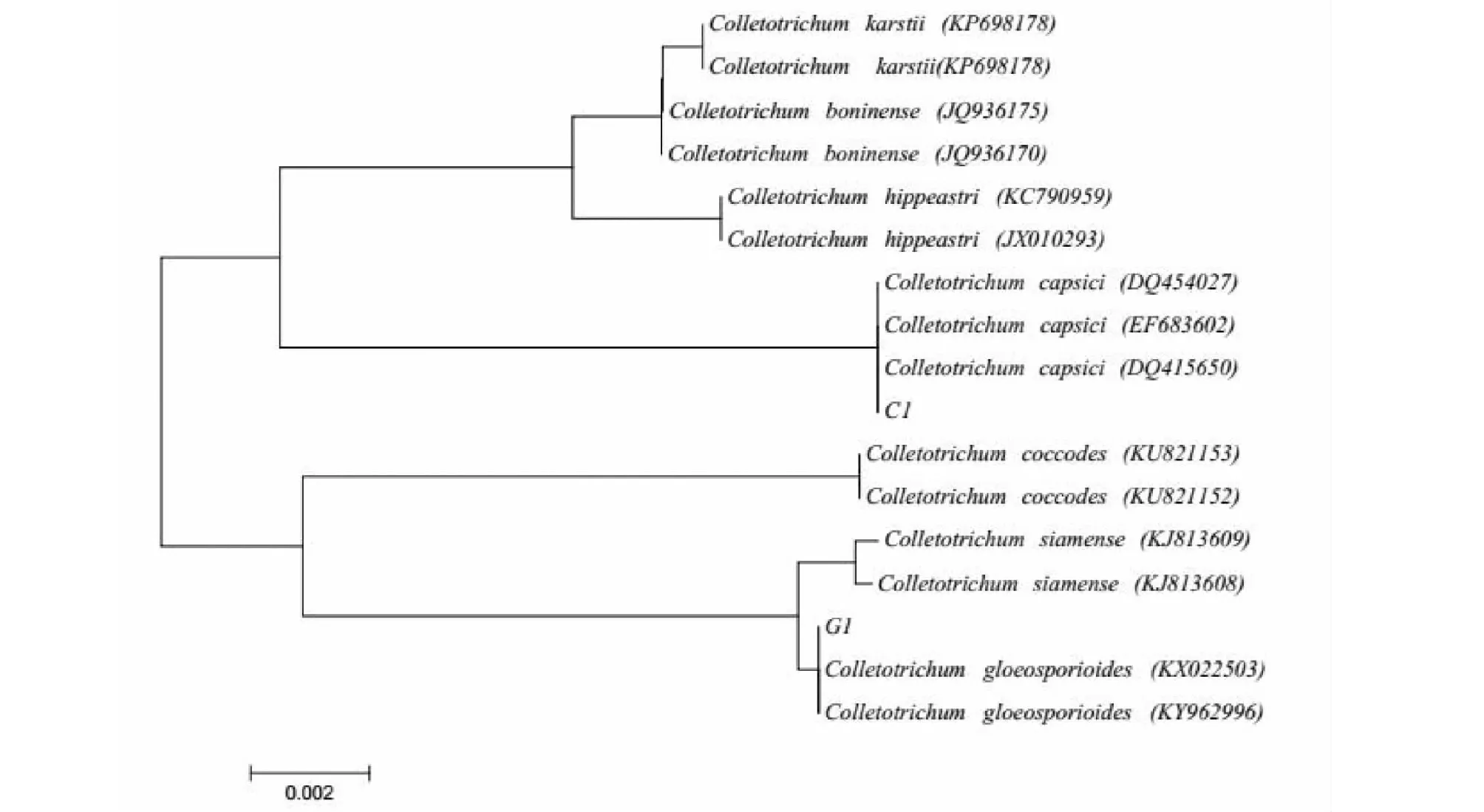
图3 基于炭疽菌rDNA-ITS序列构建的C1菌株和G1系统发育树Fig.3 Phylogenetic tree of isolate C1and G1 based on rDNA-ITS sequences of Colletotrichum spp.
2.3 17种杀菌剂对2菌株的抑制作用
试验结果表明,供试17种杀菌剂对C1和G1菌株菌丝生长均有不同程度的抑制作用(表3)。对于C1菌株500 mg/mL咪鲜胺WG毒力最强,EC50的值仅为0.03 μg/mL,其次为300 mg/mL咯菌腈SC和250 mg/mL丙环唑EC,EC50值分别为0.06 和0.13 μg/mL均小于1 μg/mL;EC50值小于10 μg/mL的有410 mg/mL苯醚甲环唑SC、500 mg/mL异菌脲WP 和750 mg/mL抑霉唑硫酸盐SG,EC50的值分别为2.86 g/mL、5.00 μg/mL和8.11 μg/mL;EC50值小于20 μg/mL的有227 mg/mL二氰蒽醌SC、100 mg/mL多抗霉素WP、750 mg/mL百菌清WP、200 mg/mL抑霉唑EW、250 mg/mL溴菌腈ME、500 mg/mL福美双WP和400 mg/mL嘧霉胺SC。对于G1菌株300 mg/mL咯菌腈SC毒力最强,EC50的值仅为0.01 μg/mL,其次为500 mg/mL咪鲜胺WG、250 mg/mL丙环唑EC、200 mg/mL抑霉唑EW、410 mg/mL苯醚甲环唑SC和430 mg/mL戊唑醇SC,EC50值分别为0.02、0.08、0.47、0.84和0.91μg/mL,均小于1 μg/mL;EC50的值小于10 μg/mL的有500 mg/mL多菌灵WP、750 mg/mL抑霉唑硫酸盐SG、500 mg/mL福美双WP、500 mg/mL异菌脲WP和500 mg/mL嘧菌酯WG,EC50的值分别为1.18、1.96、2.54、7.19和8.33μg/mL;EC50的值小于20 μg/mL的有25 %溴菌腈ME和75 %百菌清WP。

表3 17种杀菌剂对2株炭疽菌的毒力测定Table 3 Toxicity determination of 17 fungicides against two Colletotrichum spp.
续表3 Continued table 3

杀菌剂种类毒力回归方程(y=ax+b) 相关系数(r)EC50值平均EC50值C.gloeospcridesy=1.177x+4.65560.9840∗∗1.96异菌脲C.capsiciy=0.6219x+4.56550.9799∗∗5.006.09C.gloeospcridesy=1.0274x+4.11960.9732∗∗7.19抑霉唑C.capsiciy=0.4938x+4.45450.9660∗∗12.736.60C.gloeospcridesy=1.3809x+5.44940.9913∗∗0.47福美双C.capsiciy=0.6771x+4.23010.9438∗13.718.13C.gloeospcridesy=0.5098x+4.79350.9973∗∗2.54百菌清C.capsiciy=0.4011x+4.55950.9759∗∗12.5413.8C.gloeospcridesy=0.8515x+3.9970.9536∗15.06二氰蒽醌C.capsiciy=0.4769x+4.52050.8783∗10.1317.42C.gloeospcridesy=0.8381x+3.83250.9880∗∗24.72戊唑醇C.capsiciy=0.4067x+4.36560.9862∗∗36.3018.6C.gloeospcridesy=0.8656x+5.03610.9831∗∗0.91多抗霉素C.capsiciy=0.9407x+4.00580.9494∗11.4064.51C.gloeospcridesy=0.7432x+3.46120.9378∗117.63嘧霉胺C.capsiciy=0.816x+3.95550.9217∗19.0693.04C.gloeospcridesy=0.6195x+3.6230.9100∗167.02溴菌腈C.capsiciy=0.851x+4.05580.9608∗∗12.8793.04C.gloeospcridesy=1.2837x+3.50580.9736∗∗14.59代森锰锌C.capsiciy=0.5703x+3.02910.9977∗∗2856.943843.54C.gloeospcridesy=0.4202x+3.4520.9860∗∗4830.14嘧菌酯C.capsiciy=0.1788x+3.74740.9936∗∗10129612.715064810.50C.gloeospcridesy=0.3609x+4.66770.9282∗8.33多菌灵C.capsiciy=0.3421x+3.83940.9700∗2469.311235.25C.gloeospcridesy=0.9838x+4.9280.9013∗1.18
从对2菌株的平均EC50值看,410 mg/mL咪鲜胺WG<300 mg/mL咯菌腈SC<250 mg/mL丙环唑EC,均EC50值均小于1 μg/mL;其次410 mg/mL苯醚甲环唑SC<750 mg/mL抑霉唑硫酸盐SG<500 mg/mL异菌脲WP,平均EC50均小于10 μg/mL;平均EC50值小于20 μg/mL是200 mg/mL抑霉唑EW<500 mg/mL福美双WP<750 mg/mL百菌清WP<227 mg/mL二氰蒽醌SC<430 mg/mL戊唑醇SC。EC50值均高于100 μg/mL是多菌灵和代森锰锌。
3 结 论
本实验采集番木瓜炭疽病病果,采用柯赫氏法则对病原菌进行分离、纯化和致病性测定,根据病原菌的形态特征,结合其rDNA-ITS区域的序列分析对病原菌进行鉴定,实验结果表明导致海南番木瓜炭疽病的主要病原菌为辣椒炭疽菌(C.capsici)和胶孢炭疽菌(C.gloeospcrides)。在供试的17种杀菌剂中,500 μg/mL咪酰胺WG、300 μg/mL咯菌腈SC和250 mg/mL丙环唑EC对番木瓜炭疽病有较好的抑菌效果。
4 讨 论
李建莹等人研究表明炭疽菌在番木瓜生产中,从刚刚坐果的幼果到成熟采摘前的大果均可进行潜伏侵染[16]。刘秀娟等人在1990-1992年对海南省番木瓜各种植区进行了贮藏期发病调查,表明在番木瓜果皮中存在很多潜伏侵染的病原真菌,其中就以番木瓜胶孢炭疽菌(C.gloeospcrides)发生最普遍且致病性最强[17]。炭疽病一直为海南省番木瓜贮藏期的重要病害,本研究根据对病原真菌形态鉴定、致病性测定以及其rDNA-ITS序列同源性分析结果,进一步确定辣椒炭疽菌(C.capsici)和胶孢炭疽菌(C.gloeospcrides)为番木瓜炭疽病的主要致病菌。
李敏等人对番木瓜胶孢炭疽菌进行了室内毒力测定,在供试的21中杀菌剂中,参考EC50值及斜率值综合分析认为,咪鲜胺、苯醚甲环唑、丙环唑、戊唑醇等均有较好的抑菌效果[18]。吴伟怀等人对番木瓜果腐镰刀菌进行室内毒力测定,结果表明在供试的9种药剂中咪鲜胺的抑菌效果最为显著[19]。本试验结果也表明,不同杀菌剂对番木瓜炭疽病病原菌的抑制作用不同,其中500 mg/mL咪鲜胺WG、300 mg/mL咯菌腈SC和250 mg/mL丙环唑EC 这3种杀菌剂抑菌能力最强,410 mg/mL苯醚甲环唑SC、750 mg/mL抑霉唑硫酸盐SG和500 mg/mL异菌脲WP 3种杀菌剂也具有较好的抑菌效果。综合分析认为,410 mg/mL咪鲜胺WG、300 mg/mL咯菌腈SC和250 mg/mL丙环唑可作为番木瓜炭疽病的防治药剂。
