水稻抗细菌性条斑病主效基因位点的遗传分析及定位
2020-04-22覃丽萍岑贞陆
覃丽萍,谢 玲*,岑贞陆
(1.广西农业科学院微生物研究所,广西 南宁 530007;2.广西农业科学院植物保护研究所,广西 南宁 530007)
【研究意义】水稻细菌性条斑病(OryzasativaL.,简称水稻细条病)由水稻黄单胞菌栖稻致病变种Xanthomonasoryzaepv.Oryzicola(Fang,et al.)Swings et al.引起,是我国南方及东南亚国家水稻上的一种主要细菌性病害,通常减产5 %~20 %,在适宜的气候条件下感病品种减产在30 %以上[1],严重影响水稻的产量和品质,被我国列为植物检疫对象。目前水稻细条病防治主要依赖化学药物,但效果不明显,且长期使用易造成病菌产生抗(耐)药性、环境污染及农药残留等负面影响[2],不利于保持生态平衡和促进农业的可持续发展。培育和种植抗病品种是防治细条病经济、有效且环保的方法,而挖掘抗病相关基因资源、掌握数量丰富的抗性基因位点是培育抗病品种的关键。主效基因控制的质量抗性能很好地抵御病菌侵染及繁殖而表现出免疫或高抗,是当前利用的主要植物抗病性类型,但目前对水稻细条病抗性基因的研究主要集中在数量性状基因(QTL)定位,对主效基因的定位研究相对较少。SSR标记具有较高的应用价值,可应用于动植物的遗传图谱构建、目标基因标定及指纹图绘制等研究中[3-6]。因此,广泛深入发掘抗水稻细条病国际稻品种BJ1的主效基因,丰富水稻抗病基因位点数量,对水稻抗细条病的分子标记辅助选择具有重要意义。【前人研究进展】多数学者认为,水稻对细条病的抗性属QTL控制的数量性状,分别在第1、2、3、4、5、7、8和11号染色体定位到十几个抗性QTL,并获得相应的分子标记[7-13]。但也有学者通过对不同水稻抗源材料进行研究发现,水稻对细条病的抗性由显性或隐性主效基因控制,属质量性状。何月秋等[14]研究发现13个杂交稻组合对细条病的抗性受1~2显性主效基因控制;张红生等[15]研究证实籼稻品种IR36对细条病的抗性由1对隐性主效基因控制,Dular、IR26和IR1545-339则由1对显性主效基因控制;徐建龙等[16]研究认为抗源品种Hashikalmi和Dular的抗性受2对独立的隐性主效基因控制,90IRBBN44受1对隐性主效基因控制;黄大辉等[17]研究表明野生稻DP3的抗性由2对隐性重叠作用的基因控制;贺文爱等[18]研究认为野生稻抗源DY3、DY17和DY20 的抗性由 2 对隐性主效基因控制,而DY16 的抗性由 1 对隐性主效基因控制。国际稻BJ1全生育期抗细条病,曾有不同学者尝试分析其对细条病的抗性遗传规律,如周明华等[19]认为BJ1对细条病的抗性由1对显性基因控制,Nayak等[20]则认为BJ1对细条病的抗性受3对独立隐性基因控制,二者的研究结果虽存在差异,但均认为BJ1对细条病的抗性由主效基因控制。【本研究切入点】目前,虽然已发现抗源BJ1携带抗细条病主效基因,但鲜见对其抗性基因进行定位的研究报道。【拟解决的关键问题】以高抗细条病的国际稻品种 BJ1与感病品种油占8号为亲本,通过杂交、自交构建F2代分离群体,采用混合分组分析法(BSA)和简单重复序列(SSR)分子标记技术结合抗病性鉴定,对BJ1携带的抗性基因位点进行初步定位,为水稻抗细条病分子标记辅助育种打下基础。
1 材料与方法
1.1 试验材料
抗病亲本为国际稻品种BJ1,感病亲本为籼稻品种油占8号,感病对照为TN1,接种菌株莲塘13为广西水稻细条病病菌优势致病型Ⅲ型,均由本研究课题组保存提供。
1.2 群体构建
BJ1与油占8号进行杂交,收获F1代种子后播种,F1代植株自交得到F2代。在广西农业科学院玻璃大棚的栽培池中种植抗、感亲本及F1代各10株,种植F2代251株。各生育期除抗病性鉴定时外均保持浅水灌溉。
1.3 抗病性鉴定
在早稻分蘖盛期(5月底)进行接种:将 2 根大头针以约8 mm的间距插进橡皮胶中,高压灭菌备用;供试菌株在肉汁冻培养基上培养2 d后,用无菌水冲洗掉菌苔,配成3×108CFU/mL悬浮液(当天使用);将大小与培养皿内空间相当、厚约2 cm的无菌海绵置于培养皿内并倒入菌液,使海绵吸足菌液,然后将水稻新生的完全展开叶正面朝上平置于海绵碟上,用准备好的大头针在叶片中上部刺一下,注意使橡皮胶上的2 根针分别刺在叶片中脉两侧,稍按压橡皮胶挤出海绵中的菌液使之渗入叶片伤口;在接种过程中根据菌液损耗情况适时给海绵补充菌液;每株接种2 片叶。接种 20 d后,参考农秀美等[21]的方法(略有修改)进行病情调查和标准划分,测量接种点病斑的长度,每个单株测量10个病斑,取其平均值作为评判单株对细条病抗性水平的依据。详细划分标准见表1,以 10.0 mm 的病斑长度作为划分抗、感分界线。接种完成后至病情调查期间保持深水灌溉。
1.4 抗性基因初步定位
1.4.1 DNA提取及基因池构建 采用 CTAB 法提取抗、感亲本及 F2代群体各单株的基因组DNA,结合抗病性鉴定选取极端抗病(免疫I和高抗HR)和极端感病(高感HS)F2代单株各15株的DNA分别混合成抗病基因池和感病基因池。提取方法:每株取新鲜嫩叶约 0.1 g,剪碎,放入内有一颗直径约5 mm钢珠的2.0 mL EP管中,加入600.0 μl CATB提取液;使用组织研磨仪充分研磨;65 ℃水浴30 min,期间将样品上下颠倒2次;加入等体积(600.0 μl)氯仿—异戊醇混合液(混合比例为24∶1),摇匀后10 000 r/min离心10 min;取上清液400.0 μl,置于1.5 mL EP管中;加入2倍体积(800.0 μl)无水乙醇,上下颠倒1次,4 ℃静置30 min;10 000 r/min离心10 min,弃上清液,自然晾干沉淀,加入100.0 μl ddH2O,置于4 ℃或-20 ℃保存备用。
表1 水稻抗、感细条病划分标准及其相应症状表现
Table 1 The standard of division for rice bacterial leaf streak and the corresponding symptoms
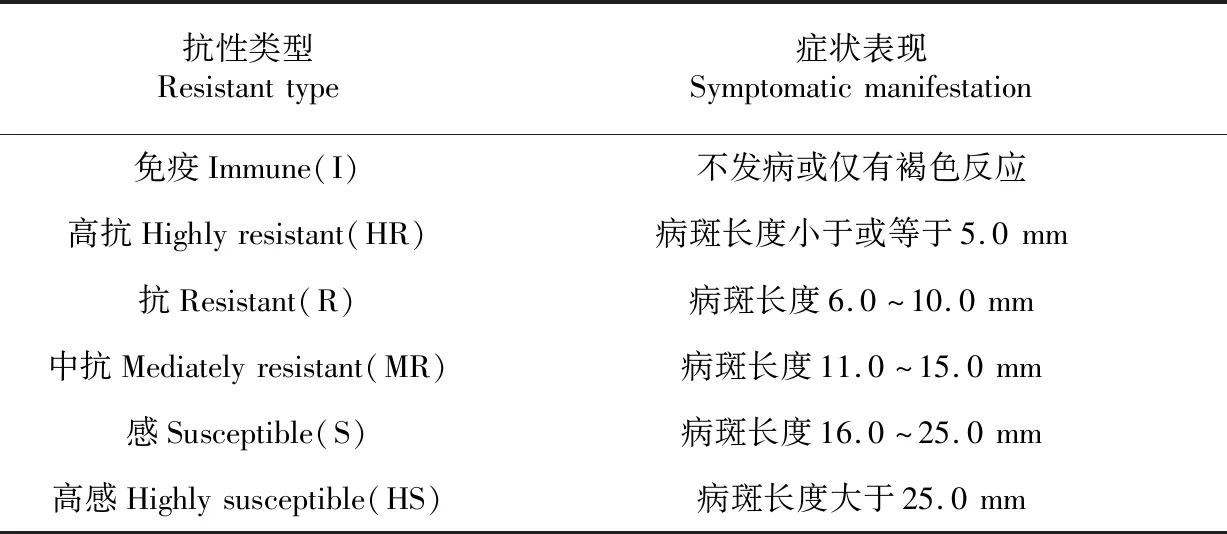
抗性类型Resistanttype症状表现Symptomaticmanifestation免疫Immune(I)不发病或仅有褐色反应高抗Highlyresistant(HR)病斑长度小于或等于5.0mm抗Resistant(R)病斑长度6.0~10.0mm中抗Mediatelyresistant(MR)病斑长度11.0~15.0mm感Susceptible(S)病斑长度16.0~25.0mm高感Highlysusceptible(HS)病斑长度大于25.0mm
1.4.2 SSR分子标记筛选 从已公布的水稻SSR引物[由捷瑞生物工程(上海)有限公司合成]中选出在水稻12条不同染色体上均匀分布的279对引物,对抗、感亲本进行初筛,选择在抗、感亲本间具有多态性的SSR引物在抗、感基因池中进行多态性检测。
PCR 反应体系20.0 μl:包括2.0 μl 10×Buffer(含 Mg2+)、2.0 μl dNTPs (2.5 mmol/L)、2.0 μl引物(10 μmol/L)、2.0 μl模板DNA、0.1 μlTaqDNA 聚合酶(5 U/μl)、11.9 μl灭菌纯净水。扩增程序:95 ℃ 预变性 5 min;95 ℃ 变性 30 s,52 ℃复性 30 s,72 ℃ 延伸 30 s,进行35 个循环;72 ℃延伸 5 min,4 ℃ 保存待用。PCR扩增产物经 8.0 %非变性丙烯酰胺凝胶电泳分离、快速银染后观察。银染步骤(各步骤均需轻微振荡):10.0 %乙醇(v/v)+0.5 % 冰醋酸(v/v)固定10 min; 0.2 %硝酸银(w/w)渗透10 min,双蒸水漂洗 2次,每次10 s; 10.0 %硫代硫酸钠漂洗30 s,去除多余的银离子; 1.5 %氢氧化钠(w/w)+1.0 %(v/v)甲醛显色,待条带清晰显现时用清水冲洗。
1.4.3 连锁标记 利用在抗病基因池和感病基因池间表现出多态性的SSR标记引物对F2群体进行扩增,扩增产物按1.4.2的方法进行电泳分离、银染观察,采用“1-2”系统记载各单株的带型,与抗病亲本带型一致的记为“1”,与感病亲本带型一致的记为“2”,杂合带型记为“3”,缺失记为“0”。
1.5 统计分析
采用OriginPro 9.1分析F2代群体基因型与表型的相关性。
2 结果与分析
2.1 抗源抗性的遗传特征
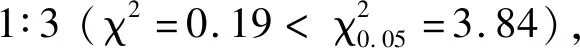
2.2 亲本间SSR分子标记的初筛结果
从已公布的水稻SSR引物中选出均匀分布于水稻12条不同染色体上的279对引物,对抗、感亲本进行初筛,结果有RM310、RM330A和RM257等65对引物在亲本间检测到多态性,各染色体上的SSR分子标记引物在亲本间的多态性表现率存在明显差异,变幅在0 %~42.9 %,平均多态性表现率为23.3 %(表3)。
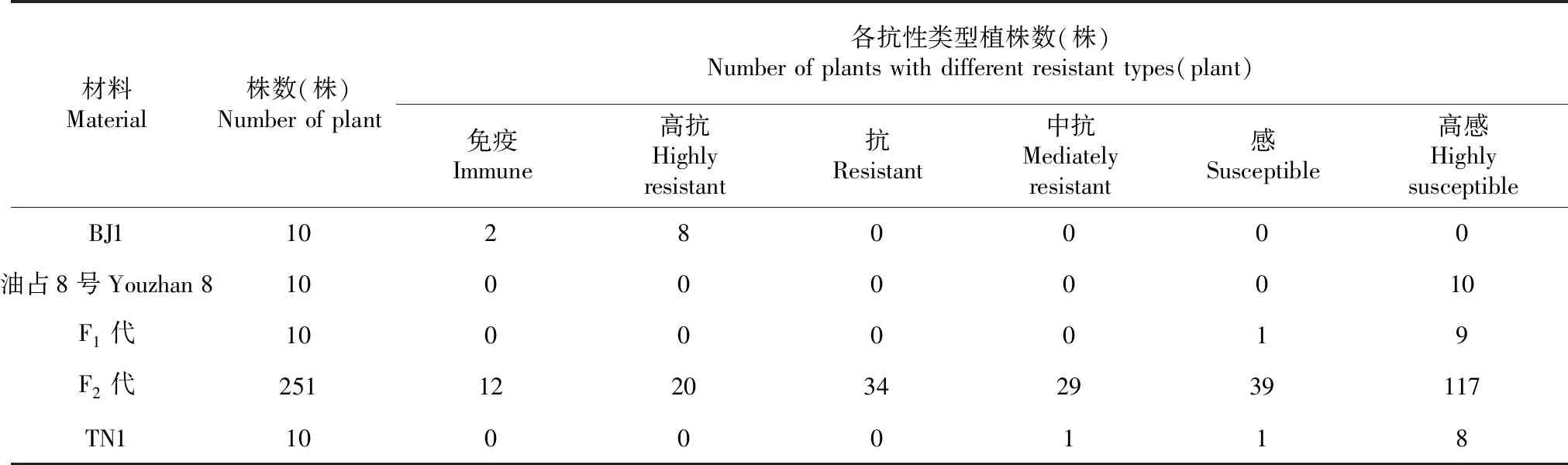
表2 亲本、F1和F2代对细条病的抗性表现Table 2 Resistance reaction of parents,F1 and F2 to bacterial leaf streak

a:感病材料发病情况;b:F2代不同单株的发病情况a:Symptoms on susceptible plants;b:Symptoms on different F2 plants图1 水稻接种细条病菌株莲塘13后20 d的症状表现Fig.1 Symptoms of bacterial leaf streak after 20 days inoculated with Liantang 13
2.3 抗性基因的定位结果
在抗病、感病亲本间呈多态性的65对引物中,RM 258(上游引物5′-CTCCCTGGCCTTTAAAGCTGTCG-3′,下游引物5′-GACGAACAGCAGCAGAAGAGAAGC-3′)在抗、感基因池间呈多态性。利用RM258扩增F2代群体单株251株(图2),结果检测到抗病带型68株,其中表型鉴定为抗病的有60株、感病的有8株,基因型与表型符合率为88.2 %;检测到感病带型(感病亲本带型和杂合带型)175株,其中表型鉴定为抗病的有4株、感病的有171株,基因型与表型符合率为97.7 %;剔除缺失的8株,有243株F2代群体的基因型与表型符合率为93.0 %(表4),基因型与表型的相关系数为0.5705,二者的相关性达显著水平(P<0.05),表明SSR分子标记RM258与BJ1携带的抗水稻细条病隐性主效基因存在连锁关系。对照已公布的水稻分子遗传连锁图,可知RM258位于第10号染色体上约48.8 cM处。
3 讨 论
国际稻 BJ1不但高抗细条病,而且抗白叶枯病[22]、抗虫和抗倒伏,综合抗性好[23],虽然其农艺性状较差,但仍不失为一个培育抗水稻细条病中间材料的好抗源。本研究以BJ1为供体,油占8号为受体,构建其F2代分离群体对抗源BJ1的抗性遗传特性进行研究,结果表明,来自国际稻圃的籼稻品种BJ1对细条病的抗性属隐性遗传,受1对主效基因控制。周明华等[19]利用BJ1与感病品种南农籼2号、金刚 30杂交、回交构建F2、BC1和BC2群体研究BJ1对细条病的抗性遗传规律,发现其抗性由1对主效显性基因控制;Nayak等[20]通过研究BJ1与感病品种TKM-6和IR-8构建的 F2和F3代群体,发现BJ1对细条病的抗性由3对独立主效隐性基因控制。本研究结果与周明华等[19]、Nayak 等[20]的研究结果虽然存在差异,但均表明BJ1对水稻细条病的抗性由主效基因控制,该抗性属质量性状。

表3 各条染色体上SSR分子标记在亲本间的多态性水平Table 3 The polymorphism level of SSR markers on different chromosomes in parents
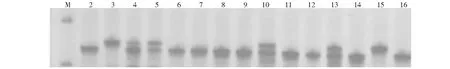
M:Marker;2:抗病亲本BJ1带型;3:感病亲本油占8号带型;4~16:部分F2代单株的带型M:Marker;2:PCR pattern of resistant parent BJ1;3:PCR pattern of susceptible parent Youzhan 8;4-16:PCR pattern of partial F2 plants图2 SSR分子标记引物RM258扩增亲本及部分F2代单株的电泳结果Fig.2 The electrophoretogram of parents and partial F2 amplified by SSR primer RM258
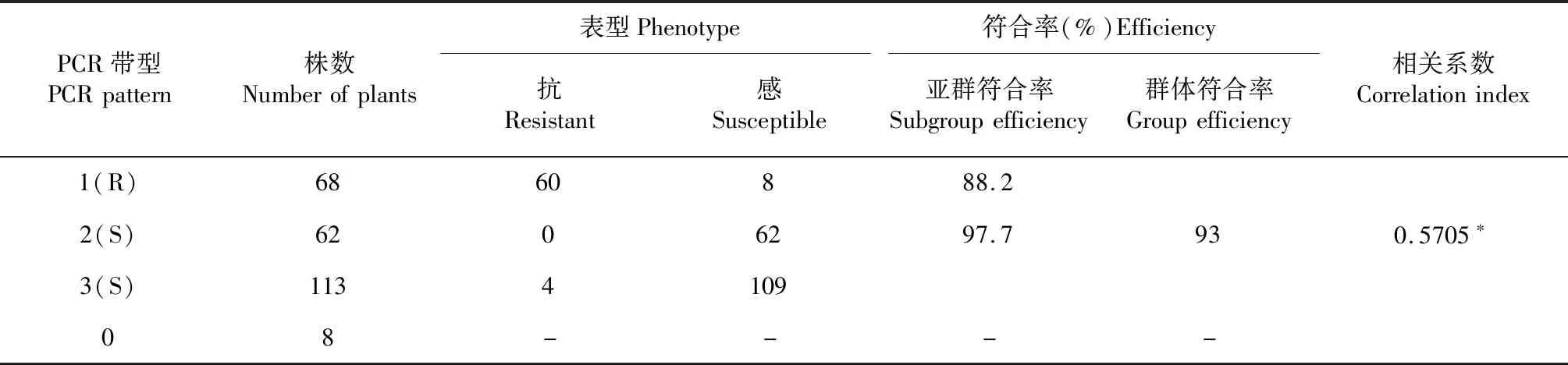
表4 SSR 标记引物RM 258 检测F2代群体基因型与表型的符合率Table 4 Efficiency of genotype and phenotype of SSR marker RM258 in F2 populations
注:*表示显著相关(P<0.05)。
Note:* represented significant correlation(P<0.05).
已有学者通过经典遗传分析发现不少水稻种质携带抗细条病主效基因,但已定位的仅有普通野生稻DP3和DY19的抗性基因bls1和bls2[24-25]及美国祖传品种Carolina Gold Select的抗性基因Xo1[26],且这3个基因分别位于第6号染色体RM1940与 RM510 间的21-kb 物理距离内、第2号染色体23474851~24484154 bp间约1.009 Mb距离内和第4号染色体长臂31358156~32448509 bp间1.09 Mb 距离内。本研究发现BJ1携带1对抗细条病隐性主效基因,并初步将该基因定位于第10号染色体约48.8 cM处,与 SSR分子标记RM258紧密连锁。这是首次在第10号染色体上检测到水稻细条病抗性基因,可为培育抗细条病水稻品种(系)提供新的抗性位点。
曾有学者认为水稻对细条病的抗性属数量性状,不存在主效基因[7-8],但世界上抗细条病的水稻种质资源非常丰富[17,27-30],尤其随着研究广度和深度的提高,不断有新的细条病抗性主效基因或QTL被发现和定位。本研究认为,前人对水稻细条病抗性遗传的研究结论不一致,除了与采用的菌株、接种方法、分级标准及环境因素等不同有关外,主要是因为所用稻种材料的遗传背景不同及抗病遗传机制存在差异,因此,水稻对细条病的抗性应该同时存在质量抗性和数量抗性。
主效基因控制的质量抗性效应较大,在基因克隆和功能利用上相对容易成功,但易因病原菌发生变异而使抗性不稳定或丧失;QTL控制的数量抗性效应微小、难以精细定位和克隆,但其抗性较持久[31]。若将BJ1的抗性主效基因导入其他携带多个抗性QTL、农艺性状优良的品种中,有望培育出抗性广谱、持久及稳定的水稻品种(系)。由于本研究仅对BJ1抗细条病基因定位进行初步探讨,离水稻生产实际应用还存在差距,因此今后有待进行精细的定位、分离、克隆和转化。
4 结 论
通过对国际稻材料BJ1进行常规杂交、选育和SSR分子标记结合抗病性鉴定,检测到BJ1所携带的细条病抗性基因为隐性主效基因,位于10号染色体上约48.8 cM处,且与SSR分子标记RM258紧密连锁,推测是一个全新的抗水稻细条病基因位点。
致 谢:广西农业科学院水稻研究所李丹婷研究员、农保选副研究员、夏秀忠副研究员、马增凤副研究员、高利军副研究员为本研究内容的完善提供了技术指导及部分实验材料,谨向他们表示真挚的感谢!
