胸腹腔镜食管切除术手术治疗食管癌的临床效果及对患者并发症发生的影响
2020-04-21朱勇陈晶寇海涛张宇王相臣
朱勇,陈晶,寇海涛,张宇,王相臣
(河南省濮阳市人民医院胸外科,濮阳457100)
目前,食管癌是我国较为常见的消化系统恶性肿瘤之一,其发病数占所有恶性肿瘤发病数的2%,其中以中、下段食管癌最为常见,各占40%以上[1]。患者发病后,常表现为吞咽困难、吞咽疼痛、食物反流等临床症状。随着病情发展,严重者出现无法吞咽、疼痛难忍等严重并发症,致死率极高。为有效缓解其不良症状,手术切除是目前主要且有效的治疗方法,但传统开放性食管癌切除术手术创伤面较大,患者术后应激反应、炎症反应及并发症发生较为严重,不利于对患者后期康复[2]。随着近年来微创技术和腔镜技术的不断发展,腔镜下微创外科手术在恶性肿瘤切除中的应用也越加广泛[3-5],本文对胸腔镜食管切除术对食管癌患者的临床应用效果和对患者术后并发症发生的影响进行研究。
1 资料与方法
1.1 一般资料 对2015 年7 月-2017 年11 月我院肿瘤科收治的106 例食管癌患者进行回顾性分析,纳入标准:(1)由胃镜及病理活体检验确诊食管癌;(2)CT 检验显示无远处转移、肿瘤外侵等情况;(3)于我院进行手术并资料完备者。排除标准:(1)合并精神类疾病或严重心、肝、肾等重要器官病变者;(2)合并凝血功能障碍等手术禁忌症者;(3)合并严重感染、内分泌系统或免疫系统疾病者;(4)合并肺部病变者。所有患者及家属均自愿参加本研究并签署知情同意书。使用随机数字表法将所有患者分为传统组(53 例)及胸腔镜组(53 例),两组基线资料见表1。2 组一般资料差异无统计学意义(P>0.05)。
表1 两组基线资料的比较[±s,n(%)]Tab 1 Comparisonofbaselinedatabetweenthetwogroups[±s,n(%)]

表1 两组基线资料的比较[±s,n(%)]Tab 1 Comparisonofbaselinedatabetweenthetwogroups[±s,n(%)]
年龄/岁 性别组成 肿瘤位置 临床分期男 女 上 中 下 I~II III 56.46±5.58 30 23 12 20 21 29 24 57.11±5.69 28 25 13 22 18 26 27 χ2/t 0.594 0.152 0.052 0.158 0.365 0.340 P 0.277 0.696 0.819 0.691 0.546 0.560组别 n传统组 53胸腔镜组53
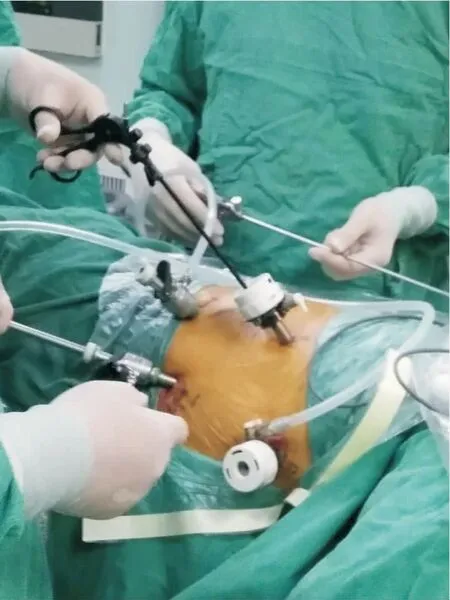
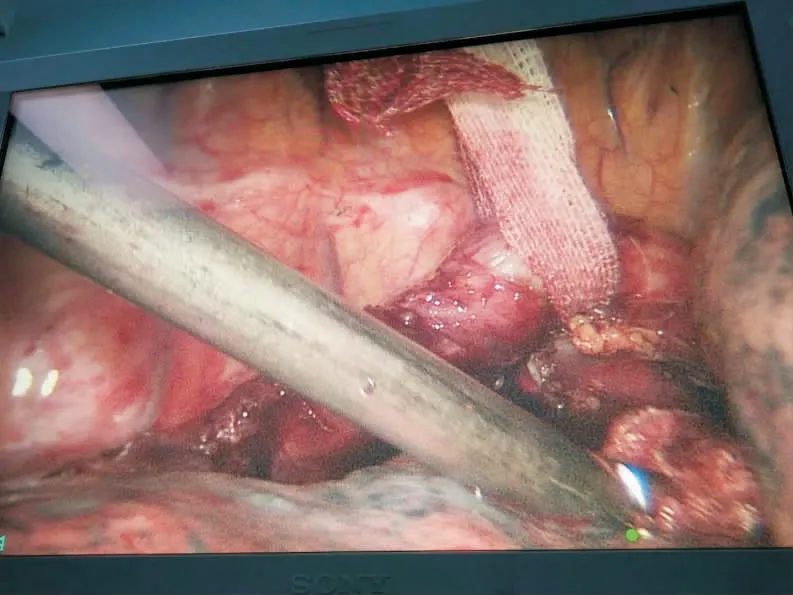
图2 游离食管Fig 2 Free of the esophagus
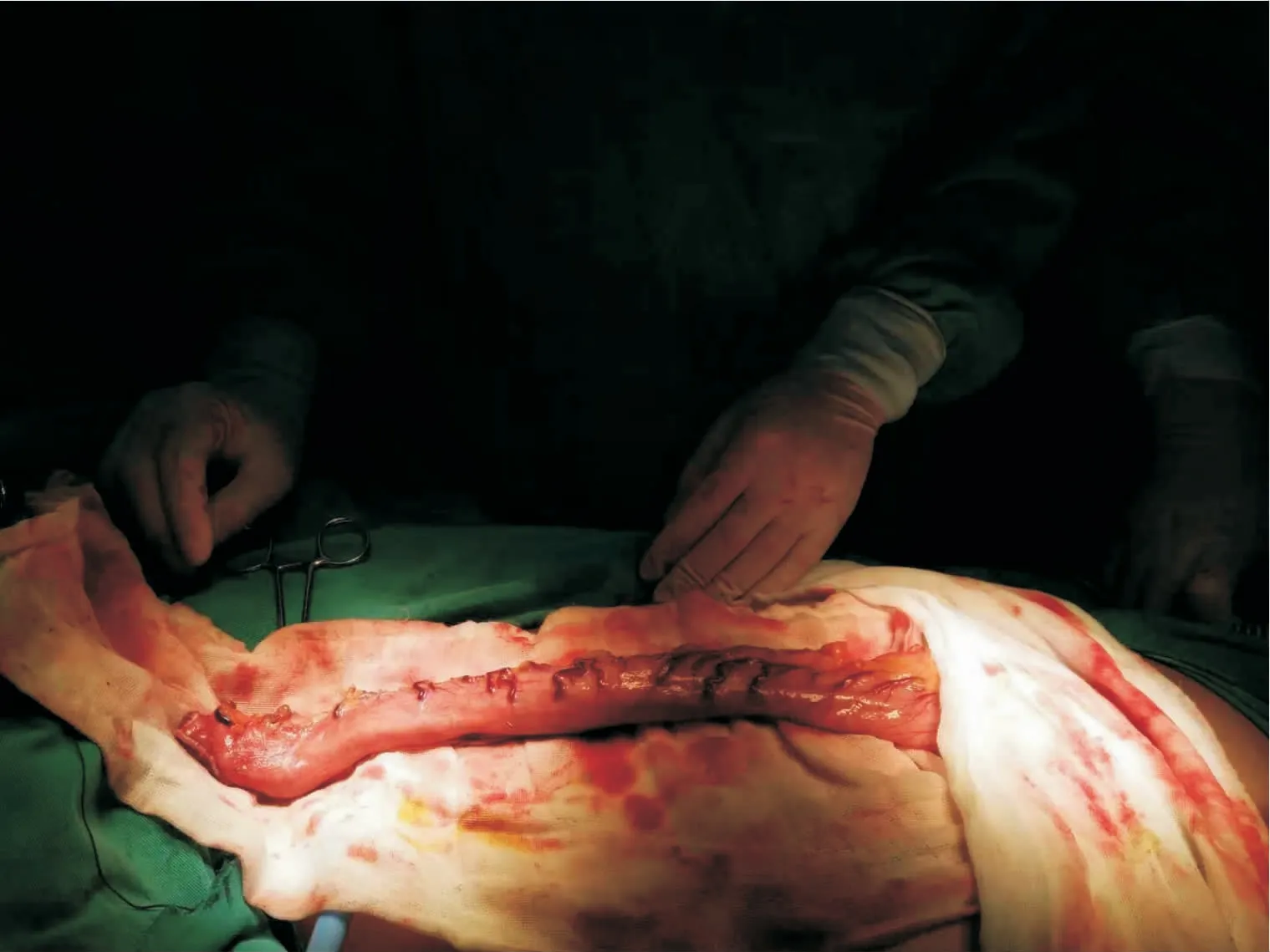
图3 管状胃制作Fig 3 Tube stomach
1.2 方法 所有患者入院后均进行营养控制,身体调理等常规术前准备,为排除不同手术熟练度不同引起的影响,所有手术均由同一组外科医师进行。
传统组手术方法:传统组使用常规三切口食管切除术,患者全麻,行单腔器官插管双肺通气。具体步骤如下:(1)取左侧卧位,于右胸后外则作切口,切开皮肤及皮下组织,分离胸腔段食管并对胸腔野淋巴结进行清扫;(2)患者转仰卧位,对颈部食管进行处理,具体操作同上;(3)常规开腹手术,对患者腹腔淋巴结进行清扫;(4)于剑突下切口,切口长度约3 cm,拉出胃及胸腔段食管,制作管状胃,并使用经食管床将其牵引至颈部,内层使用可吸收线缝合,外层使用丝线缝合,完成后留置营养管及胃减压管,逐层关闭切口并缝合。
胸腔镜组使用胸腔镜切除术,术前准备同传统组,具体操作如下:患者取左侧俯卧位,在腋中线第6、7 肋骨间隙间作一切口,切口长度约15 mm;第3、4 肋骨间隙作一约5 mm 切口,作为主操作孔;肩胛线第9 肋间作15 mm 切口,作为辅助操作孔,置入胸腔镜,探查食管情况(图1)。游离奇静脉,以Ham lock 夹闭,超声刀切断,游离胸段食管(图2),清扫食管旁淋巴结及左右喉返神经,放置胸腔闭式引流管,缝合胸部切口。患者取平卧位,分别于脐左上方1、3 cm 与左锁骨中线交汇处,剑突下,左侧肋缘下,右锁骨中线与脐上方3 cm 水平线交汇处打孔,植入腹腔镜,常规游离胃,切断肝胃、脾胃韧带,清除胃左动脉旁淋巴结及脂肪组织,处理胃左血管,以Ham lock 夹闭后超声刀切断。左颈部胸锁乳突肌前缘切口,分离颈浅肌群,游离颈段食管,近心夹闭后,断食管,远端使用10 号线缝合牵引。扩大剑突下切口,提出并游离胃,制作管状胃(图3),将胃提至左颈部,行食管,胃左颈部端侧吻合术,并置入胃管及十二指肠营养管,包埋吻合口,冲洗颈部切口并放置橡皮引流条,缝合颈部切口,放置腹腔引流管,分层缝合腹部切口。
1.3 观察指标 观察指标包括:(1)两组术中情况;(2)两组疼痛程度;(3)两组术后并发症发生率;(4)两组手术前后两组肺功能指标水平;(5)两组手术前后炎性因子水平。
1.4 判断标准 (1)术中情况:记录两组平均手术时间,术中出血量、淋巴结清扫个数及术后引流量并进行比较。(2)术后疼痛[6]:使用视觉模拟评分法(VAS)进行评定,标尺正面标注患者疼痛程度,背面标注评分,由患者指定其疼痛程度后进行对照,对应评分即为其疼痛分值。其中轻度疼痛:1~3 分,中度:4~6 分,重度:7~10 分。(3)肺功能指标:使用上海凯梵实业有限公司提供的S-980A(II)型肺功能检测仪进行检测,主要包括肺活量(VC)、用力肺活量(FVC)、每分钟最大通气量(MVV)、第一秒用力呼气量(FEV1)4 项指标。(4)炎性因子水平:取患者清晨静脉血,低速离心后取上清液,使用酶联免疫吸附法测定其肿瘤坏死因子(TNF-α)、白介素-6(IL-6)、白介素-8(IL-8)及白介素(IL-10)水平。试剂盒由上海酶联免疫生物科技有限公司提供。(5)并发症:术后对患者进行体征观察及,并定期观察患者伤口吻合及气管感染症状。使用影像学检测观察患者是否存在吻合口瘘,观察其是否存在肺部等器官感染。
1.5 统计学方法 所有统计学资料都采用SPSS21.0 专业统计学软件进行数据分析,计量资料以±s表示,组间比较采用独立样本t检验,干预前后组内比较采用重复测量方差分析进行检验,而所有的计数资料用χ2检验,P<0.05 评价为差异具有统计学意义。术后并发症发生率=并发症发生数/总例数×100%。
2 结果
2.1 2 组术中情况的比较 胸腔镜组手术时间、术中引流量、术中出血量显著低于传统组,差异具有统计学意义(P<0.05),2 组清扫淋巴结个数差异不显著(P<0.05),见表2。
表2 2 组术中情况的比较(±s)Tab 2 Comparison of intraoperative conditions between the two groups(±s)

表2 2 组术中情况的比较(±s)Tab 2 Comparison of intraoperative conditions between the two groups(±s)
术中淋巴结清扫个数/个 手术时间/min 术中出血量/mL 术后引流量/mL 11.94±0.53 170.42±10.35 185.66±11.12 655.62±679.78 12.02±0.49 161.28±9.98 163.29±9.96 283.55±498.74 t 0.807 4.628 10.909 3.213 P 0.211 0.000 0.000 0.001组别 n传统组 53胸腔镜组 53
2.2 2 组疼痛程度的比较 术后胸腔镜组VAS 评分及重度、重度疼痛例数显著低于传统组,轻度疼痛例数显著高于传统组(P<0.05),见表3。
2.3 2 组术后并发症发生率的比较 胸腔镜组并发症发生率显著低于传统组(P<0.05),见表4。
2.4 2 组手术前后两组肺功能指标水平的比较 术前两组肺功能各项指标水平无显著差异(P>0.05),术后胸腔镜组肺功能各项指标显著优于传统组(P<0.05),见表5。
2.5 2 组血清炎性因子水平的比较 见表6。
表3 2 组疼痛程度的比较[±s,n(%)]Tab 3 Comparison of pain degree between two groups[±s,n(%)]
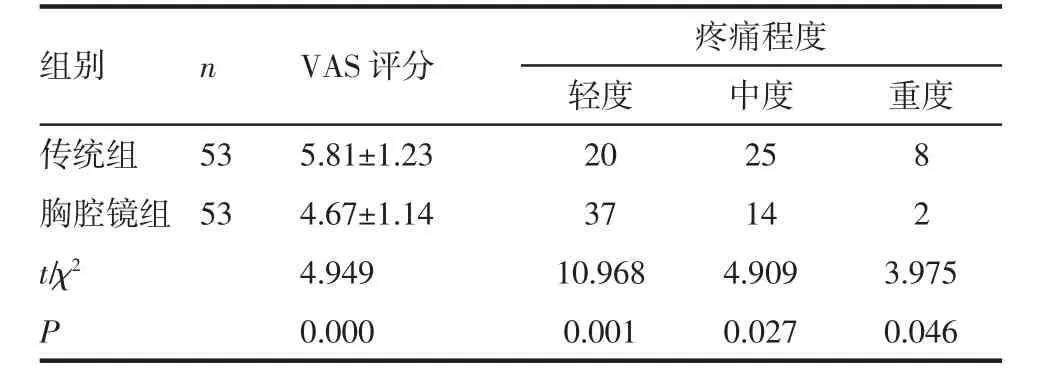
表3 2 组疼痛程度的比较[±s,n(%)]Tab 3 Comparison of pain degree between two groups[±s,n(%)]
组别传统组胸腔镜组t/χ2 P n 53 53 VAS 评分 疼痛程度轻度 中度 重度5.81±1.23 20 25 8 4.67±1.14 37 14 2 4.949 10.968 4.909 3.975 0.000 0.001 0.027 0.046

表4 2 组术后并发症发生率的比较[n(%)]Tab 4 Comparison of postoperative complications between the two groups[n(%)]
表5 2 组手术前后两组肺功能指标水平的比较(±s)Tab 5 Comparison of lung function indexes between two groups before and after surgery(±s)

表5 2 组手术前后两组肺功能指标水平的比较(±s)Tab 5 Comparison of lung function indexes between two groups before and after surgery(±s)
组别 n 术前/mL 术后/mL VC FVC MVV FEV1 VC FVC MVV FEV1传统组 53 97.12±10.45 96.68±10.26 87.24±10.13 89.97±14.78 68.52±6.64 63.44±6.27 55.79±6.74 65.55±12.11胸腔镜组 53 96.98±10.33 95.45±9.89 85.98±10.04 87.68±14.92 80.03±8.38 78.10±7.67 68.53±7.05 75.42±13.20 t/χ2 0.069 0.628 0.643 0.794 7.837 10.773 9.509 4.011 P 0.472 0.266 0.261 0.215 0.000 0.000 0.000 0.000
表6 2 组血清炎性因子水平的比较(±s)Tab 6 Comparison of serum inflammatory factor levels between two groups(±s)
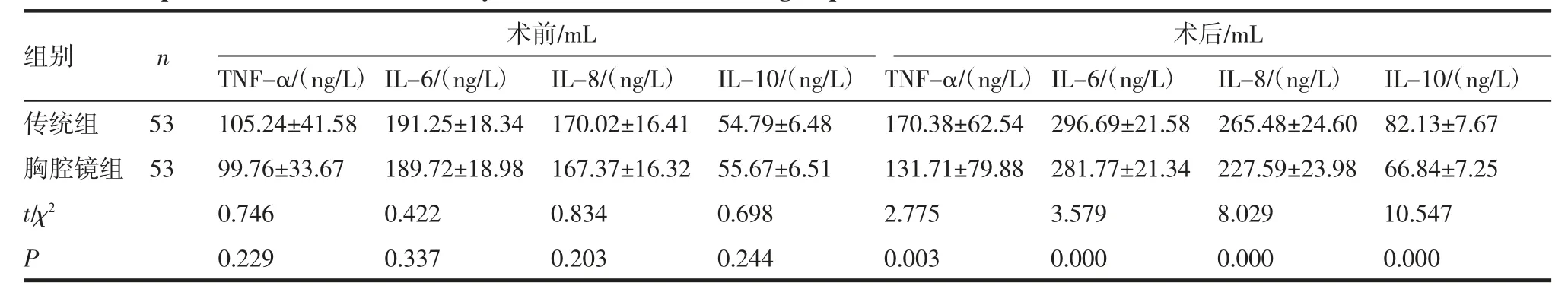
表6 2 组血清炎性因子水平的比较(±s)Tab 6 Comparison of serum inflammatory factor levels between two groups(±s)
术前/mL 术后/mL TNF-α/(ng/L) IL-6/(ng/L) IL-8/(ng/L) IL-10/(ng/L) TNF-α/(ng/L) IL-6/(ng/L) IL-8/(ng/L) IL-10/(ng/L)传统组 53 105.24±41.58 191.25±18.34 170.02±16.41 54.79±6.48 170.38±62.54 296.69±21.58 265.48±24.60 82.13±7.67胸腔镜组 53 99.76±33.67 189.72±18.98 167.37±16.32 55.67±6.51 131.71±79.88 281.77±21.34 227.59±23.98 66.84±7.25 t/χ2 0.746 0.422 0.834 0.698 2.775 3.579 8.029 10.547 P 0.229 0.337 0.203 0.244 0.003 0.000 0.000 0.000组别 n
3 讨论
我国食管癌发病率及致死率均较高,目前,其发病机理尚未完全清楚,有部分学者认为[7],硝酸盐类物质的过量摄入、食物中微量元素和无机盐的缺乏及各种如抽烟等不良习惯是其主要致病因素。食管癌治疗方式仍停留在化疗、放疗、手术切除等常规恶性肿瘤治疗手段,其中,手术切除是临床主要治疗方式[8]。但传统开放式食管癌切除术手术创口较大、术后留置管较多,严重影响患者后期康复。随着腔镜手术的不断发展及微创技术的日渐成熟,相较于传统手术,胸腔镜、腹腔镜切除术术中创伤更小,出血量更低,可显著改善患者术后恢复情况,减少其术后并发症发生数,已被逐渐运用于食管癌切除术中[9-10]。
本次研究结果显示,术前两组肺功能指标及血清炎性因子水平无显著差异(P>0.05);胸腔镜组术中出血量、手术时间、术后引流量、VAS 评分、并发症发生率及术后血清炎性因子水平显著低于传统组;肺功能相关指标显著高于传统组,差异具有统计学意义(P<0.05);两组术中淋巴结清扫个数差异不显著(P>0.05),提示胸腔镜、腹腔镜下行食管癌切除术相较传统开放性手术具有同样的淋巴结清扫能力,此外,腔镜下手术能有效改善患者术中指标及术后疼痛症状,降低手术对患者肺功能及机体炎症反应的影响,减少并发症的发生,达到促进患者术后康复的目的。笔者认为,胸腹腔镜下手术能获得开阔且无盲区的视野,因此可以达到与传统开胸手术的清扫效果。此外,气道通畅程度、肺脏状态、胸廓与肺组织顺应性及其完整性等多个因素决定了健康人体中肺功能的优劣程度,传统开胸手术中,由于手术创面较大,肺组织及和内脏长时间的暴露及术中对肺部的挤压和挫伤,对患者肺功能及循环系统功能造成严重影响。同时,膈肌是呼吸系统的核心肌肉之一,一半以上的呼吸作用与其有关,传统开胸手术则会严重破坏膈肌的完整性,加剧其对患者肺功能的损害,腔镜下手术则可有效改善此类情况,本次研究结果中胸腔镜组术后肺功能优于传统组也可对笔者观点进行证实。
患者机体损伤则可引起其体内血清炎性因子水平上升,IL-6、IL-8、TNF-α 是3 种促炎因子,许建功等[11]报道指出,此3 种促炎因子可促进T 淋巴细胞及超敏C 蛋白表达,促进机体炎症反应。且其水平随机体损伤程度增加而上升。多种炎性因子相互作用,形成循环效应,引发一系列不良反应。IL-10 则为一种抑炎因子,可抑制机体免疫应答,多种因子互相拮抗,互相影响,调节患者机体炎症反应。腔镜下行食管癌切除术以其微创性可有效减少患者机体创伤,从而缓解其炎性反应,降低患者血清炎性因子水平,同时,疼痛作为与炎性反应紧密相关的症状,患者炎症反应的降低则能有效对其疼痛症状进行缓解。马明全等[12]指出,肿瘤的发生与患者免疫系能力有关,肿瘤发生后,癌细胞严重影响患者免疫功能。同时手术创伤损害患者正常生理机能,引起一系列严重应激反应,进一步破坏患者免疫系统,导致患者免疫力显著降低,极易发生各种继发感染,形成恶性循环。结合此观点,笔者分析,使用微创手术减轻患者机体损伤能有效降低其对患者免疫功能的损害,进而减少患者并发症的发生。此外,国内目前也有部分学者对腔镜下食管癌切除术进行研究,马明全等[12]研究显示胸腔镜下食管癌切除术能有效缓解患者术后应激反应;张续民等[13-14]证实腔镜下手术可有效降低食管癌切除术对患者肺功能及炎症反应的影响;李志龙等[14-15]证实,胸腔镜下手术能有效减少食管癌患者术后并发症发生数。
综上所述,胸腹腔镜食管切除术能在保证淋巴结清扫效率的前提下有效改善食管癌患者术中指标,减低其术后并发症发生率、术后疼痛及手术对患者肺功能的影响,改善患者术后感染症状,但本研究样本较少,且全为我院患者,此观点还需多中心、大样本研究证实。
