孕期及哺乳期铅暴露对仔代大鼠学习记忆能力的影响及其机制
2020-04-20尹晓婷钱鸿昊
李 环,尹晓婷,钱鸿昊,张 晶
(北华大学医学院环境卫生教研室,吉林 吉林 132001)
铅是环境中存在的重金属污染物,对儿童和动物中枢神经系统(central nervous system,CNS)的发育具有极大的毒性。学习和记忆认知障碍是铅中毒儿童的主要临床症状。铅暴露通过影响突触功能可塑性,即长时程增强(long-term potentiation,LTP)或长期抑制(long-term depression,LTD)[1],从而影响动物的学习记忆能力。有关海马相关的空间学习和记忆过程研究[2]显示:即刻早基因c-fos及其产物在学习记忆的信号传导中起重要作用,c-fos蛋白是促进神经结构重塑并刺激神经生长的重要因素。另外海马相关神经递质如兴奋性神经递质谷氨酸(glutamic acid,Glu)、抑制性神经递质γ-氨基丁酸(gamma-aminobutyric acid,GABA)等含量可直接反映学习记忆能力[3]。小清蛋白(parvalbumin, PV)主要在篮状和树枝状GAGA神经元中表达,精神分裂症患者的认知功能损害与PV阳性GAGA神经元的突触抑制功能障碍密切相关[4],在患者海马和杏仁核等脑区PV阳性的GAGA神经元密度下降[5],据此推测PV也会影响学习记忆能力。但PV对子代学习记忆能力的作用尚未见报道。本研究对孕期及哺乳期母鼠通过自由饮水接触不同水平铅,建立铅暴露模型,通过检测出生10 d后仔代大鼠学习记忆能力、血液中铅质量浓度、海马组织中铅和一氧化氮(nitric oxide, NO)水平及一氧化氮合酶(nitric oxide synthase,NOS)活性及c-fos和PV蛋白的表达情况,探讨c-fos及PV与仔代大鼠学习能力、海马组织中NO水平及NOS活性的相关性,阐明铅对仔代大鼠神经系统发育期记忆功能损害的可能机制。
1 材料与方法
1.1 实验动物、主要试剂和仪器8只雌性和4只 Wistar大鼠购自吉林大学实验动物中心,动物许可证号:SCXK(吉)2010-0005,体质量为250~270 g,将大鼠饲养在12 h∶12 h的明暗循环中,通风良好且温度恒定(18℃~23℃),相对湿度45%~55%,动物适应实验室的光照和喂养条件,1周后用于实验。所有实验方案均遵循《实验动物的护理和使用指南》中的原则和程序进行,并经北华大学实验动物使用伦理委员会批准。 醋酸铅(分析纯,沈阳化学试剂有限公司),考马斯亮蓝蛋白测定试剂盒、NO硝酸还原酶法试剂盒和NOS化学比色法试剂盒(南京建成生物工程研究所),兔抗大鼠c-fos抗体和PV单克隆抗体(美国Santa Cruz公司),HRP-抗兔二抗(武汉博士德公司),BCA 试剂盒 (上海碧云天生物技术有限公司)。AI1200原子吸收光谱仪(加拿大Aurora公司), Bio Imaging System凝胶成像系统(美国Gene公司),AY120电子分析天平(日本岛津公司),DK-8D型电热恒温水槽(上海精宏实验设备有限公司),LDZ4-0.8台式离心机(北京医用离心机厂),Morris水迷宫(中国医学科学院),24UV型超纯水仪(美国Millipore公司)
1.2 实验动物模型制备和分组Wistar大鼠适应1周后,将8只雌性大鼠单独饲养,并随机分为对照组和低、中及高剂量铅暴露组,每组2只。低、中和高剂量铅暴露组大鼠分别饮用含0.05%、0.10%和0.20%醋酸铅的去离子水,对照组大鼠饮用去离子水。2周后以雌雄比例2∶1合笼,每日早6点检查雌鼠阴栓,当确定雌鼠怀孕后,对孕鼠继续饮用含铅的去离子水直至仔鼠出生后第10天。每组随机选取10只仔代大鼠用于后续实验,雌雄不限。
1.3 仔代大鼠Morris水迷宫实验按照田元春等[6]报道的水迷宫方法进行仔代大鼠定位航行实验和空间探索。该实验过程包括训练5 d和测试1 d。训练当天,将大鼠依次按北西南东4个象限入水点放入池中,测定120 s内找到水下平台的时间(即逃避潜伏期)和游泳路径的长度,找到平台实验便终止。将在120 s内找不到平台的大鼠引导到平台上,并停留30 s。未能找到平台大鼠的逃避潜伏期按 120 s 计算。最后 1 d 进行空间探索实验,撤去平台,于训练时的对侧入水点把仔代大鼠放入水中自由游泳2 min,检测其寻找原平台所在象限的穿越次数和停留时间。为减少外界环境对仔代大鼠的干扰,训练及测试期间迷宫外参照物及环境保持不变,实验人员尽量保持安静,测试时间为每天上午 9:00-12:00。
1.4 仔代大鼠血液和海马组织中铅质量浓度测定水迷宫实验后,仔鼠眼球取血,将血收集到装有肝素钠的离心管中,颈椎脱臼处死,冰上剥离脑组织,取双侧大脑半球,分离海马组织,称质量。将全血及左侧海马组织用硝酸进行消化并定容,采用原子吸收分光光度法通过AI1200原子吸收光谱仪测定铅质量浓度。
1.5 生化方法检测仔代大鼠海马组织中NO水平和NOS活性准确称量右侧海马组织,放入离心管中,在冰上按质量体积比为1∶9加入生理盐水,置于组织匀浆机中进行匀浆后,低温离心,2 500 r·min-1离心 10 min,提取上清液于-20℃保存,待测。按照NO及NOS测定试剂盒采用生化方法进行测定分析。
1.6 蛋白免疫印迹法检测仔代大鼠海马组织中c-fos和PV蛋白表达水平将每组仔代大鼠的海马组织取出并迅速置于-80℃保存待测。将样品置于4℃预冷裂解缓冲液(质量体积比为1∶6)中,4℃超声粉碎(6 s×3次),4℃孵育30 min,每10 min震荡1次,低温离心12 000 r·min-1,10 min×3次,取上清液分装并于-80℃保存。通过Bradford法测定蛋白质含量,使用标准牛血清白蛋白通过10% SDS-PAGE分离蛋白质。用5%脱脂奶粉封闭2 h后,加入1∶100兔抗大鼠c-fos抗体和PV单克隆抗体,在37℃摇动1 h,用PBST洗涤3次,每次10 min。加入辣根过氧化物酶标记的二抗(1∶1 000),在37℃摇动1 h,用PBST洗涤3次,然后用化学发光剂在凝胶成像系统观察条带。使用Image J软件通过灰度值测定法对蛋白质进行定量,以c-fos和PV蛋白与相应内参(β-actin)灰度值的比值代表c-fos和PV蛋白表达水平。

2 结 果
2.1 各组仔代大鼠学习记忆能力与对照组比较,中和高剂量铅暴露组仔代大鼠逃避潜伏期和游泳距离明显增加(P<0.05);目标象限停留时间和穿越次数明显减少(P<0.05),且呈剂量依赖性。见表1。
2.2 各组仔代大鼠血液和海马组织中铅质量浓度经单因素方差分析,各组仔代大鼠血液和海马组织中铅质量浓度比较差异有统计学意义(F=176.44,P<0.01;F=37.37,P<0.01);与对照组比较,铅暴露组仔代大鼠血液和海马组织中铅质量浓度明显升高(P<0.05),且呈剂量依赖性。见表2。
2.3 各组仔代大鼠海马组织中NO水平和NOS活性各组仔代大鼠海马组织中NO水平和NOS 活性比较差异有统计学意义(F=4.105,P<0.05;F=3.443,P<0.05);与对照组比较,高剂量铅暴露组仔代大鼠海马组织中NO水平明显降低(P<0.05),NOS活性降低(P<0.05)。见表3。
表1 各组仔代大鼠空间学习记忆能力


GroupPositioning navigation testEscape latency(t/s)Swimming distance (l/m)Space exploration experimentTime of staying in target quadrant (t/s) Number of cossingplatform (n)Control9.41±4.3113.59±2.2117.75±2.336.27±1.01Lead-exposed Low dose10.65±3.1714.54±3.5112.84±3.574.40±1.72 Medium dose 17.31±2.81∗18.62±2.71∗9.32±1.28∗3.52±0.96∗ High dose24.13±4.91∗21.35±2.45∗7.66±2.02∗1.95±0.48∗F6.2853.9244.4097.045P0.0040.0240.0160.002
*P<0.05 compared with control group.
表2 各组仔代大鼠血液和海马组织中铅质量浓度
Tab.2 Lead concentrations in blood and hippocampus tissue of offspring rats in various groups
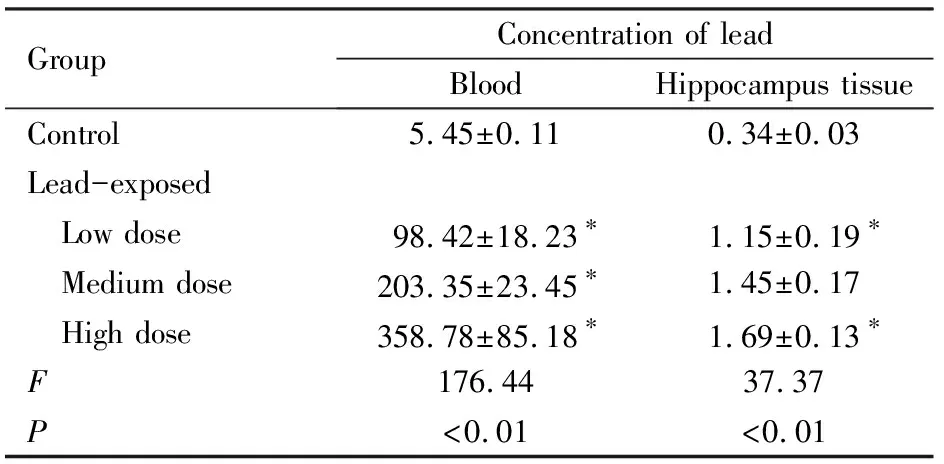
Group Concentration of lead Blood Hippocampus tissueControl5.45±0.110.34±0.03Lead-exposed Low dose98.42±18.23∗1.15±0.19∗ Medium dose 203.35±23.45∗1.45±0.17 High dose358.78±85.18∗1.69±0.13∗F176.4437.37P<0.01<0.01
*P<0.05 compared with control group.
2.4 各组仔代大鼠海马组织中c-fos和PV蛋白表达水平随着母鼠暴露铅剂量的增加仔代大鼠海马组织中c-fos蛋白表达水平逐渐降低,而PV蛋白表达水平逐渐升高。与对照组比较,中和高剂量铅暴露组仔代大鼠海马组织中PV蛋白表达水平明显升高(P<0.05),而各剂量暴露铅组仔代大鼠海马组织中c-fos蛋白表达水平明显降低(P<0.05)。见图1。
表3 各组仔代大鼠海马组织中NO水平和NOS活性

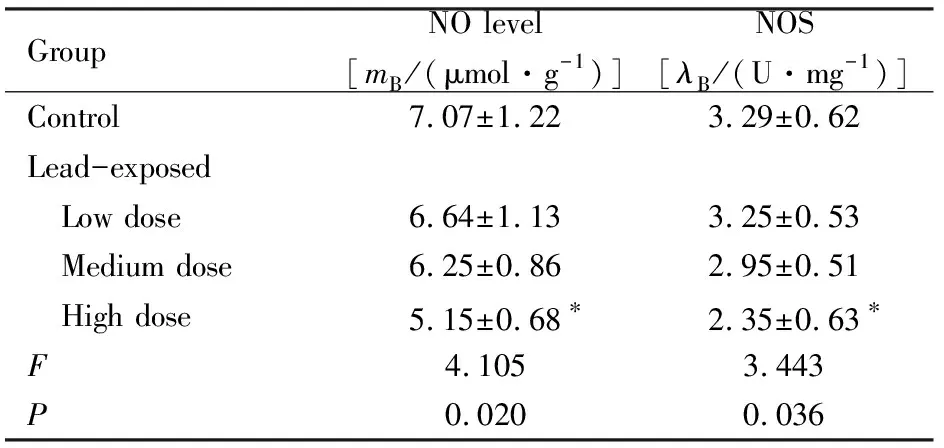
Group NO level[mB/(μmol·g-1)]NOS[λB/(U·mg-1)]Control7.07±1.223.29±0.62Lead-exposed Low dose6.64±1.133.25±0.53 Medium dose 6.25±0.862.95±0.51 High dose5.15±0.68∗2.35±0.63∗F4.1053.443P0.0200.036
*P<0.05 compared with control group.
2.5 仔代大鼠海马组织中c-fos和PV蛋白表达水平与学习记忆能力相关指标相关性经Pearson相关分析,仔代大鼠海马组织中c-fos蛋白表达水平与空间探索实验中仔代大鼠目标象限停留时间和穿越次数以及海马组织中NO水平和NOS活性呈正相关关系(P<0.01);仔代大鼠海马组织中PV蛋白表达水平与空间探索中仔代大鼠目标象限停留时间和穿越次数以及海马组织中NO水平和NOS活性呈负相关关系(P<0.01)。见表4。
3 讨 论
神经系统是铅的主要靶标,由于人类的大脑发育以及人类妊娠期与大鼠妊娠期及产后10 d相对应[7],本文作者建立了人类等效妊娠期铅暴露大鼠模型以探讨铅对海马相关空间学习和记忆能力的影响。本研究结果显示:随醋酸铅暴露剂量增加,仔代大鼠血液和海马组织中铅质量浓度升高,证实在孕期和哺乳期接触铅,铅就能被子代所吸收并进入仔鼠脑内发生蓄积[8-9]。有研究[10-11]显示:Cx43半通道参与了铅从细胞外到细胞内的转运,但发育中的大脑血脑屏障并不完善,且生长发育期铅暴露可损害大鼠血脑屏障紧密连接,使铅蓄积于脑组织。
海马是一种边缘结构,与学习和记忆功能密切相关。Morris水迷宫实验是检测生长发育期海马损害较为敏感的检测方法[12]。本研究结果显示:母鼠孕期和哺乳期接触铅,可使仔代大鼠在Morris水迷宫任务中存在缺陷,表现为平均逃避潜伏期和游泳距离明显延长,穿越隐匿平台次数明显减少,说明仔代大鼠学习和记忆功能已经表现为损伤。
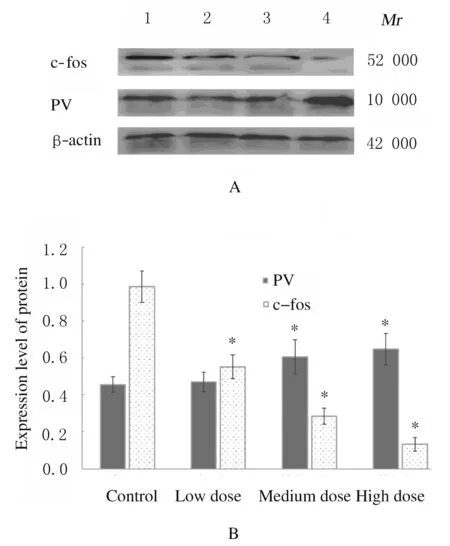
*P<0.05 compared with control group.
Lane 1:Control group;Lane 2-4:Low,medium and high doses of lead-exposed groups.
图1 各组仔代大鼠海马组织中c-fos和PV蛋白表达电泳图(A)和直条图(B)
Fig.1 Electrophoregram(A)and histogram(B) of expressions of c-fos and PV proteins in hippocampus tissue of offspring rats in various groups
表4 仔代大鼠海马组织中c-fos和PV蛋白表达水平与学习能力相关指标的相关性分析
Tab.4 Correlation analysis on expression levels of c-fos and PV proteins in hippocampus tissue and learning and memory abilities of offspring rats

Learning abilityc-fosrPPVrPEscape latency-0.6160.0010.2820.181Swimming distance-0.5720.0040.3490.095Time of staying in target quadrant0.6310.001-0.4920.036Number of crossing platform 0.729<0.01-0.3930.057NO content 0.5860.004-0.3620.083NOS activity 0.4720.020-0.2850.177
学习记忆能力的分子基础是LTP,研究[13]显示:神经元内典型的NO作为逆行性信息分子,通过NO-cGMP 信号系统,参与了LTP,而NOS 是催化生成NO的关键酶[14]。REDDY等[15]研究发现:低剂量铅暴露可降低大鼠神经元细胞中 NOS 活性,抑制 NO产生,降低其调节 LTP 的能力,产生认知障碍。其原因为铅作为金属离子可与 NOS 活性中心结合或者通过离子的竞争拮抗作用抑制 Ca2+的内流,从而降低 NOS 活性或使 NOS失活,减少NO 的产生,铅可以通过氧化损伤机制激活诱导型NOS,生成 ONOO-自由基,破坏神经元细胞的抗氧化系统,促使与学习记忆相关的基因、蛋白质等结构和功能发生变化,使学习记忆功能下降[16-18]。本研究结果显示:母鼠铅暴露后,仔代大鼠海马组织中NO水平及NOS活性较对照组均明显降低,并且随母鼠铅暴露剂量的增加,NO水平下降也更加明显,这也加重了铅的神经发育毒性进而影响学习记忆能力,此结果也与上述的水迷宫测试结果相符合,随着仔代大鼠海马组织中铅质量浓度的升高,NOS活性明显下降,产生的NO水平不足以完成LTP,影响学习能力。
c-fos存在于海马组织中[19]。目前c-fos与学习记忆关系的研究最为深入。c-fos基因缺乏小鼠的空间学习记忆能力明显降低[20],有学者[21]提出将 c-fos 基因作为学习记忆功能的客观指标之一。研究[22]显示:大鼠急性铅暴露时出现的学习记忆功能的受损可能与铅通过Ca2+/CaM-CaMKⅡ信号转导通路抑制CaMKⅡ下游因子CREB和c-fos蛋白的活性有关。本研究结果显示:母鼠铅暴露后仔代大鼠海马组织中c-fos蛋白表达水平下降;并且相关分析结果显示c-fos蛋白表达水平与水迷宫测试的学习能力指标以及海马组织中NO水平呈正相关关系,因此推测铅可能通过影响与c-fos相关的信号通路和关键分子而产生神经毒效应,影响学习记忆能力。
PV作为钙结合蛋白(calcium-binding proteins, CBPs)家族成员,主要通过对细胞内 Ca2+浓度的调控平衡神经元膜内外Ca2+浓度。研究[23-24]显示:PV能够通过对抗缺血缺氧性脑损伤引起的胞内Ca2+超载从而起到神经保护作用,且PV是脑内抑制性系统的主要神经化学物质,PV蛋白表达于中枢神经系统GABA能中间神经元的亚群中,参与突触的形成及其功能的成熟并具有神经保护作用。研究[25]证实:铅可以使海马神经细胞中Ca2+浓度升高,超载的 Ca2+导致海马神经元损伤及神经功能损害,突触传递效能减弱,从而引起大鼠学习记忆能力下降。本实验中铅暴露组仔代大鼠海马组织中PV蛋白表达水平高于对照组,并在相关分析中显示PV蛋白表达水平与水迷宫测试的学习能力指标以及海马组织中NO水平呈负相关关系,提示海马组织中PV蛋白与学习记忆功能有一定关系。本文作者推测升高的PV蛋白表达水平可能一方面能缓冲细胞内游离Ca2+,减轻Ca2+超载损伤;另一方面通过对PV中间神经元的突触活化作用增强,使得该区域的神经元相对抑制而保护神经,是机体的一种反馈调节机制。但PV蛋白的高表达可能也会导致动物脑内兴奋性和抑制性平衡发生改变,因而使得本研究中高剂量铅暴露组仔代大鼠的神经行为改变明显突出。铅暴露后PV蛋白在海马组织中高表达的效应是机体的反馈保护机制还是铅的损伤机制所引起尚需进一步深入探讨。
综上所述,大鼠孕期及哺乳期铅暴露可损伤仔代大鼠的学习记忆能力,其毒性作用机制可能与海马组织中c-fos蛋白表达水平降低和PV蛋白表达水平升高有关。
