蒙药给旺-9味对D-氨基半乳糖诱导急性肝衰竭模型大鼠免疫功能的影响*
2020-04-20王月洪乌日嘎苏丽娅
闹 敏,王月洪,乌日嘎,赞 根,苏丽娅
(内蒙古医科大学蒙医药学院 呼和浩特 010110)
ALF 是一种起病急、进展迅速、预后凶险的疾病和综合征[1]。其发病机制复杂且尚不完全明确,有学者[2]提出肝衰竭发生发展过程中,除了大量肝细胞死亡还存在2种典型重要改变:炎症细胞浸润与微循环障碍;分别反映肝衰竭时出现的免疫损伤与缺血缺氧及再灌注损伤,肝组织依次经受这三重致死性打击是ALF 走向不可逆转结局的主要推动机制。面对ALF治疗陷入瓶颈期的情况[3-5],阻断疾病发展的主要推动机制,扫除有效防治策略建立上的障碍迫在眉睫。蒙药给旺-9味为蒙医治疗肝损伤的经典方,广泛用于肝热、肝血炽盛热、肝硬化、脂肪肝、急性肝损伤、病毒性肝炎、酒精性肝损伤等疾病疗效显著[6]。有研究表明给旺-9 具有保肝作用以及调节脂质代谢和抗脂质过氧化的作用[7-11]。另外本课题组前期研究发现,蒙药给旺-9可明显减轻D-GalN 诱导ALF 模型大鼠的血清转氨酶水平,明显减轻肝细胞坏死程度,减轻炎性细胞浸润等。基于给旺-9 味在治疗肝胆疾病方面具有优势和前景且在阻断ALF 发展的主要推动机制中有一定的作用,本研究通过观察给旺-9对ALF 模型大鼠肝脏细胞因子IL-2、IL-6、TNF-α和IFN-γ等指标的影响以及对形态学的影响从免疫调控作用角度探讨蒙药给旺-9 保肝作用,为该药防治ALF 提供实验依据,并为其后续保肝作用机制研究提供实验基础,同时为揭示肝衰竭的发病机制提供新的思维方式并使其更好地应用于临床提供理论依据。
1 材料
1.1 动物
清洁级成年雄性SD 大鼠(北京市斯贝福生物技术有限公司,许可证号:SCXK(京)2016-0002);大鼠被饲养于内蒙古医科大学动物实验室,大鼠词料由该实验中心提供。饲养环境:清洁级动物词养室,室温15-20℃,湿度(60-80)%,定时通风换气,自然明暗周期。
1.2 药品
D-GalN(美国sigma 公司,准字号:G500);给旺-9味(库伦制药厂,国家准字号:Z15020878);复方甘草酸苷,商品名:美能(中国材药业有限公司准字号:17259);伊红染液(成都成科汇博科技有限公司,批号:G1040);苏木素染液(成都成科汇博科技有限公司,G1140);中性树胶(北京索莱宝有限公司,G8590);Leica石蜡(德国Leica公司,批号39601006)。
1.3 主要试剂
氢氧化钠(天津永晟精细化工有限公司,准字号:0140101);羧甲基纤维素钠(CMC-Na)(国药集团化学试剂有限公司,准字号:F20100407);水合氯醛(国药集团化学试剂有限公司,准字号:20171211);AST、ALT 试剂盒、IL-2,6 试剂盒、TNF-α试剂盒、IFN-γ试剂盒(武汉基因美生物科技有限公司,准字号:201907)。
1.4 主要仪器
TOSHIBA 全自动生化分析仪,型号:Accute TBA-40FR;酶标仪:北京普朗新技术有限公司,型号:DNM-960;离心机:微量高速离心机(国产)型号:TG16W;LeicaRM2235 轮转式切片机;LeicaHI1210 摊片机;LeicaHI220 烘片机;LeicaDFC450 显微镜;YD-12G 生物组织脱水机。
2 实验方法
2.1 动物分组及给药
将72 只清洁级雄性SD 大鼠随机分为六组:空白组、模型组、阳性组、蒙药给旺-9 味低中高剂量三组,各12 只,给予普通饮食适应性喂养7 天,次日开始给药,所有药物均以0.5% CMC-Na 为溶媒,换算等效临床剂量后,阳性药美能组0.45 g·kg-1·天-1,蒙药给旺-9味低、中、高剂量组分别(0.4 g、0.8 g、1.6 g)·kg-1·天-1剂量灌胃,空白组与模型组给予等容量0.5%CMC-Na 以作对照。灌胃体积20 mL·kg-1,每日一次,连续10天。
2.2 动物模型的建立
末次给药后禁食12 h,除空白组外,其余各组大鼠单次腹腔注射600 mg·kg-1D-GalN(D-GalN 溶于无菌生理盐水中,用1 mmol·L-1的NaOH 将pH 调至7.0,配置成浓度为10% 的溶液,根据预实验结果选定600 mg·kg-1为最佳造模)进行造模。造模2 h 后立即给予相应药物灌胃,间隔12 h 后再灌胃1 次,方法同上。
2.3 标本釆集与处理
动物处死前24 h,禁食不禁水。D-GalN 造模后48 h,腹腔注射水合氯醛麻醉,腹主动脉采血,促凝管接血,3000 rpm 速度离心15 min,取上清液,存放于-20℃冰箱待检。处死动物分离出肝组织,装于DEPC水处理过的EP 管中,放置液氮中快速冷冻,然后转移至-80℃超低温冰箱保存待测。取肝右叶固定部位染色、显微镜下观察肝组织形态学变化。
2.4 观察指标
大鼠血清肝功能指标检测:采用全自动生化分析仪严格按照试剂说明测定血清ALT、AST;肝组织免疫指标检测:肝匀浆取上清液采用Ellisa 法检测IL-2、IL-6、TNF-α、IFN-γ;组织病理形态学学观察。
3 统计学分析
采用SPSS 19.0 统计软件,采用单因素方差分析,计量资料±s表示,P<0.05为差异有统计学意义。
4 结果
4.1 各组大鼠血清中的AST、ALT水平
与空白组比较,模型组大鼠血清AST、ALT水平显著升高,差异有统计学意义(#P<0.05),模型成立;与模型组比较,阳性组、蒙药低、中剂量组均显著降低ALT水平,差异有统计学意义(*P<0.05)(表1)。
4.2 各组大鼠肝脏中的IL-2、IL-6、TNF-a、IFN-γ 水平(表2)
4.2.1 IL-2
与空白组比较模型组IL-2水平显著升高,差异有统计学意义(#P<0.01)、蒙药低、中剂量组IL-2水平差异均有统计学意义(#P<0.01);与模型组比较阳性组、蒙药组均显著降低IL-2 水平,差异均有统计学意义(*P<0.01);与阳性组比较蒙药低剂量组,中剂量组IL-2水平差异有统计学意义(+P<0.01)。
表1 各组大鼠血清中的AST、ALT(±s,n = 12)

表1 各组大鼠血清中的AST、ALT(±s,n = 12)
注:#P <0.05 vs blank group;*P <0.05 vs model group
组别空白组模型组阳性组低剂量组中剂量组高剂量组AST/(pg·mL-1)119.73±13.111145.20±630.16#109.46±513.82#4358.32±3947.695442.888±3211.8#5527.03±3506.12 ALT/(pg·mL-1)31.64±3.841091.81±209.15#631.91±293.79#*500.96±305.28#*208.31±160.78*644.225±389.69#
4.2.2 IL-6
与空白组比较模型组IL-6水平显著升高,差异有统计学意义(#P<0.01)、蒙药低、中剂量组IL-6水平差异均有统计学意义(#P<0.01);与模型组比较阳性组、蒙药组均显著降低IL-6 水平,差异均有统计学意义(*P<0.01);与阳性组比较蒙药低剂量组,中剂量组IL-6水平差异有统计学意义(+P<0.01)。
4.2.3 TNF-α
与空白组比较模型组TNF-α水平显著升高,差异有统计学意义(#P<0.01)、蒙药低、中剂量组TNF-a水平差异均有统计学意义(#P<0.01);与模型组比较阳性组、蒙药组均显著降低TNF-a 水平,差异均有统计学意义(*P<0.01);与阳性组比较蒙药低剂量组,中剂量组TNF-a水平差异均有统计学意义(+P<0.01)。
4.2.4 IFN-γ
与空白组比较模型组IFN-γ水平显著升高,差异有统计学意义(#P<0.01)、阳性组、蒙药组IFN-γ水平差异均有统计学意义(#P<0.01);与模型组比较阳性组、蒙药组均显著降低IFN-γ水平,差异均有统计学意义(*P<0.01);与阳性组比较蒙药低剂量组,中剂量组IFN-γ水平差异均有统计学意义(+P<0.01)。
4.3 肝脏病理形态学结果
镜下模型组肝组织结构紊乱、肝索形态不清晰、肝细胞肿胀变形,大部分弥漫性中度至重度气球样水肿、偶可见肝细胞轻度脂肪变性,汇管区可见不同程度的细胞浸润,窦内皮轻到中度增生以及不同程度的胆管增生,镜下视野可见弥漫性大片状及桥接样坏死为主,可见多处核固缩,溶解,碎裂。给旺-9味组肝组织镜下:肝板排列,肝索形态未见明显好转、低剂量水肿程度无明显改善,中剂量和高剂量组肝细胞水肿较其它组减轻多数以轻度水肿为主,高、中剂量组脂肪变性较模型组减轻,汇管区周围炎细胞浸润减轻,偶见窦内皮增生,高中低剂量组胆管增生均明显改善,低剂量组肝细胞坏死仍有桥接坏死及碎片状坏死,中、高剂量组坏死区域明显改善以点状坏死和碎片状坏死为主,高剂量组镜下视野多见弥漫性出血,中剂量组偶见。总结:蒙药组可明显减轻肝组织细胞水肿,炎症变性,坏死表现,蒙药高剂量组肝细胞坏死程度最轻。
5 讨论
表2 各组大鼠肝脏中的IL-2、IL-6、TNF-a、IF-γ(±s,n= 12)
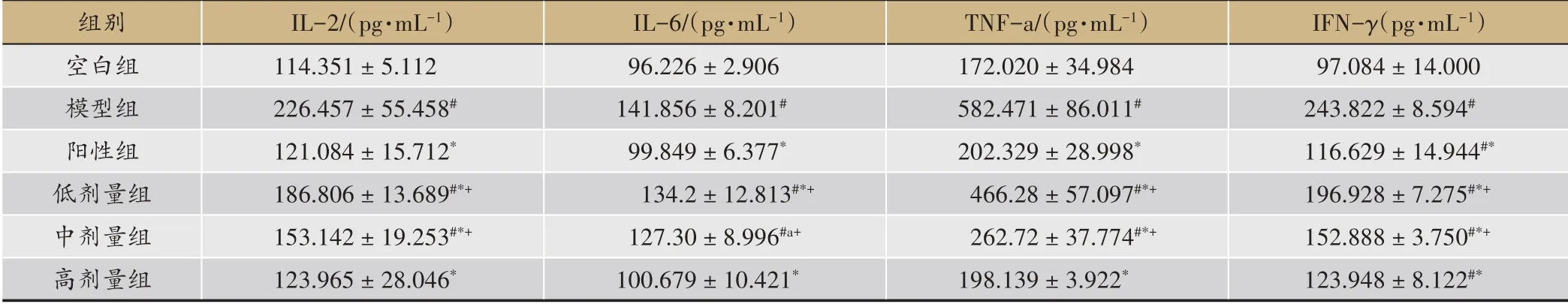
表2 各组大鼠肝脏中的IL-2、IL-6、TNF-a、IF-γ(±s,n= 12)
注:#P <0.01vs blank group;*P <0.01,*P <0.05 vs model group;+P <0.01 vs control group
组别空白组模型组阳性组低剂量组中剂量组高剂量组IL-2/(pg·mL-1)114.351±5.112226.457±55.458#121.084±15.712*186.806±13.689#*+153.142±19.253#*+123.965±28.046*IL-6/(pg·mL-1)96.226±2.906141.856±8.201#99.849±6.377*134.2±12.813#*+127.30±8.996#a+100.679±10.421*TNF-a/(pg·mL-1)172.020±34.984582.471±86.011#202.329±28.998*466.28±57.097#*+262.72±37.774#*+198.139±3.922*IFN-γ(pg·mL-1)97.084±14.000243.822±8.594#116.629±14.944#*196.928±7.275#*+152.888±3.750#*+123.948±8.122#*
ALF 的病理损伤涉及过度免疫,炎症性细胞因子网络的激活,肝细胞的凋亡和坏死,脂质过氧化反映等在内的多种机制。本研究中采用的D-GlaN 诱导急性肝脏衰竭模型通过能量耗竭、钙离子内流、破坏肝细胞膜的完整性而引起肝脏原发性损伤,还可以促进内毒素的产生,激活肝脏的Kupffer 细胞,导致一系列炎症因子的释放,炎症因子的过度表达引起肝脏二次打击[12]可以促进活性氧的产生,引起肝脏的过氧化增强、代谢紊乱[13-16]加重肝脏损害,最后导致肝细胞大量死亡,炎性细胞浸润,微循环障碍等肝脏的三重打击,符合急性肝功能衰竭的临床表现、病理变化、生化、凝血功能等[17]。肝功能检查血清转氨酶的变化是反映肝细胞损害的敏感指标,其中普遍以ALT、AST作为观察指标,ALT在肝脏中的含量最丰富,AST属细胞内功能酶,肝细胞受损或坏死后ALT、AST 释放入血中[18]。血清中的ALT、AST 升高时,肝脏组织的ALT、AST 活力下降,进而肝细胞代谢发生一系列障碍,即大量的肝细胞坏死导致的免疫功能失调往往会对肝脏进行第二次打击,进一步加重肝损伤。本研究肝功结果显示:与空白对照组比较,模型组血清ALT、AST 水平显著升高,差异有统计学意义(P<0.05),组织形态学结果中模型组镜下肝组织结构紊乱、肝索形态不清晰、肝细胞中度至重度水肿、细胞浸润、胆管增生,弥漫性大片状及桥接样坏死为主,多处核固缩,溶解,碎裂等,以上提示造模成功。ALF 的发病机制是一个复杂的系统,被多数学者支持的“二次打击学说”还是“三重打击学说”都贯穿整个发病过程,免疫失衡是它们持续损伤肝组织的根本原因。IL-2、IL-6、TNF-α、IFN-γ是肝衰竭发病机制信号通路较典型的免疫指标[19,20]。本研究免疫指标检测结果显示:与空白组比较,模型组肝组织细胞因子IL-2、IL-6、TNF-α、IFN-γ水平明显升高,而与模型组比较,蒙药给旺-9 低、中、高剂量组均能显著降低肝组织细胞因子IL-2、IL-6、TNF-α、IFN-γ,差异有统计学意义(均P<0.01),与阳性组比较,蒙药低、中剂量组IL-2、IL-6、TNF-α、IFNγ水平差异有统计学意义(均P<0.01),蒙药高剂量组降低肝组织IL-2、IL-6、TNF-α、IFN-γ水平效果与美能片接近。提示蒙药给旺-9可显著降低D-GlaN 所诱导的ALF 模型大鼠肝组织细胞因子IL-2、IL-6、TNFα、IFN-γ。病理形态学结果显示蒙药组较模型组可明显减轻肝组织细胞水肿,炎症变性,坏死表现,且蒙药高剂量组肝细胞坏死程度最轻。给旺-9味下调IL-2、IL-6、TNF-α、IFN-γ表达水平,从源头治疗阻断疾病发展的主要推动机制,能够减轻肝细胞的损伤具有明显保肝作用,具体作用机制与调节肝组织免疫平衡,减轻其炎性反应有关。
本研究中采用的蒙药给旺-9 味是蒙医治疗肝热性病经典方,方中以牛黄为主药,清肝热,解毒;辅以瞿麦清血热、镇刺痛、解毒;五灵脂清肝热、止痛、调和体素;印度獐芽菜镇希拉,清热解毒;木香调和体素,止痛,共为佐药。使以红花清肝热,锁脉;关木通清肝热,清腑热。诸药合奏清肝热之效。给旺-9具有蒙药方剂多成分、多靶点、多系统性的共性特点,本研究为其后续作用机制研究提供了一定实验依据,同时为揭示肝衰竭的发病机制提供新的思维方式并使其更好地应用于临床提供了理论依据。
