“神宁藏香”对失眠大鼠的行为学及GABA能系统通路的影响*
2020-04-20谭丽博于佳慧郑骁洋仁青加
谭丽博,于佳慧,郑骁洋,刘 燕,于 雪,戴 宁,张 蔚,仁青加,李 峰**
(1. 北京中医药大学中医学院 北京 100029;2. 西藏藏医学院藏医药研究所 拉萨 850000)
失眠是临床常见病、多发病,主要表现为经常不能获得正常睡眠,或入睡困难,或睡眠时间不足,或睡眠不深,或睡后易醒,多梦,醒后疲乏,严重者彻夜不眠,影响工作效率或社会功能为特征的病症。失眠主要由药物、躯体疾病、心理因素以及环境改变等引起,长期睡眠障碍会导致精神思维异常,诱发多种身心疾病[1]。有研究发现,失眠患者时常表现出一定的情绪障碍,特别是抑郁、焦虑、紧张和躁动不安等负性情绪[2]。据调查,我国人群中有45.5%存在不同程度的睡眠质量问题[3],失眠的患病率高达10%-48%[4]。长期失眠所带来的负面影响遍及人们的工作和生活,严重者甚至会引起恶性意外事故[5]。因此,失眠作为一种发病率逐年上升的身心疾病,随着现代人生活节奏的加快和工作压力的加大,越来越严重的影响着患者的工作和生活质量,它不仅仅是医学问题,更是亟待解决的社会问题[6]。
目前临床对于睡眠障碍的治法以重塑睡眠—觉醒节律为主[7],治疗药物主要包括苯二氮卓类、非苯二氮卓类、三环类抗抑郁药、褪黑素等[8],但因部分药物有成瘾性、依赖性、宿醉感等不良反应[9],导致临床应用受到限制,甚至停用。心理疗法和行为认知疗法(CBT-i)是国际上认可度较高的失眠疗法[10],它以心理治疗为核心,需要专业人士的指导,虽为世界上公认的非药物治疗的最佳方案,但因目前尚缺乏训练有素的从业人员且诊疗费用较高,难以在国内普及。
在失眠的治疗方面,传统藏医积累了丰富的经验,形成了独具特色的医学理论和药物疗法[11]。值得一提的是藏香疗法,除了具有防疫、避秽、预防流感等功效,在治疗失眠方面也具有悠久的发展历史,在西藏地区应用广泛。藏香疗法使用独特的鼻吸给药途径,使药物成分直达中枢神经系统,临床应用方便、药效发挥快捷,可有效改善睡眠质量,缓解疲劳,使人心旷神怡、神清气爽[12]。由于藏香疗法对于失眠的显著疗效、加之其价格低廉、携带方便等优势,现已成为深受西藏人民青睐和喜爱的一种生活必需品,其显著的应用价值值得在全国推广使用[11]。
因此,本研究基于藏香在失眠治疗中的应用,从行为学实验角度探讨“神宁藏香”对失眠大鼠不良情绪的干预作用,运用Western Blot技术从GABA 的合成代谢-传导-转运系统探讨其对失眠大鼠下丘脑干预作用的神经生物学机制,为临床中使用“神宁藏香”治疗失眠提供实验依据和理论参考。
1 实验材料
1.1 实验动物
健康雄性SD 大鼠50 只,体质量190±10 g,由北京维通利华实验动物技术有限公司提供,许可证编号为SCXK(京)2016-0006。严格按照实验动物要求的饲养原则饲养于清洁级动物房,普通饲料喂养,自由饮水。
1.2 药物
Ⅰ阳性药组(以下简称西药组):艾司唑仑片。
Ⅱ“神宁藏香”组(以下简称藏香组):以松香、沉香、琥珀、藏红花、藏寇、丁香、檀香、阿魏等药制成藏香。
Ⅲ安神组(以下简称中药组):酸枣仁20 g,川芎9 g,知母15 g,茯苓18 g,生甘草9 g,清半夏10 g,栀子10 g,合欢皮15 g,夜交藤15 g。
艾司唑仑1 盒,购自中日友好医院,常温保存备用;藏香由西藏藏医学院及西藏自治区康松商贸有限公司制备,4℃保存;中药安神方生药购于北京同仁堂,并委托北京创立有限责任公司制备成浸膏,4℃保存备用。
1.3 主要试剂和仪器
DL-4-氯苯丙氨酸(PCPA)(aladdin,上海);戊巴比妥钠(Sigma,美国);BCA 蛋白含量检测试剂盒(凯基生物,江苏);一抗GAPDH(Proteintech,美国),一抗GAD65(Proteintech,美国),一抗GABA-T(Proteintech,美 国),NKCCl(Proteintech,美 国),一 抗GAT-1(Proteintech,美国),兔二抗(Proteintech,美国),鼠二抗(Proteintech,美国);全波长酶标仪CPOCH(Bio-tek,美国);蛋白电泳电转系统(电源、电泳槽、电转槽)(Bio-RAD,美国);超灵敏多功能成像C600(Azure,美国)。旷场箱(众实迪创科技发展有限公司,北京)悬尾实验装置(众实迪创科技发展有限公司,北京),强迫游泳设备(众实迪创科技发展有限公司,北京)。
2 实验方法
2.1 复制失眠模型
SD 大鼠适应性饲养7 天后,随机分为空白对照组(以下简称正常组)(10 只)和失眠模型组(40 只)。模型组采用国际通用化学因素所致失眠模型制作方法,即“氯苯丙氨酸(PCPA)腹腔注射法”复制失眠模型[13],将PCPA 按400 mg/10 mL·kg-1用量,用弱碱性生理盐水配置成混悬液,于每日8:00-8:30对模型组大鼠进行腹腔注射,连续注射2 天。用戊巴比妥钠翻正实验评价模型成功与否,造模后大鼠随机分为模型组、西药组、藏香组、中药组。
2.2 实验动物分组和给药
使用SPSS 软件生成随机数字,将造模后的40 只大鼠,随机分为以下4 组,每组10 只。模型组:连续7天生理盐水灌胃;西药组:连续7 天艾司唑仑灌胃;藏香组:放入10 m2独立动物房饲养(遮光密闭),在上午8时、9时分别点燃1根半藏香,在11时点燃3根,燃香的空间距离大鼠≤5 m,熏燃时间为第1次和第2次30 min,第3 次60 min,连续给药7 天;中药组:连续7 天安神中药浸膏灌胃。各组大鼠给药量依据浸膏出膏率和大鼠给药体表面积公式计算得出。正常组:连续7 天生理盐水灌胃。
2.3 实验及观察指标
2.3.1 一般状态
观察各组大鼠的精神状态、毛发光泽变化、进食饮水量、体质量变化及活动情况等。
2.3.2 戊巴比妥钠翻正实验
分别于第1 次腹腔注射和末次给药36 h 后,依据药量40 mg/Kg,对各组大鼠进行腹腔注射戊巴比妥钠,分别记录各组大鼠腹腔注射时间、入睡时间和苏醒时间,计算其睡眠潜伏期和睡眠持续时间。
2.3.3 旷场实验
于第6天给药30 min后,大鼠在木箱中适应1 min,用录像设备进行实验过程录制,记录各组大鼠5 min内中央格停留时间、中央格穿格次数、中心穿格数百分比、站立次数、修饰次数。两次实验之间,用低浓度乙醇溶液喷洒、清洁场箱内壁及底面。
2.3.4 强迫游泳实验
将大鼠依次放置在一个单独的强迫游泳设备(高40 cm,直径18 cm),其中水的高度30 cm(水温25℃)。两次游泳间期需要引导15 min预测试,24 h后进行6 min的游泳测试。用录像设备进行实验过程录制,记录各组大鼠6 min 测试内大鼠游泳时间(s)、大鼠挣扎时间(s)、飘浮行为(不动)的持续时间。不动定义为顺从的在水中漂浮于垂直位置,只需要小的运动以保持头部在水面之上。
2.3.5 悬尾实验
实验在暗光,白噪声条件下进行,操作者将大鼠尾根部1/3用胶带固定在悬尾仪器挂钩上,使大鼠头部朝下,用录像设备进行实验过程录制,观察并记录6 min内各组大鼠的不动的时间(s)、挣扎次数(次)。
2.4 检测指标
2.4.1 取材
给药结束后第2 天,各组大鼠进行麻醉取材。腹主动脉取血、断头后,迅速剥离大鼠下丘脑,保存于-80℃冰箱冷冻待测,每组随机选取6 只下丘脑进行Western Blot检测。
2.4.2 Western Blot
从-80℃冰箱取出待测大鼠下丘脑组织,加入ripa裂解液超声匀浆,离心后提取上清,采用BCA 试剂盒、酶标仪测定并计算各组组织总蛋白浓度,配平,使各样本蛋白等量,蛋白样品定量为50 μg。根据待测目的蛋白的分子量,选择适宜分离胶浓度配胶,上样并电泳,再电转到PVDF 膜上,脱脂奶粉封闭1.5 h 后,加入一抗GAD65(1:1000)、GABA-T(1:1000)、NKCC1(1:2000),GAT-1(1:1000)、GAPDH(1:50000),4℃孵育过夜,二抗温孵育1.5 h,ECL 化学发光、曝光显影,用凝胶图像处理系统分析目标条带的光密度值。
2.5 统计学处理
使用SPSS 20.0软件处理实验数据,统计描述使用以均值±标准差(xˉ±s)表示;统计分析先对各组数值进行正态性检验和方差齐性检验,若两项都符合,则进行单因素方差分析(ANOVA);不符合则使用非参数检验,P<0.05 表明组间差异具有统计学意义。组间比较的结果柱形图使用GraphPad Prism 软件进行绘制。
3 实验结果
3.1 一般状态
与正常组相比,模型组大鼠毛发枯槁失去光泽,对外界刺激敏感、易激惹,进食、饮水量明显增加,但体质量减轻。
3.2 戊巴比妥钠翻正实验
造模后,和正常组相比,模型组大鼠的睡眠潜伏期延长(P<0.05),而模型组的睡眠持续时间明显缩短(P<0.01),在一定程度上表明成功复制失眠模型(图1)。
给药后,与正常组相比,模型组大鼠睡眠潜伏期显著延长(P<0.01);各给药组和模型组相比睡眠潜伏期有显著性差异(P<0.01);并且,模型组高于西药组和中药组(P<0.05,P<0.05);模型组虽与藏香组相比无差异,但是藏香组睡眠潜伏期有降低趋势;西药组高于中药组,西药组低于藏香组;中药组低于藏香组。
给药后,和正常组相比,模型组大鼠睡眠持续时间明显缩短(P<0.01);和模型组相比,各给药组睡眠持续时间有显著性差异(P<0.01),模型组低于西药组、中药组和藏香组(P<0.01,P<0.01,P<0.01);藏香组大鼠睡眠持续时间均高于中药组和西药组(图2)。
3.3 旷场实验
与模型组大鼠相比,正常组和各给药组在旷场实验的水平运动(中央格停留时间、中央格穿格次数、中心穿格数百分比)及垂直运动(站立次数、修饰次数)指标上正常组均高于模型组(P<0.05)(表1)。
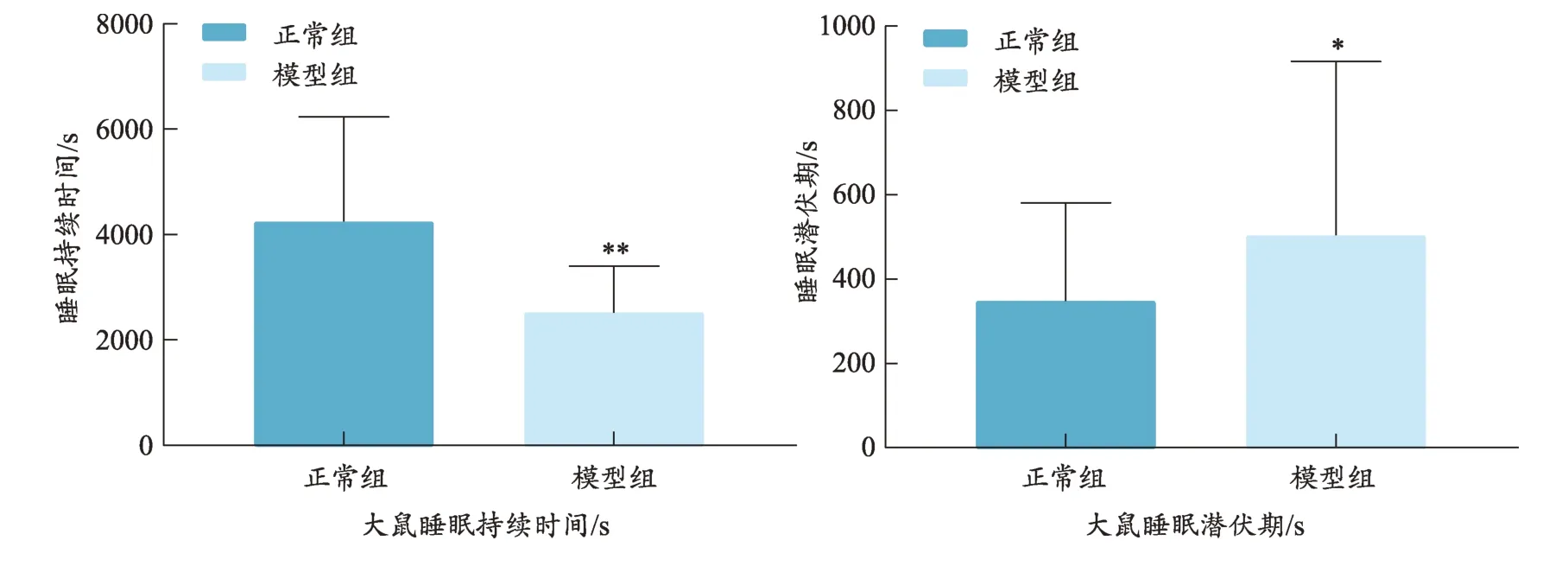
图1 戊巴比妥钠翻正实验结果图

图2 给药后戊巴比妥钠翻正实验结果(±s,n=10)
表1 给药后大鼠旷场实验结果(±s,n=10)

表1 给药后大鼠旷场实验结果(±s,n=10)
注:与正常组比较,*表示P <0.05,**表示P <0.01;与模型对照组比较,△表示P <0.05,△△表示P <0.01。
组别正常组模型组西药组中药组藏香组中央格停留时间(s)38.36±18.941.77±1.46**9.74±1.46△△17.22±3.73△△5.43±0.75△△中央格穿格次数(次)3.43±2.371.57±0.78*3.29±1.25△1.86±1.062.71±1.38中心穿格数百分比(%)15.71±13.222.86±1.21*4.43±4.198.43±5.56△△6.71±6.87站立次数(次)18.71±13.996.57±4.35*16.29±5.64△△12.00±7.1115.57±5.68△△修饰次数(次)8.71±4.533.14±2.03*6.43±1.90△4.86±2.475.29±4.75
3.3.1 中央格停留时间
与正常组相比,模型组大鼠中央格停留时间有显著降低(P<0.05);与模型组相比,西药组、中药组和藏香组均能显著提高大鼠的中央格停留时间(P<0.01,P<0.01,P<0.01);中药组大鼠在旷场中央格停留时间上高于西药组和藏香组。
3.3.2 中央格穿格次数
与正常组相比,模型组大鼠中央格穿格次数明显减少(P<0.05);并且,与模型组相比,西药组中央格穿格次数明显增多(P<0.05),中药组和藏香组与模型组相比虽无差异(P>0.05),但可看出有增高模型大鼠中央格穿格次数的趋势;且西药组高于中药组和藏香组。
3.3.3 中心穿格数百分比
与正常组相比,模型组大鼠中心穿格数百分比显著降低(P<0.05),各给药组与模型组两两比较后发现:中药能显著增加模型大鼠中心穿格数百分比(P<0.01),西药组、藏香组与模型组相比虽无差异(P>0.05),但均有增高模型大鼠中心穿格数百分比的趋势,且藏香组趋势优于西药组。

图3 悬尾实验结果图

图4 大鼠强迫游泳实验结果
3.3.4 站立次数
与正常组相比,模型组站立次数显著降低(P<0.05),各给药组和模型组两两比较后发现:西药组和藏香组均能显著增加模型大鼠站立次数(P<0.01,P<0.01),且西药组优于藏香组;中药组与模型组相比虽无差异(P>0.05),但有明显增加模型大鼠站立次数的趋势。
3.3.5 修饰次数
与正常组相比,模型组修饰次数有显著降低(P<0.05),各给药组和模型组两两比较后发现:西药组能显著增加模型大鼠修饰次数(P<0.05);中药组、藏香组与模型组相比虽无差异(P>0.05),但有明显增加模型大鼠修饰次数的趋势,且藏香组趋势优于中药组。
3.4 悬尾实验
与正常组大鼠相比,模型组大鼠不动时间显著延长(P<0.01),挣扎次数显著降低(P<0.05)。说明大鼠造模后出现明显的负面情绪,表现为喜静少动的绝望感。
与模型组相比,西药组、中药组、藏香组大鼠不动时间明显缩短(P<0.01,P<0.01,P<0.01),且藏香组低于西药组和中药组,中药组低于西药组。
与模型组大鼠相比,各给药组大鼠挣扎次数虽无差异(P>0.05),但各给药组有明显增高模型大鼠挣扎次数的趋势,且中药组趋势高于藏香组和西药组,藏香组趋势高于西药组(图3)。
3.5 强迫游泳实验
3.5.1 漂浮时间
与正常组相比,模型组大鼠的漂浮时间显著增加(P<0.05)。给药干预后,与模型组相比,中药组、西药组及藏香组大鼠的漂浮时间均非常显著性减少(P<0.01,P<0.01,P<0.01),其中藏香组大鼠漂浮时间低于中药组和西药组(图4)。
3.5.2 挣扎时间
与正常组相比,模型组大鼠的挣扎时间非常显著降低(P<0.01)。给药干预后,与模型组相比,西药组和中药组大鼠的挣扎时间显著增加(P<0.05,P<0.05),藏香组与模型组相比虽无明显改变(P>0.05),但有明显增加模型大鼠挣扎时间的趋势。
3.5.3 游泳时间
与正常组相比,模型组大鼠游泳时间明显缩短(P<0.01)。给药干预后,西药组、中药组大鼠游泳时间比模型组显著延长(P<0.05,P<0.01),藏香组与模型组相比虽无差异(P>0.05),但有明显增加模型大鼠游泳时间的趋势。
3.6 失眠大鼠下丘脑中GABA-T、GAD65、NKCCl、GAT-1的蛋白表达
Western Blot结果显示(表2、图5):

图5 各组大鼠下丘脑GABA-T、GAD65、GAT-1、NKCCl的蛋白的表达
表2 各组大鼠下丘脑GABA-T、GAD-65、GAT-1、NKCCl结果(±s,n=6)

表2 各组大鼠下丘脑GABA-T、GAD-65、GAT-1、NKCCl结果(±s,n=6)
注:与正常组比较,*表示P <0.05,**表示P <0.01;与模型对照组比较,△表示P <0.05,△△表示P <0.01。
组别正常组模型组西药组中药组藏香组GABA-T 0.92±0.303.00±2.38**0.86±0.36△△1.08±0.47△1.43±0.90 GAD-651.69±0.970.76±0.24*1.75±0.93△1.32±0.41△1.13±0.43△GAT-12.30±1.360.74±0.27*2.42±2.40△△1.82±1.12△△1.65±1.37 NKCC10.93±0.071.40±0.53**1.13±0.42△1.12±0.43△1.15±0.52△
和正常组相比,模型组大鼠下丘脑GABA-T 蛋白表达量明显增加(P<0.01);西药组和中药组表达比模型组显著下降(P<0.01,P<0.05),藏香组与模型组相比无差异(P>0.05),但是有明显下降趋势。
和正常组相比,模型组大鼠下丘脑GAD-65 蛋白表达显著性降低(P<0.05);与模型组相比,西药组、中药组、藏香组大鼠下丘脑GAD-65 蛋白表达量均显著性增高(P<0.05,P<0.05,P<0.05)。
和正常组相比,模型组大鼠下丘脑GAT-1蛋白表达量显著性降低(P<0.05)。与模型组相比,西药组和中药组表达非常显著上升(P<0.01,P<0.01),藏香组与模型组相比无差异(P>0.05),但是有明显上升趋势。
和正常组相比,模型组大鼠下丘脑NKCC-1 蛋白表达量显著升高(P<0.01);与模型组相比,西药组、中药组和藏香组大鼠下丘脑NKCC-1蛋白表达均显著性降低(P<0.05,P<0.05,P<0.05)。并且,藏香组NKCC-1蛋白表达高于西药组,高于中药组。
4 讨论
随着现代人生活节奏的加快和工作压力的增大,失眠的发病率日益增高,研发疗效显著、安全无副作用的抗失眠制剂势在必行。藏香疗法以其独特的黏膜吸收途径,直达中枢神经系统具有起效迅速,应用方便等诸多优势,值得临床上的进一步研究和应用。
目前,对于失眠的机制研究结果显示:失眠可能与GABA/GLU 系统有关[14],而γ-氨基丁酸(gammaaminobutyric acid,GABA)是中枢系统中与失眠密切相关的神经元[15,16]。因此本研究提出了GABA 系统功能失调是失眠维持性因素的假说,应用行为学实验从宏观角度研究“神宁藏香”对失眠模型大鼠睡眠时长及失眠所导致的负性情绪的调控作用;应用Western Blot分子生物学技术,探究失眠模型大鼠GABA 能系统通路中GABA 的合成代谢、传导和转运三个方面的神经生物学疗效机制。通过对“神宁藏香”进行深入的研究,从而为开发和推广治疗失眠的新制剂提供依据。
4.1 研究对睡眠及情绪的影响
实验结果表明,“神宁藏香”、中药安神方及艾司唑仑均能通过缩短睡眠潜伏期,延长睡眠持续时间有效改善睡眠,且“神宁藏香”在缩短入睡时间、延长睡眠时间方面上有更显著的优势。
有研究报道,普通人群中20%的失眠症者伴有抑郁症状[17],在对60 例原发性失眠症的焦虑抑郁状态调查分析的结果也同样显示[18]:原发性失眠症患者与正常人相比存在不同程度的焦虑抑郁症状。强迫游泳实验和悬尾实验均能反映处于抑郁状态的动物的抑郁程度[19-21]。实验结果显示,失眠模型大鼠强迫游泳和悬尾实验的不动时间均增加,提示其较快放弃逃脱希望,更多时间处于绝望状态,反映出抑郁情绪。给药干预后,“神宁藏香”、安神中药方、西药艾司唑仑均能缩短模型大鼠的漂浮时间和不动时间,缓解失眠造成的抑郁情绪,这与文献中报道的抗抑郁药动物实验中的结果一致[22],且“神宁藏香”对于改善失眠大鼠的抑郁状态效果显著。
旷场实验是检测动物情绪行为和在新异环境中的焦虑、紧张情绪,认知、自发活动情况的经典实验。其中大鼠的焦虑状态和认知能力主要通过中央格停留时间表现[23],大鼠的自发活动情况则通过中央格穿格次数、中心穿格数百分比和站立次数反映[24]。本次实验中,失眠模型大鼠的旷场水平运动和垂直运动水平均显著降低,提示由于失眠的影响,大鼠可能出现焦虑抑郁等负面情绪和认知能力下降的情况,且自发活动明显减少,出现了郁郁寡欢、喜静少动等负性情绪。给药干预后结果显示,“神宁藏香”能有效延长模型大鼠中央格停留时间,增加站立次数,表明“神宁藏香”可有效缓解失眠大鼠的负面情绪的,同时在模型大鼠自发活动和空间探索能力方面有促进作用,增强其对空间探索兴趣。
4.2 研究对相关作用靶点的影响
由于中枢神经系统中的大量GABA能神经元与睡眠密切相关,而GABA 能系统通路中GABA 的合成代谢、传导和转运环节发生变化都会间接地影响GABA的含量以及生物功能,进而影响睡眠[25]。Western Blot结果表明,失眠大鼠下丘脑中的GABA 能传导功能出现异常,可能和GABA 的代谢、重摄取、受体亚基结合及其转运蛋白相关:主要用于合成GABA 的GAD-65蛋白表达明显增加,用于传导的NKCC1蛋白表达明显降低;与GABA 降解相关的GABA-T 降低,而GAT-1作为GABA 重摄取的主要转运体,随GABA 含量减少而降低蛋白表达。安神中药、艾司唑仑等传统失眠药物的治疗作用可能与该通路多靶点有关,通过促进合成受体表达、减少GABA 的降解,降低转运蛋白表达,增加GABA 的重摄取,提高GABA 与受体的结合率,发挥GABA的神经抑制作用,从而改善失眠。
另外,本实验选取苯二氮䓬类药物艾司唑仑作为阳性对照药,作为传统治疗失眠的药物,苯二氮卓类其作用靶点在抑制性神经递质GABA,即它与GABA相关受体结合而增多GABA 的释放,从而抑制5-HT的产生和释放[26]通过非选择性拮抗γ-氨基丁酸苯二氮䓬(GABA-BZOA)复合体,起到了神经的抑制性保护作用。“神宁藏香”药效基本等同于阳性对照药,这一结果进一步证实“神宁藏香”和阳性对照药对于模型大鼠失眠的改善作用机制基本一致,其作用靶点主要是促进GABA 合成蛋白GAD-65 的表达和降低转运蛋白NKCC1 的表达,并有减少GABA 的降解蛋白GABA-T,增加其的重摄取蛋白GAT-1表达的趋势。
4.3 优势与不足
香熏疗法在唐宋时期发展到鼎盛阶段,近代逐渐失传。但在西藏地区,因其独特的黏膜吸收途径,直达中枢神经系统而起效迅速,应用、携带方便等诸多优势一直沿用至今。藏医理论认为[27],失眠因“隆”(相当于气或元气)元紊乱、不足或邪气阻滞所致。而藏香中常用药物:松香、沉香、琥珀、藏寇、阿魏等数十种[28],多为辛味药物,辛“能行能散”,具有芳香解郁、行气行血等作用;松香、沉香、丁香、琥珀均有降逆下行之效,有助于引阳入于阴[12];藏红花、藏寇、阿魏有有行气活血,散郁开结的功效,有助于解心忧郁积,醒神益智;“神宁藏香”诸药合用,一方面调节人体气血津液的正常升降出入,气血和而五脏安;另一方面气血循常道而无邪气阻滞,阳入于阴而寤寐如常。“神宁藏香”还可以明显缓解各种原因引起的忧愁抑郁、思虑过度、精神紊乱等症,实为快乐愉悦之香[11]。
本实验是首次使用藏香治疗失眠的动物实验研究,主要研究藏香疗法对于失眠大鼠的治疗效果和神经生物学机制,以期进一步拓宽藏药的应用和推广。但本次研究也存在不足之处,实验中主要采用在规定时间内,整组大鼠在固定规格的房间内集体闻嗅的方法进行,可能不能很好地控制每只大鼠的具体给药量,提示今后可对藏香的剂型进行进一步的改良,如研制藏香熏香剂挥发油制剂,并应用单独雾化吸入的方法,增加藏香有效成分的释放,合理规划鼻腔粘膜给药方式的给药量等,更好地控制和规范实验操作方法,从而增加研究的规范性和可重复性。
5 结论
“神宁藏香”能够有效地延长失眠大鼠的睡眠持续时间,改善失眠所产生的抑郁、紧张等负性情绪,增加其空间探索的兴趣;并且其作用靶点主要是通过促进失眠大鼠下丘脑中GABA 合成蛋白GAD-65 的表达和降低转运蛋白NKCC1的表达而发挥治疗作用,这也为临床中推广使用“神宁藏香”治疗失眠提供了实验依据和理论基础。
