齐墩果酸对大鼠心肌细胞缺氧后生物学功能的影响
2020-04-18姜辉刘涛杨忠路葛玉光都业君
姜辉,刘涛,杨忠路,葛玉光,都业君
(北部战区总医院心血管外科,沈阳 110016)
急性心肌梗死(acute myocardial infarction,AMI)是最常见的心血管疾病,发病率和死亡率都很高[1]。溶栓、经皮冠状动脉腔内成形术和冠状动脉旁路移植术等再灌注治疗被认为是降低AMI死亡率的有效措施。目前,临床上广泛使用静脉注射溶栓药物,但出血等不良反应不容忽视。经皮冠状动脉腔内成形术和冠状动脉旁路移植术可避免介入性血管重建引起的出血,但不能促进心脏再生,也不能避免心肌细胞损伤[2-3]。因此,寻找保护心肌细胞免受缺氧损伤的新的治疗策略具有重要的意义。
齐墩果酸(oleanolic acid,OA)是一种生物活性五环三萜类植物化学物质,常见于橄榄科植物。OA具有多种潜在的药理作用,例如对化学或果糖诱导的肝损伤保护作用以及抗炎、抗糖尿病、抗氧化、抗肿瘤和抗糖苷作用等,且未见合成药剂的常见不良反应[4-5]。还有研究[6]发现,OA对于高糖诱导的心肌损伤具有一定保护作用,但是其具体机制尚不明确。
本研究拟探讨OA对缺氧损伤大鼠心肌细胞H9C2增殖、凋亡和迁移的潜在作用及其可能的机制,旨在为临床上心肌梗死的治疗提供可能的新方法。
1 材料与方法
1.1 材料
大鼠心肌H9C2细胞购自中国科学院细胞库(上海)。OA购自美国Selleck生物科技有限公司,DMEM、胎牛血清、胰蛋白酶购自武汉普诺赛生命科技有限公司,Annexin-PI染液购自上海碧云天生物技术有限公司,MTT购自国药集团化学试剂有限公司,NP-40裂解液购自北京天根生化科技有限公司,MEK抗 体、p-MEK抗 体、Cyclin D1抗 体、bcl-2抗 体、MMP2抗体和GAPDH抗体购自北京博奥森生物技术有限公司。
1.2 方法
1.2.1 细胞培养与缺氧模型构建:将H9C2细胞接种于96孔板中(1×103/孔)。用含10%胎牛血清的DMEM培养基,在37 ℃、5% CO2(95%空气)饱和湿度的培养箱中常规培养H9C2细胞,设为常氧对照组;另在1%O2、5%CO2和94%N2的培养箱中培养H9C2细胞,设为缺氧模型组,每组3个复孔。
1.2.2 药物处理:将OA溶解于0.9%NaCl溶液,制成20 mol/L原液。将H9C2细胞接种于96孔板中(1×103/孔),缺氧孵育12 h后,分别加入0.9%NaCl溶液(对照组)以及不同浓度的OA,药物终浓度为25和50 μmol/L,每组3个复孔。
1.2.3 MTT实验:分别在常氧和缺氧条件下培养0、12、24、36和48 h时,以及药物处理0、12、24、36和48 h时,向96孔板中加入MTT(5 mg/mL),37 ℃ 孵育4 h。弃上清液,加入MTT-甲臜结晶,用酶标仪检测490 nm波长的吸光度。
1.2.4 流式细胞术:不同浓度(终浓度25和50 μmol/L)OA作用细胞24 h后,用胰蛋白酶消化,制成单细胞悬液,加入预冷的70%乙醇固定过夜。800 r/min离心5 min,弃上清,加入50 μL Annexin-PI染色液并充分混匀,37 ℃ 避光染色30 min,用流式细胞仪进行检测分析。
1.2.5 transwell实验:将细胞接种于transwell小室中(1×105/孔),下室加入600 μL含血清培养基,12 h后更换培养基,用不同浓度OA(终浓度为25和50 μmol/L)处理细胞,每组设3个复孔。16 h后,用棉签擦去上层细胞,95%乙醇固定20 min,0.4%台盼蓝染色20 min。200倍显微镜下观察。
1.2.6 Western blotting:用不同浓度OA(终浓度为25和50 μmol/L)处理细胞24 h后,用NP-40制备细胞裂解液。取30 μg蛋白行SDS-PAGE电泳,电转移至PVDF膜,TBST漂洗,5%脱脂奶粉封闭1 h。分别加入一抗(MEK抗体1 ∶800稀释,p-MEK抗体1 ∶800稀释,Cyclin D1抗体1 ∶1 000稀释,bcl-2抗体1 ∶1 000稀释,MMP2抗体1 ∶1 000稀释,内参照GAPDH抗体1 ∶5 000稀释),4 ℃ 孵育过夜。洗膜,加入二抗孵育1 h。采用ECL发光法检测蛋白质的表达水平。
1.3 统计学分析
2 结果
2.1 缺氧对H9C2细胞增殖与迁移的影响
MTT实验结果显示,缺氧模型组H9C2细胞的增殖受到抑制,与常氧对照组比较差异有统计学意义(P< 0.01),见图1、表1。
transwell实验结果显示,与常氧对照组(54.69±6.78)比较,缺氧模型组H9C2细胞的迁移能力(37.45±5.23)受到抑制,差异有统计学意义(P<0.01),见图2。
2.2 不同浓度的OA对缺氧H9C2细胞增殖和凋亡的影响
MTT实验结果显示,与对照组相比,25 μmol/L和50 μmol/L OA可以促进缺氧H9C2细胞的增殖,差异有统计学意义(P< 0.05),见图3、表2。流式细胞术结果显示,OA能够有效阻滞H9C2细胞的凋亡(25 μmol/L和50 μmol/L OA 组分别为8.63%±2.74%和4.28%±1.12%),与对照组(12.72%±1.67%)比较差异有统计学意义(P< 0.05),见图4。transwell实验结果显示,经OA处理的缺氧H9C2细胞的迁移能力增强(25 μmol/L和50 μmol/L OA 组分别为52.41±6.98和61.44±8.02),与对照组(31.16±5.77)比较差异有统计学意义(P< 0.05),见图5。

表1 缺氧对H9C2细胞增殖能力的影响(OD490nm)Fig.1 Effects of hypoxia on the proliferation of H9C2 cells(OD490nm)

图1 缺氧对H9C2细胞增殖的影响(n=3)Fig.1 Effects of hypoxic on the proliferation of H9C2 cells(n=3)
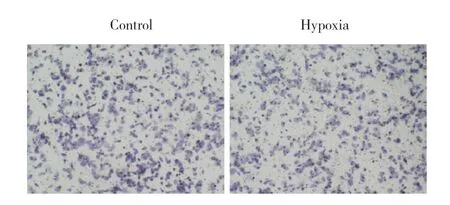
图2 缺氧对H9C2细胞迁移的影响 ×200Fig.2 Effect of hypoxic on H9C2 migration ×200
2.3 OA对缺氧H9C2细胞增殖、凋亡及迁移相关蛋白的影响
Western blotting实验结果显示,OA处理H9C2细胞24 h后,MEK磷酸化水平以及Cyclin D1、bcl-2、MMP2蛋白表达水平明显升高,见图6。
3 讨论
研究[7]表明,OA可以通过减弱高血糖诱导的氧化应激、细胞凋亡和降低缺血再灌注后蛋白酶活性,对大鼠心肌发挥保护作用。本研究观察了OA对缺氧H9C2细胞生物学功能的影响,并进一步探索其作用机制,以期能够为临床上心肌梗死的治疗提供新的可能。

表2 OA对缺氧H9C2细胞增殖能力的影响(OD490nm)Fig.2 Effect of OA on proliferation of hypoxia H9C2 cells(OD490nm)
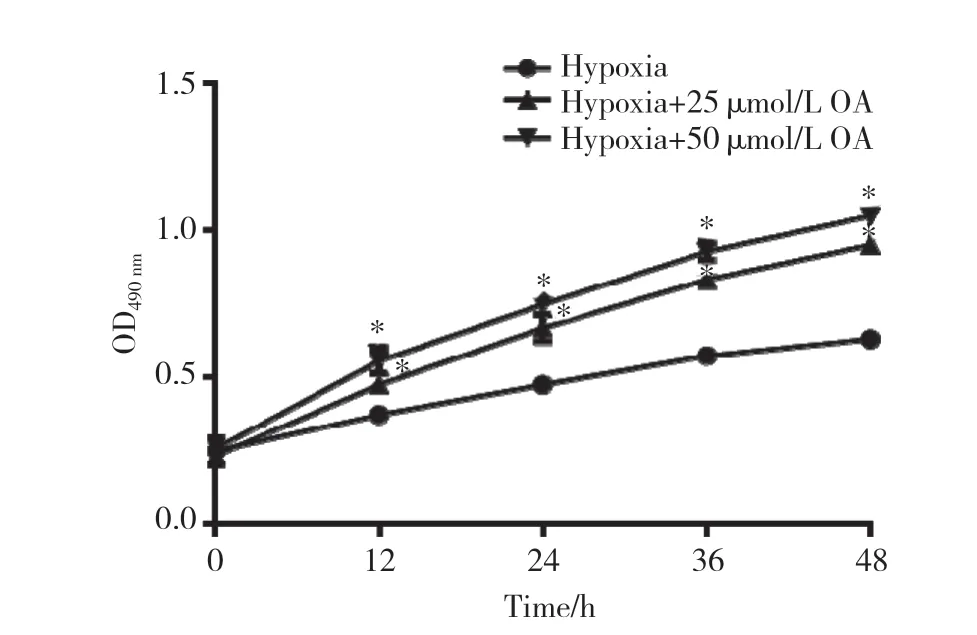
图3 不同浓度OA对H9C2细胞增殖的影响(n=3)Fig.3 Effect of different concentrations of oleanolic acid on H9C2 proliferation(n=3)
心肌梗死的发病机制涉及多种信号通路,其中MEK/ERK和AMPK信号通路在心肌缺血再灌注损伤中起重要作用。其中,MEK/ERK在心肌缺血再灌注应激中的作用目前尚有争议,大多数认为MEK/ERK通路的激活具有心肌保护作用[8],增强MEK/ERK的激活可减少心肌梗死面积[9]。本研究结果表明缺氧能够抑制H9C2细胞的增殖和迁移,与前人的研究结果一致。

图4 不同浓度OA对缺氧H9C2细胞凋亡的作用Fig.4 Effect of different concentrations of oleanolic acid on apoptosis of H9C2 cells after hypoxia

图5 不同浓度OA对缺氧H9C2细胞迁移的作用 ×200Fig.5 Effect of different concentrations of oleanolic acid on migration of H9C2 cells after hypoxia ×200
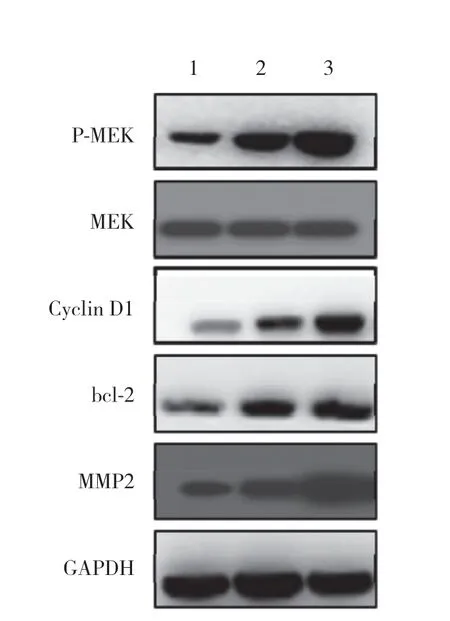
图6 OA对H9C2细胞增殖、凋亡及迁移相关蛋白表达的影响Fig.6 Effect of oleanolic acid on the expression of proteins related to the proliferation,apoptosis,and migration of H9C2 cells
研究[10]表明,OA具有多种药理作用,包括抗氧化、免疫调节、抗纤维化、抗炎和抗癌等。基于这些药理作用,OA已被证明在细胞保护和器官保护方面是有益的。本研究在构建缺氧心肌细胞模型后,用不同浓度的OA处理缺氧的H9C2细胞,结果发现,OA能促进H9C2细胞的增殖,而且这种促进作用具有剂量依赖性。进一步的研究证明,OA还能够抑制缺氧H9C2细胞的凋亡,促进缺氧H9C2细胞的迁移。研究[8]表明,MEK信号通路参与调控缺氧导致的细胞生长和迁移能力下调,其下游的Cyclin D1作为调节细胞周期的重要蛋白,具有促进细胞周期从G1期向S期转化的作用,bcl-2蛋白能够阻止细胞色素c从线粒体释放到细胞质,从而抑制细胞凋亡,MMP2能够通过降解和重塑细胞外基质的动态平衡,发挥调节细胞迁移的作用。本研究通过Western blotting发现OA可促进缺氧H9C2细胞MEK的磷酸化水平,但并不影响总MEK的表达;另外,OA还促进了Cyclin D1、bcl-2和MMP2的表达。因此,推测OA通过以上作用促进缺氧H9C2细胞的增殖和迁移,并抑制其凋亡,进而发挥保护心肌细胞的功能。
综上所述,本研究结果表明,OA能够对缺氧损伤后的大鼠心肌H9C2细胞发挥保护作用,提示OA可能成为临床上治疗心肌梗死的潜在药物。
