急性冠状动脉综合征患者血清血栓调节蛋白和脂蛋白相关磷脂酶A2水平变化及临床意义
2020-04-18马彩云刘祎秀任凤学许振业王韶屏柳景华
马彩云 刘祎秀 任凤学 许振业 王韶屏 柳景华
血栓调节蛋白(thrombomodulin,TM)是Esmon和Owenl于1981年首次确认并于次年从兔肺中分离出的一种膜糖蛋白[1],存在于静脉、动脉和毛细血管内皮细胞表面,是目前认为反应血管内皮损伤较好的指标[2]。脂蛋白相关磷脂酶A2(lipoprotein-associated phospholipase A2,Lp-PLA2)是近年来新发现的炎症标志物,目前研究认为在冠心病发病机制及临床预后中有着重要的意义[3-7]。但两者在急性冠状动脉综合征(acute coronary syndrom,ACS)的变化及其关系的研究尚少有报道。本研究采用酶联免疫吸附法(ELISA)检测冠心病患者血清TM和Lp-PLA2的水平,并结合冠状动脉造影进行相关分析,旨在探讨TM和Lp-PLA2在冠心病发病机制中的作用两者的关系,从而为临床提供可靠依据。
资料与方法
1. 研究对象 本研究共入选2015年7月至2016年10月,首都医科大学附属北京安贞医院心内科住院、年龄35~75岁,并经冠状动脉造影确诊为冠心病患者120例,分为ACS组69例和稳定性心绞痛(stable angina pectoris, SAP)组51例。冠心病患者入选条件为经冠状动脉造影证实至少有1支主要血管狭窄≥50%、且不具备任何一条排除标准的患者。再将120例冠心病患者按病变血管支数分为单支病变组(45例)、双支病变组(38例)和3支病变组(37例)。采用Gensini评分系统[8]评定冠状动脉血管病变狭窄程度,按Gensini积分分为轻度病变组(<26分)36例、中度病变组(26~54分)48例和重度病变组(>54分)36例。另选同期有胸痛症状冠状动脉造影正常的患者20例为对照组。用酶联免疫吸附试验(ELISA)法分别检测血清TM、Lp-PLA2水平。该研究经首都医科大学附属北京安贞医院伦理委员会批准,受试对象均同意参加该项研究,并签署知情同意书。
排除标准:合并严重肝、肾、造血及神经系统等原发性疾病及精神病、恶性肿瘤患者;严重心功能不全(EF<35%),未控制的高血压3级患者,严重瓣膜性心脏病;随机血糖≥13.7 mmol/L的糖尿病患者或HbAlc≥9.5%;合并甲状腺功能异常的甲状腺疾病;凝血功能异常的血液系统疾病以及肝硬化、肾功能不全(失代偿期)等;严重的细菌、病毒以及真菌感染性疾病;拒绝签署知情同意书,或估计依从性较差、随访可能性差者;妊娠或哺乳期妇女;参加临床药物试验者。
2. 观察方法 所有患者入院后处理均按入院常规治疗进行, 入院次晨空腹肘静脉取血,3 d内行冠状动脉造影检查。(1) 一般临床资料:包括年龄、性别、血压、空腹血糖、血脂、心电图以及肝、肾功能等。(2) 冠状动脉脉造影:所有患者于入院3 d内行冠状动脉造影检查,进行冠状动脉狭窄程度的评分(Gensini评分)。狭窄程度用定量冠状动脉动脉造影分析方法(quantitative coronary angiography,QCA)法,狭窄直径<25%计1分,25%~50%计2分,50%~75%计4分,75%~90%计8分,90%~99%计16分,100%计32分。冠状动脉各段所占系数:左主干记5分,前降支近、中、远段分别记2.5、1.5、1分,第一、二对角支分别记1、0.5分,回旋支近、远段分别记2.5、1分,钝缘支记1分;右冠近、中、远段,后降支、左室后支各记1分。将各段系数与之相对应的狭窄程度的计分相乘,然后将各狭窄段总积分相加即为该患者的冠状动脉狭窄程度的Gensini评分。 (3) 检测方法:所有入组患者于入院后第二天清晨抽空腹静脉血5 mL, 静脉血经3 000 r/min离心10 min后,留取上层血清,冻存-80℃低温冰箱备用。Lp-PLA2测定试剂盒由美国RND Systems公司提供,TM测定试剂盒由美国Quidel公司提供,酶标仪为美国MD-SpectraMax M2多功能酶标仪,以上指标均采用ELISA法,操作严格按照试剂盒说明进行。

表1 各组冠心病患者临床资料比较
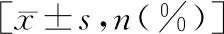
表2 不同病变支数各组临床资料比较
3.统计学方法 应用SPSS 17.0软件包对数据进行统计学分析。计量资料以均数±标准差表示,采用单因素方差分析,组间两两比较采用q检验,如方差不齐则进行非参数分析(Kruskal-Wallis H检验);计数资料以频数及百分率表示,比较采用χ2检验。采用Spearman 相关分析。以P<0.05为差异有统计学意义。
结 果
1.各组患者基本临床资料的比较 对照组、SAP组、ACS组在年龄、性别、高血压病史、吸烟史、入院血压、FBS、TG、TC、HDL-C、LDL-C等比较,差异无统计学意义。对照组、单支病变组、双支病变组和3支病变组上述指标比较,差异无统计学意义。对照组、轻度病变组、中度病变组和重度病变组上述指标比较,亦差异无统计学意义,见表1~3。
2. 各组患者TM、LP-PLA2的比较 与对照组比较,SAP组、ACS组血清TM、Lp-PLA2水平均明显升高(P均<0.05),与SAP组比较,ACS组血清TM、Lp-PLA2均明显升高(P均<0.05)。单支病变组、双支病变组、3支病变组血清TM、Lp-PLA2均差异无统计学意义(P均>0.05)。重度病变组血清TM水平明显高于中度度病变组和轻度病变组(P均<0.05)。轻度病变组、中度病变组和重度病变组血清Lp-PLA2均差异无统计学意义(P>0.05),见表4~6。
3.各组患者血清TM和Lp-PLA2的相关性分析 非参数Spearman相关分析显示:ACS组患者血清TM和Lp-PLA2间呈正相关(r=0.012,P<0.05)。 而SAP组和对照组与两者无相关(r=0.035,P>0.05)。

表3 各组不同Gensini 积分临床资料比较
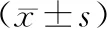
表4 各组血清TM及Lp-PLA2水平比较
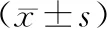
表5 各组不同病变血管数TM及Lp-PLA2水平比较
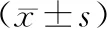
表6 各组不同Gensini积分血清炎症因子水平比较
讨 论
TM跨膜存在于内皮细胞表面,为蛋白C活化系统的重要辅助因子,在调控血栓形成及溶解中发挥重要作用。在正常情况下,TM对血管内皮细胞具有保护作用,与凝血酶结合后能产生大量的活化型蛋白C保护血管,抑制凝血、炎症和内皮细胞凋亡的发生。当各种不同原因造成内皮细胞损伤时,TM可释放到血液中,监测血浆TM可反应内皮细胞的受损情况。近年研究表明,急性冠状动脉综合征的发生、形成和消退与血栓、凝血酶系统密切相关,而蛋白C抗凝系统在调控血栓形成剂溶解中发挥重要作用,TM作为其中的一员也越来越受到人们的关注,是内皮损伤的金标准[8]。ACS的病理基础是冠状动脉粥样硬化裂纹、破裂的斑块表面或斑块内部血栓形成,从而引起冠状动脉完全闭塞或不全闭塞,血管内皮失去完整性。有研究表明ACS患者血浆TM水平明显高于对照组[9]。另有学者研究发现,冠心病患者病变血管越多,其血浆TM浓度越高[10]。本研究结果显示,ACS组血清TM水平明显高于SAP组及对照组,SAP组明显高于对照组,说明ACS患者内皮损伤显著。同时也证实血管内皮细胞受损参与冠心病的发病过程,其不仅是冠状动脉粥样硬化发生的始动因素,也是ACS患者病情进展的关键环节。这与既往的研究一致。
另外,我们的研究发现,血清TM水平在单支病变组、双支病变组、3支病变组均差异无统计学意义。说明单纯用病变支数并不能间接反映动脉粥样硬化内皮损伤的范围和程度。为此我们采用了更精确的Gensini评分系统对每条冠状动脉及其主要分支血管病变狭窄程度进行定量评定。 结果表明重度病变组血清TM水平明显高于中度型和轻度病变组。说明血清中TM水平在一定程度上可以反映冠状动脉粥样硬化病变的范围和程度。
Lp-PLA2是近年国内外研究较热门的血管内皮炎症标志物之一。人血浆Lp-PLA2 主要由巨噬细胞分泌,也可以由内皮细胞,平滑肌细胞分泌,并接受炎症介质的调节。目前研究发现,Lp-PLA2在动脉硬化的形成和发展中起着推动作用,能够增加斑块的不稳定性,是动脉粥样硬化的一种新的炎性反应标志物。而且,Lp-PLA2不易受BMI、血压、感染、糖尿病、风湿类疾病等全身因素的影响,与CRP、IL-6、TNF-α等传统的炎症标志物相比,相对比较特异,显示出与心血管疾病更密切的关系。Lp-PLA2反映斑块炎症程度,评价冠状动脉病变的活动性[4];可预测冠状动脉事件或其他不良心血管事件[5];可判定冠状动脉病变严重程度,可识别高危患者并进行危险分层[11]。本结果显示,ACS组血清Lp-PLA2水平明显高于SAP组及对照组,SAP组明显高于对照组,说明ACS患者血管内皮存在更为强烈的炎症反应。另外,既往有研究表明[12]:Lp-PLA2 的水平与冠状动脉的病变支数有着密切关系,可以在一定程度上反应冠状动脉的狭窄程度。随着冠状动脉病变的支数增加,Lp-PLA2 水平及 Gensini积分呈现逐步升高趋势,3支与单支病变差异有统计学意义。 而我们的研究发现,血清Lp-PLA2水平在单支病变组、双支病变组、3支病变组,均差异无统计学意义,在轻度病变组、中度病变组和重度病变组,均差异无统计学意义。这与既往的研究有所不同。其中的差异需要进一步验证,本研究的病例数较少,体内影响Lp-PLA2 水平的因素较多,仍需大规模的临床研究来证实。
本研究结果显示,ACS患者血清TM和Lp-PLA2间有正相关关系,而SAP组和对照组与血清TM和Lp-PLA2间无明显相关性,提示ACS发病过程中内皮功能损伤与炎性反应损伤可能相互作用、相互影响。研究提示,炎症与免疫反应在动脉粥样硬化的发生、发展中起重要作用,炎症反应的激活及血管内皮功能可能是导致斑块不稳定的主要因素[13],炎性反应损伤及血管内皮损伤与ACS发病有密切的关系。本研究的结果在一定程度上验证了这一学说。ACS时动脉粥样斑块破裂、表面破损或出现裂纹、继而出血和血栓形成引起冠状动脉不完全或完全性阻塞,使血清TM及Lp-PLA2水平进一步升高,标志着内皮损伤进一步加重。这样就在内皮受损和血栓形成之间形成互为加重的恶性循环。
总之,本研究发现,内皮功能损伤与炎性反应参与了ACS的发病过程,并且两者可能相互促进、相互影响。
