化香果提取物体外抑菌活性研究
2020-04-17汪咏梅张亮亮胡新宇
徐 曼, 汪咏梅, 张亮亮, 胡新宇
(中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业和草原局林产化学工程重点实验室;江苏省生物质能源与材料重点实验室,江苏省林业资源高效加工利用协同创新中心, 江苏 南京210042)
近年来,我国水产养殖行业高速发展,对养殖饲料产生巨大需求。20世纪90年代,渔业生产严重依赖人工合成药品,如抗生素、抗菌药、抗球虫药和抗寄生虫药等。大量使用抗生素导致的耐药性以及药物残留对人和动物的毒副作用引起了消费者和政府部门的关注和忧虑[1]。养殖饲料中抗生素产品的连续和无序使用还将导致耐药菌株的快速出现以及将来无药物使用的尴尬局面[2]。所以在当前状况下,寻找具有相同功效,但是安全、纯天然的植物源饲料添加剂受到科研工作者的重视。
化香树(PlatycaryastrobilaceaSieb. et Zucc.)属于胡桃科植物,广泛分布于我国西北、华东、华中、华南等地。化香树在我国民间的应用广且历史悠久,树叶捣烂加水过滤出的汁液可用做农药,用来防治棉蚜、红蜘蛛、甘薯金花虫、菜青虫、地老虎等。树叶还可供药用,能顺气、祛风、化痰、止痛、燥湿、杀虫[3-4]。化香果提取物来源于化香树果序,属于天然产物,其中含有植物多酚、黄酮、鞣花酸、维生素等生物活性物质[5-6]。嗜水气单胞菌(Aeromonashydrophila)、豚鼠气单胞菌(Aeromonascaviae)、温和气单胞菌(Aeromonassobria)、维氏气单胞菌(Aeromonasveronii)、迟钝爱德华菌(Edwardsiellatarda)等广泛存在于各种水体生态系统中,比如淡水、沿海水域以及污水中[7]。有的细菌不仅是严重危害水产动物的致病菌,也是一种人、鱼共患病原菌,对养殖业的危害很大,也会对人类健康造成威胁[8]。研究人员对化香果资源进行了一系列的研究,发现化香果提取物具有特殊的生物学和药理学活性,以及良好的抗氧化性[9-11],同时也有研究表明化香树及果序提取物对引起鼻炎和鼻窦炎等的致病菌可以起到抑制作用,还对抑制细胞毒性、预防癌症和抗衰老有一定功效[12-13],以及化香果提取物对水青石斑鱼具有一定的促生长功效[14]。因此,本研究对化香果提取物的抑菌性能进行研究,测定了化香果提取物对水产动物几种常见致病菌的最小抑菌浓度(MIC),并且对化香果提取物的小鼠经口毒性进行测定,以期为化香果提取物作为水产饲料添加剂的应用提供前期理论依据。
1 实 验
1.1 材料与仪器
化香果提取物粉末,多酚质量分数72.0%,实验室用水提取制备得到[10]。嗜水气单胞菌(A.hydrophila)、温和气单胞菌(A.sobria)、豚鼠气单胞菌(A.caviae)、维氏气单胞菌(A.veronii)、迟钝爱德华菌(E.tarda)、副溶血弧菌(V.parahaemolyticus)、鼠疫耶尔森氏菌(Y.pestis)、大肠杆菌(E.coli)、金黄色葡萄球菌(S.aureus),由集美大学水产学院提供。营养肉汤培养基(MHB),青岛高科园海博生物技术有限公司;氟苯尼考,上海联迈生物工程有限公司。
无特定病原体级实验动物(SPF级)健康ICR小鼠40只,雌雄各半,体质量18.2~22.0 g,由北京维通利华实验动物技术有限公司南京分公司提供。
SYNERGY H1多功能酶标仪,美国BioTek公司;BE204E分析天平,梅特勒-托利多公司;SHP-250型生化培养箱,上海精宏实验设备有限公司;PYX-280S-B型生化培养箱,科力实验仪器有限公司;高压蒸气灭菌锅,日本Hirayama公司; MILLI-Q纯水系统,上海摩速科学器材有限公司;超净工作台,上海博讯实业有限公司。
1.2 抑菌活性试验
1.2.1细菌基本培养基的配制 称取MHB培养基21.0 g溶于1 000 mL蒸馏水中,混匀,过滤,将过滤后的培养基分装于试管内,121 ℃灭菌30 min后,备用。
1.2.2药液配置 用超纯水溶解化香果提取物至饱和状态(质量浓度为18.0 g/L),作为样品母液,采用二倍稀释法,根据实验进行倍比稀释,所得药物质量浓度分别为18.00、 9.00、 4.50、 2.25、 1.13、 0.56、 0.28、 0.14和0.07 g/L。
1.2.3最小抑菌浓度(MIC)的测定 在大部分近似球形的细菌的最大吸收波长600 nm下,形状规则的细菌菌液浓度和吸光度呈线性关系,所以测定大多数细菌时,通常会选择测定波长600 nm下的菌液的吸光度,结合平板计数结果绘制出标准曲线,可以快速地根据吸光度计算菌液浓度。将9种受试菌株的单菌落用MHB培养基培养到对数生长期,用多功能酶标仪测定菌液吸光度(OD600),根据所需的菌液浓度通过公式反推出适合的吸光度,再根据所需吸光度对菌液进行稀释,将受试菌株用无菌生理盐水调至合适的菌浓度。
以一株细菌为例。取无菌试管11支,编号1~11,每一试管中各加入配置好的MHB培养基1.0 mL,1~9号试管中分别加入质量浓度依次为18.00、 9.00、 4.50、 2.25、 1.13、 0.56、 0.28、 0.14、 0.07 g/L的化香果提取物溶液,每管药液量100 μL;10号试管以无菌生理盐水替代药液,为阴性对照;11号试管以抗生素(氟苯尼考质量浓度为0.1 g/L)替代药液,为阳性对照。而后,在每一试管中分别加入菌悬液100 μL。加样后,于28 ℃培养(其中大肠杆菌和金黄色葡萄球菌培养温度为37 ℃)。24 h后观察各管情况:阴性对照试管中培养液应呈浑浊状,表明细菌得以生长,阳性对照试管中培养液应为澄清、透明状,表明细菌不生长;此时,再观察其他的试管内培养液的情况,若呈浑浊,表明细菌的生长不被抑制;若为澄清、透明,则表示细菌被杀死或细菌生长被抑制。以细菌不生长时,药物的最低稀释质量浓度为该药物对该菌的最小抑菌浓度。若阴性和阳性对照试管中培养液出现与预期结果不同的状况,结果无效。如若无效则重新培养菌种重做实验。
1.2.4抑菌率测定 在96孔板中加样,同列添加的药物质量浓度相同,同行添加的菌株相同,第一块孔板添加质量浓度18.00、 9.00和4.50 g/L的样品,第二块孔板样品质量浓度为2.25、 1.13和0.56 g/L,第三块孔板样品质量浓度为0.28、 0.14和0.07 g/L,每种质量浓度对某种菌株的样本均进行一次重复。同时每种菌株设一个阴性对照和阳性对照(氟苯尼考)。每孔添加的药物和菌液均为100 μL。加样后,将细胞培养板放入多功能酶标仪中培养,嗜水气单胞菌、温和气单胞菌、豚鼠气单胞菌、维氏气单胞菌、迟钝爱德华菌、副溶血弧菌、鼠疫耶尔森氏菌于28 ℃培养,大肠杆菌和金黄色葡萄球菌的孔板于37 ℃培养,每隔2 h测一次OD600,24 h后结束。根据测定的OD600数值考察是否与1.2.3节中试管实验的观察结果相同。将培养24 h的试验菌液进行倍比梯度稀释,分别稀释至原体积的2倍和4倍,通过平板计数读出每个质量浓度的药液对应的菌落值。采用下式计算不同质量浓度化香果提取物的抑菌率。
抑菌率=(阴性对照菌数-实验组的菌数)/阴性对照菌数×100%
1.3 小鼠经口毒性检验
根据GB 15193.3—2014《食品安全国家标准 急性经口毒性试验》的要求,采用霍恩氏法进行试验。分别称取化香果提取物粉末样品2 150、 4 640、 10 000、 21 500 mg,对应加入20、 20、 30、 60 mL纯净水,充分混匀配制成溶液。将40只SPF级健康ICR小鼠分雌雄随机分入2 150、 4 640、 10 000、 21 500 mg/kg体质量4个剂量组,每组5只。动物禁食6 h,饮水不限。最高剂量组受试物经口2次灌胃,间隔时间4 h,灌胃容量每次约为30 mL/kg体质量,其余剂量组受试物经口1次灌胃,2 150、 4 640 mg/kg 体质量剂量组灌胃容量约为20 mL/kg 体质量,10 000 mg/kg体质量剂量组灌胃容量约为30 mL/kg体质量。染毒后2 h给食。观察期14 d,每天观察并详细记录动物的中毒表现、死亡数和死亡时间。中毒死亡的和人道处死的动物,立即进行解剖检查。
2 结果与分析
2.1 不同菌株菌悬液的吸光度值与活菌数间的关系
将培养约16 h的细菌培养物(处于对数生长期状态)制成菌悬液,测其吸光度OD600,结合平板计数结果绘制出标准曲线,以便快速地根据吸光度计算相应的菌液浓度。本实验所选择的9种细菌的起始吸光度OD600约为0.28,其相应的活菌浓度分别为嗜水气单胞菌4.0×108CFU/mL、温和气单胞菌7.0×108CFU/mL、豚鼠气单胞菌5.0×108CFU/mL、维氏气单胞菌5.0×108CFU/mL、迟钝爱德华氏菌4.0×108CFU/mL、大肠杆菌4.6×108CFU/mL、金黄色葡萄球菌6.2×108CFU/mL、副溶血弧菌5.0×108CFU/mL、鼠疫耶尔森氏菌5.2×108CFU/mL。
2.2 化香果提取物对9种细菌的最小抑菌浓度
共设置9个质量浓度梯度,以测定化香果提取物对供试菌株的最小抑菌浓度,结果见表1。由表1可知,化香果提取物对9种供试菌株都具有抑制作用。对于供试的9种细菌,在化香果提取物质量浓度为2.25、 1.13、 0.56、 0.28、 0.14、 0.07 g/L的试管中培养液均呈浑浊,表明有细菌的生长;在质量浓度4.50、 9.00、 18.00 g/L的试管内培养液澄清、透明,表示细菌被杀死或细菌生长被抑制,即无菌生长。同时阴性对照管中细菌生长,呈均匀浑浊状;阳性对照管无细菌生长呈透明状。通过对各样品质量浓度的培养液的OD600值考察,发现样品质量浓度18.00、 9.00、 4.50 g/L的培养液的OD600值与初始值几乎无变化,说明抑菌率达到100%,在2.25 g/L的样品中培养24 h后培养液的OD600值比初始值大,说明有细菌生长。因此,无细菌生长的药物最低质量浓度为4.50 g/L,即化香果提取物对9种供试菌的最小抑菌浓度为4.50 g/L。
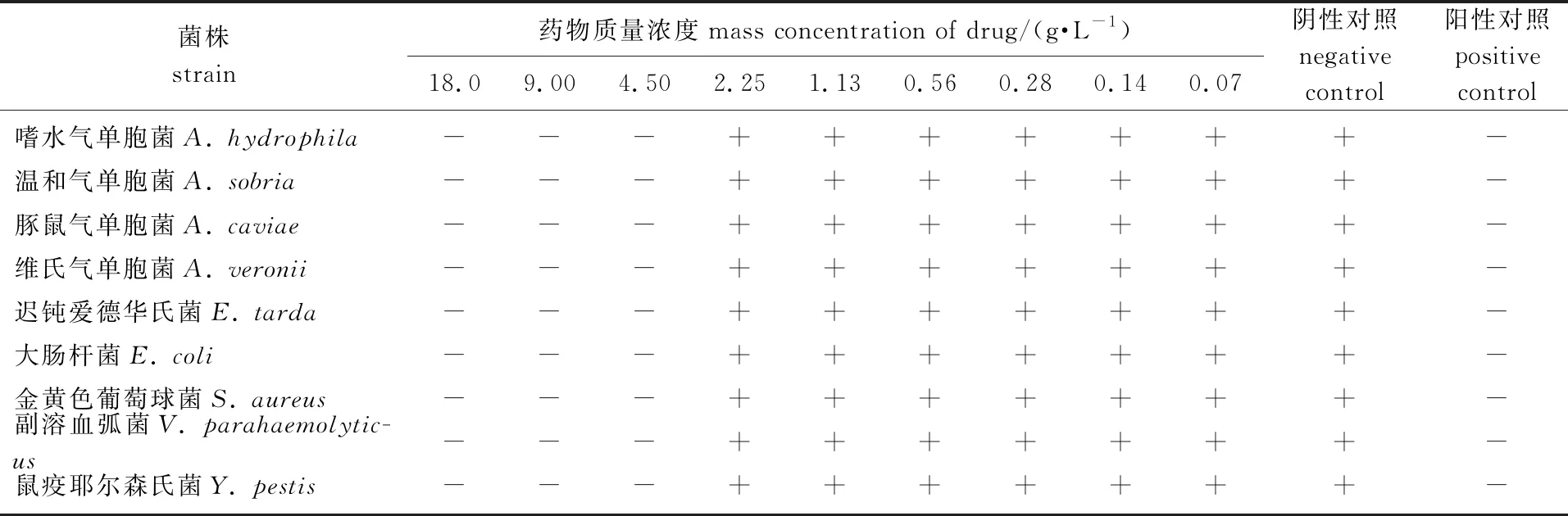
表1 化香果提取物对9种菌株的最小抑菌浓度1)
1)+:有菌生长means turbidness with colonial growth;-:无菌生长means limpidity with no colonial growth
2.3 化香果提取物抑菌活性的浓度效应
表2为不同质量浓度化香果提取物对不同细菌的抑菌率。
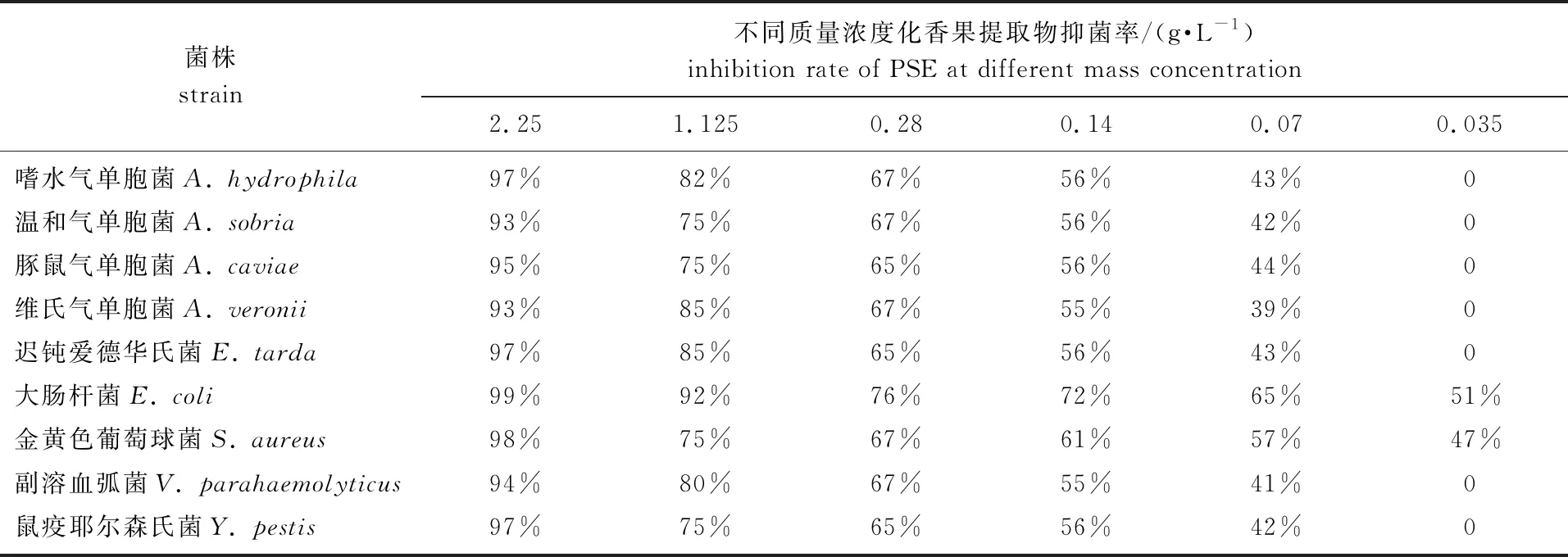
表2 不同质量浓度化香果提取物的抑菌率
依据表2对化香果提取物质量浓度和抑菌率进行相关性分析,发现化香果提取物对9种供试菌株的抑制作用都是随着提取物质量浓度的增加而增强,为进一步探究两者关系,将得到的抑菌率与样品质量浓度进行回归分析,结果见图1。由图1可知,化香果提取物对9种供试菌株的抑制作用与提取物质量浓度呈对数式增长模式,对不同细菌的抑制效果有所不同,由图1中各方程可以计算出化香果提取物对副溶血弧菌、嗜水气单胞菌、迟钝爱德华氏菌、鼠疫耶尔森氏菌、豚鼠气单胞菌、温和气单胞菌、维氏气单胞菌、大肠杆菌、金黄色葡萄球菌的IC50值分别为0.106、 0.102、 0.099、 0.099、 0.072、 0.072、 0.072、 0.035、 0.053 g/L, IC50值越小,表示样品的抑菌活性越高,化香果提取物对大肠杆菌和金黄色葡萄球菌的抑制作用显著高于对其他7种细菌的抑制作用。
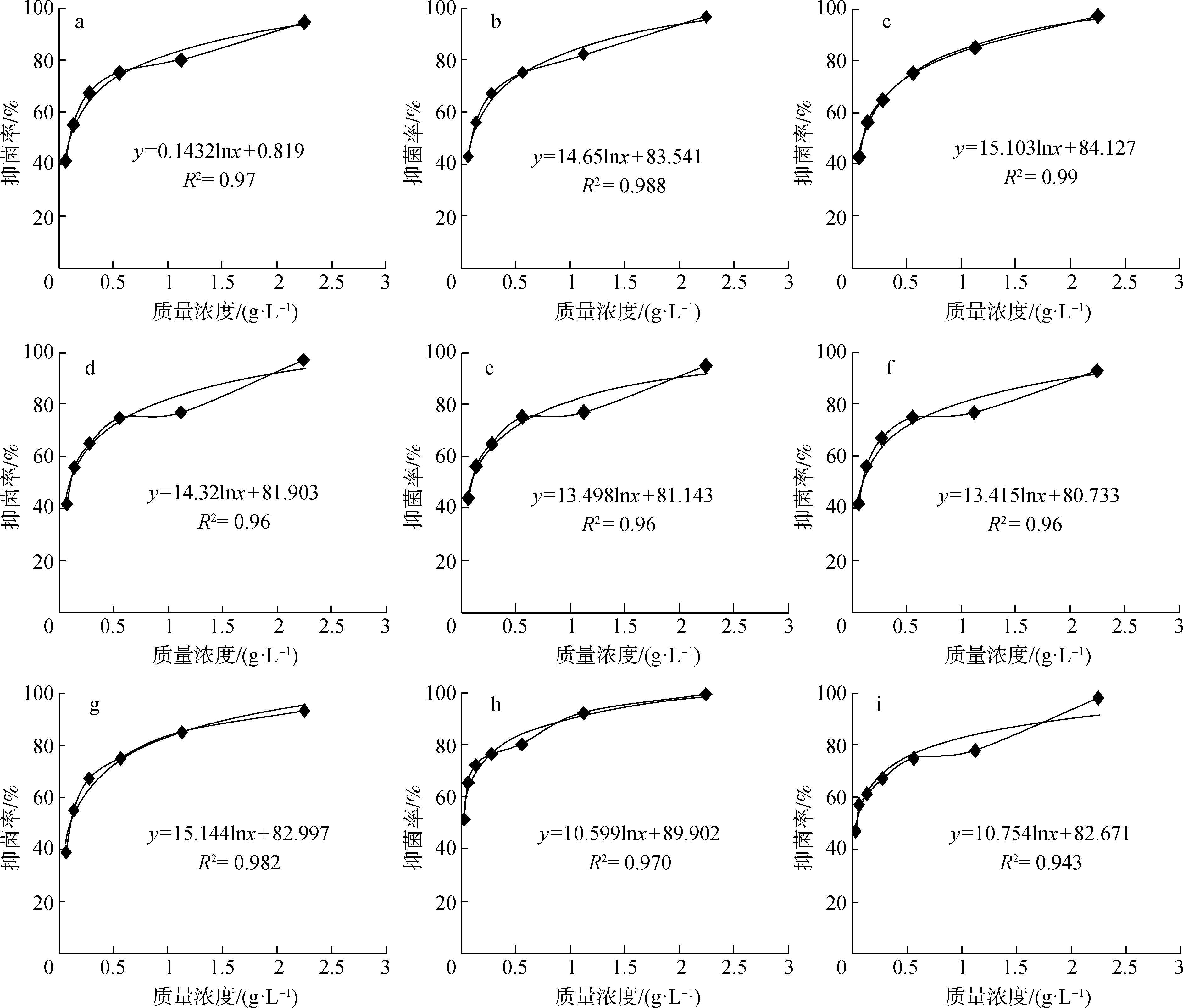
a.副溶血弧菌V.parahaemolyticus; b.嗜水气单胞菌A.hydrophila; c.迟钝爱德华氏菌E.tarda;
2.4 小鼠经口毒性试验结果
小鼠灌胃后约6 h,出现依剂量的精神萎靡、俯卧不动等中毒表现,约7 h开始出现死亡,全部中毒死亡发生在4 d内,具体结果见表3。

表3 小鼠死亡数及LD50值(95%可信限)
由表3可知,雌性小鼠4 640 mg/kg体质量剂量组有2只出现中毒表现,10 000、 21 500 mg/kg体质量剂量组中5只都出现中毒表现。雄性小鼠 21 500 mg/kg体质量剂量组中5只都出现中毒表现,各剂量组其余的存活小鼠5 d后逐渐恢复。中毒死亡和人道处死动物解剖未见明显异常。通过GB 15193.3—2014《食品安全国家标准 急性经口毒性试验》中的附表霍恩氏法急性经口半数致死量(LD50)值计算表4,可以查出化香果提取物对雌雄小鼠LD50值分别为5 010(3 440~7 300)和7 940(5 840~10 800) mg/kg体质量,根据LD50值剂量分级表规定,小鼠口服LD50值大于5 000 mg/kg体质量即为实际无毒级,所以化香果提取物属于实际无毒级。
3 结 论
3.1研究了化香果提取物对嗜水气单胞菌、温和气单胞菌、豚鼠气单胞菌、维氏气单胞菌、迟钝爱德华菌、副溶血弧菌、鼠疫耶尔森氏菌、大肠杆菌、金黄色葡萄球菌的抑菌效果,结果表明化香果提取物对供试9种细菌均表现出抑制作用,抑菌效果随质量浓度的增加而增强,对9种供试菌的最小抑菌浓度为4.50 g/L。化香果提取物对大肠杆菌的抑制能力最强,IC50值为0.035 g/L;其次为金黄色葡萄球菌,IC50值为0.053 g/L。化香果提取物具有良好的抑菌活性。
3.2通过小鼠经口毒性实验可以得出化香果提取物对雌雄小鼠急性经口半数致死量LD50值(95%可信限)分别为5 010(3 440~7 300)和7 940(5 840~10 800)mg/kg体质量,说明化香果提取物属于实际无毒级,可以作为水产动物饲料添加剂开展进一步的安全性检测和应用试验。
