上海地区草莓枯萎病病菌的鉴定及对4类杀菌剂的敏感性
2020-04-16许媛成玮颜伟中肖婷王建华吉沐祥杨敬辉
许媛 成玮 颜伟中 肖婷 王建华 吉沐祥 杨敬辉


摘要:为阐明上海地区草莓枯萎病病原菌分类地位及对药剂的敏感性。运用真菌形态学和分子生物学分类方法,对上海地区不同草莓种植区分离得到的34株病原菌进行鉴定,并采用菌丝生长速率法测定了病原菌群体对4种不同作用机制杀菌剂的敏感性。结果表明,34株病原菌均鉴定为尖孢镰刀菌(Fusarium oxysporum),病原菌群体对多菌灵、咪鲜胺、戊唑醇和吡唑醚菌酯的抑制中浓度(EC50)范围分别为0.302 7~0.556 2、0.001 1~0.148 2、0.036 1~0.299 7、0.036 8~1.721 6 mg/L。病原菌群体对多菌灵和戊唑醇的EC50比值分别为1.8、8.3,而对咪鲜胺和吡唑醚菌酯的EC50比值分别达134.7、46.8。上海市域范围内不同地区间的尖孢镰刀菌对同种杀菌剂的敏感性之间无显著性差异,对4类不同作用机制杀菌剂之间的敏感性也无显著相关性(P>0.05)。本研究结果明确了上海地区草莓枯萎病病原菌的分类地位,可以为合理选用杀菌剂防治病害及病原菌抗药监测提供参考。
关键词:草莓枯萎病病菌;病原菌鉴定;多菌灵;戊唑醇;咪鲜胺;吡唑醚菌酯;敏感性
中图分类号: S436.68+ 4文献标志码: A
文章编号:1002-1302(2020)04-0115-06
收稿日期:2018-12-26
基金项目:江苏省第五期“333”工程培养基金(编号:BRA2017149);上海市农业委员会示范推广计划[编号:沪农推字(2015)第2-7号];江苏省农业工程[编号:SXGC(2017)214]。
作者简介:许 媛(1991—),女,江苏兴化人,硕士,助理研究员,主要从事植病生防和化保方面的研究。Tel:(0511)80978081;E-mail:xyyuan007@163.com。
通信作者:杨敬辉,博士,研究员,主要从事农作物病害防控方面的研究。Tel:(0511)80978081;E-mail:yjhnn32@126.com。
上海地区草莓种植面积约为2 000 hm2,主要分布在嘉定、青浦、金山和浦东等地区。近几年,在上海地区部分大棚草莓移栽初期土传病害危害严重,尤其以枯(黄)萎病为盛。发病植株地上部分新生心叶呈黄绿色、不对称,呈大小叶状,地下根呈黑褐色,严重时整株枯死,对大棚草莓的产量和品质造成了极大的影响。由于该病田间危害症状与黄萎病极其相似,仅从田间表现形态上难以准确区分。因此,本研究对从上海地区草莓主产区显枯(黄)症草莓植株上分离得到病原菌群体进行鉴定,并检测病原菌群体对4种不同作用机制杀菌剂的敏感性,旨在为探明上海地区草莓枯萎病病原菌群体的分类地位,明确病原菌群体对不同作用机制杀菌剂的敏感性现状,以及为科学防控和抗藥性监测提供参考。
1 材料与方法
1.1 供试培养基
马铃薯琼脂培养基(potato dextrose agar,简称PDA),用于病原菌的分离、保存、鉴定和药剂敏感性测定。
1.2 菌株采集与分离
于2016年9月草莓移栽初期,从上海市嘉定区、青浦区和金山区大棚草莓园内采集初发病症的新鲜草莓根部组织,洗净并用乙醇表面消毒后,采用常规的组织分离方法[1],每个大棚分离3~5株,经单孢纯化后共得到34株菌株,将各菌株编号并保存于PDA斜面上,置4 ℃冰箱保存备用。
1.3 供试药剂
97.09%多菌灵原药,由上海升联化工有限公司提供;95.2%咪鲜胺,由江苏辉丰农化股份有限公司提供;95%戊唑醇,由江苏盐城利民农化有限公司提供;95%吡唑醚菌酯,由德国巴斯夫股份(中国)有限公司提供。多菌灵用0.1 mol/L盐酸溶解,其余原药均用丙酮溶解,各药剂均配制成10 000 mg/L的母液。99%水杨肟酸(salicylhydroxamic acid,简称SHAM),购自Sigma-Aldrich公司,用甲醇配制成20 000 mg/L 的母液。所有母液均置于4 ℃保存备用。
1.4 病原菌形态观察
将经单孢分离得到的菌株移置于PDA培养基上,置于25 ℃黑暗条件下培养,并观察其菌落形态、颜色、质地等特征。
1.5 病原菌的致病性测定
1.5.1 病原菌分生孢子液的制备
沿病原菌(25 ℃、PDA上培养5 d)边缘打取直径为4 mm的菌饼,每个菌株分别挑取4块菌饼置于装有80 mL 马铃薯液体培养液的体积为250 mL的三角瓶中,每个病原菌接种1个三角瓶,置于25 ℃、120 r/min 条件下振荡培养5 d,培养液经双层无菌纱布过滤后,于显微镜下用血球计数板计数,并用无菌水稀释菌液分生孢子浓度至1×105~3×105个/mL,每个病原菌保留100 mL稀释好的孢子悬浮液,置于4 ℃冰箱备用。
1.5.2 病原菌的接种方法
取红颊草莓幼苗,洗净根部,将苗浸于上述(“1.5.1”节)孢子液中30 s 后移栽于装有灭菌基质与田土混合(体积比为2 ∶8)的草莓苗钵中,每个菌株接种3株草莓苗,以无菌水浸根草莓苗作对照,苗钵置于草莓大棚内培养,21 d后调查发病情况。取样接种发病的草莓根部组织,参照柯赫氏法则进行病原菌的再分离。
1.6 rDNA-ITS基因部分序列的测定
1.6.1 基因组DNA的提取
在PDA平板上新鲜生长的分离菌边缘处打取直径为4 mm的菌块,接种于置有灭菌玻璃纸的PDA平板上,25 ℃暗培养72 h。将玻璃纸上的新鲜菌丝刮下置于1.5 mL离心管中,于65 ℃烘箱中烘干,用镊子捣碎备用。真菌基因组的提取参照OMEGA真菌基因组提取试剂盒说明书进行。
1.6.2 PCR扩增及生物信息学分析
rDNA-ITS引物采用真菌rDNA-ITS序列的通用引物[2]:ITS1/ITS4(5′-TCCGTAGGTGAACCTGCGG/TCCTCCGCTTATTGATATGC-3′),预期扩增长度为570 bp。PCR反应程序:95 ℃预变性4 min;94 ℃变性 40 s,55 ℃退火40 s,72 ℃延伸1 min,共进行40个循环;最后72 ℃延伸10 min;取5 μL扩增产物,经1%琼脂糖凝胶电泳检测后送至南京金斯瑞生物科技有限公司进行纯化和测序。将所得序列用BLAST搜索软件在NCBI数据库中进行同源性搜索比对分析。
1.7 草莓枯萎病病菌對4种杀菌剂的敏感性测定
采用菌丝生长速率法[3],将保留的供试菌种移植到PDA平板中,25 ℃活化96 h,然后在菌落边缘用打孔器制取直径为4 mm的菌块,移到含系列梯度药剂浓度PDA平板正中央。多菌灵系列浓度为0.05、0.10、0.20、0.40、0.80、1.60、3.20 mg/L;咪鲜胺系列浓度为0.005、0.010、0.020、0.040、0.080、0.160、0.320 mg/L;戊唑醇系列浓度为0.05、0.10、0.20、0.40、0.80、1.60、3.20 mg/L;吡唑醚菌酯系列浓度为:0.625、1.250、2.500、5.000、10.000、20.000 mg/L,吡唑醚菌酯测定时所有平板中都含100 mg/L SHAM。采用无菌水作对照,每个处理重复3次。25 ℃培养72 h后用十字交叉法测量各处理的菌落直径(cm),计算各处理的菌落直径平均值,并按照下列公式计算菌丝生长平均抑制率:菌丝生长平均抑制率=[(对照菌落直径均值-处理菌落直径均值)/(对照菌落直径均值-接种菌饼直径)]×100%。利用DPS软件,通过浓度对数值(x)与抑制率概率值(y)之间的线性回归关系,求出毒力回归方程和有效抑制中浓度(EC50)。
2 结果与分析
2.1 病害症状及病原菌培养性状观察
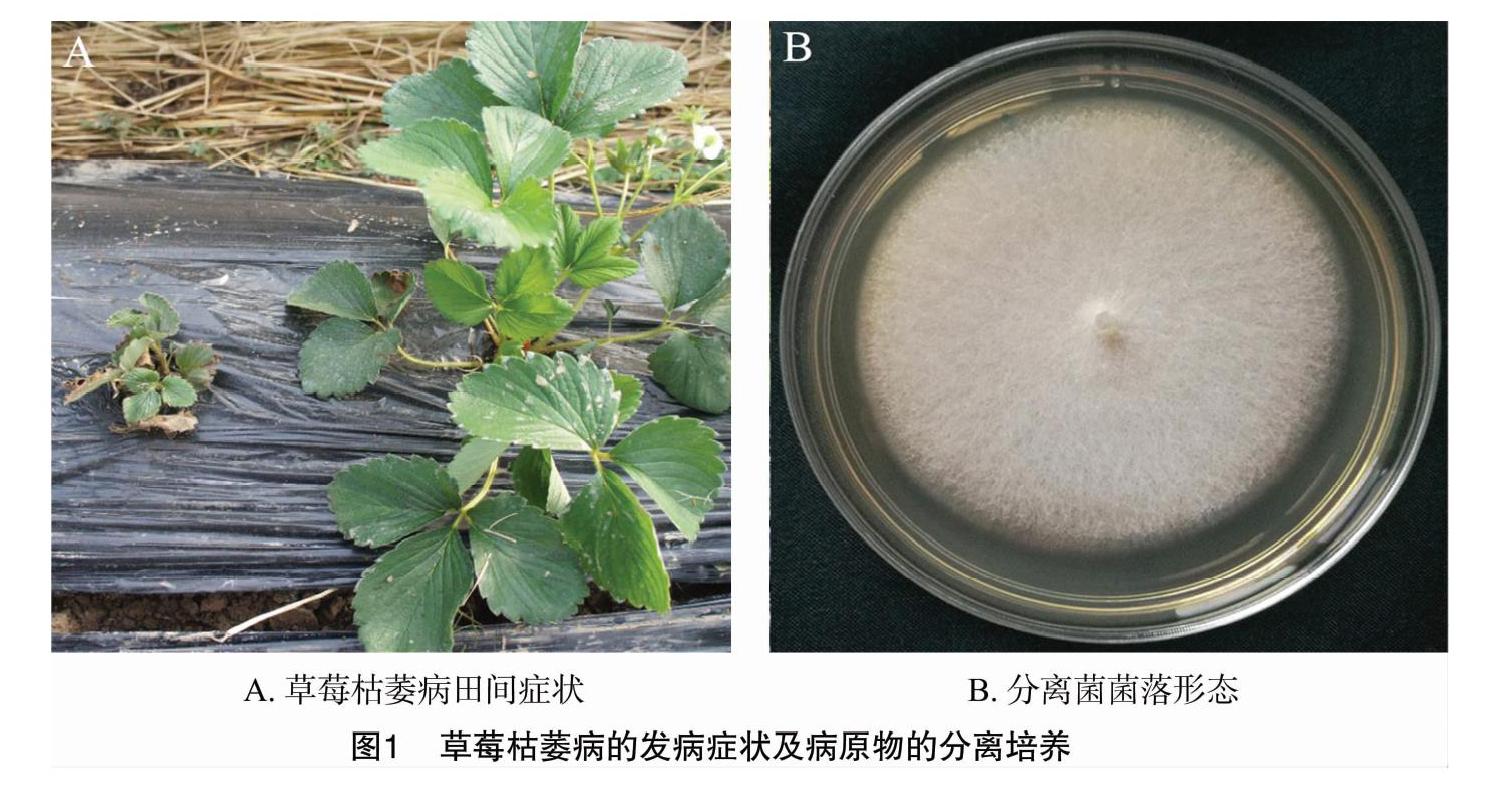
发病草莓植株地上部分复叶呈黄绿色、卷曲,呈现大小叶状,叶缘变褐、萎蔫至枯死;地下部分呈黑褐色,维管束变褐。采用组织分离法,从上海市嘉定区、青浦区、金山区的不同草莓大棚的草莓病株根颈内组织上共分离纯化得到34株单孢菌株(表1)。分离株在PDA培养基上菌丝形态呈白色、质密、絮状(图1)。
2.2 病原菌致病性测定
在人工接种草莓幼苗21 d后,地上部分新生心叶变黄、呈现大小叶,或叶缘变褐出现萎蔫症状,病情进一步发展后植株死亡,剖开根颈可见内部变褐,与田间观察到的症状一致。从接种发病的草莓根颈内分离得到的菌株与接种所用菌株的菌落形态相似。由此可见接种所用的菌株是引起草莓枯萎病的病原菌(图2)。
2.3 rDNA-ITS的PCR扩增及序列测定
菌株rDNA-ITS的PCR扩增产物电泳结果表明,所有菌株的扩增条带都清晰、明亮,大小均约为570 bp的片段 而且不见明显的非特异性杂带,符
合预期的扩增结果。测序和同源性序列进行比对分析结果表明,所有菌株均为尖把镰刀菌(Fusarium oxysporum)。
2.4 草莓枯萎病病菌对4种杀菌剂的敏感性检测
采用菌落生长直径法测得多菌灵、咪鲜胺、戊唑醇和吡唑醚菌酯对34株草莓枯萎病病菌的EC50值分别为(0.449 4±0.077 7)、(0.025 5±0.031 6)、(0.122 7±0.059 1)、(0.467 5±0.415 9) mg/L。34株草莓枯萎病群体对多菌灵和戊唑醇的敏感性差异较小,最大和最小EC50比值分别为1.8、8.3;而对咪鲜胺和吡唑醚菌酯的敏感性差异较大,最大和最小EC50比值分别为134.7、46.8。
2.5 不同地理来源菌株对4种杀菌剂的敏感性差异
分别比较取自嘉定区、青浦区和金山区的草莓枯萎病菌对供试药剂的敏感性差异。结果(图3)表明,对多菌灵的敏感性表现为金山区>青浦区>嘉定区(图3-A),对咪鲜胺、戊唑醇和吡唑醚菌酯的敏感性均表现为嘉定区>金山区>青浦区;不同地区来源的草莓枯萎病病菌对同种杀菌剂的敏感性之间存在差异,但上述差异均未达显著水平(P>0.05)。
2.6 草莓枯萎病病菌对4种杀菌剂敏感性的相关性
通过敏感性(EC50)线性回归分析(图4)得出,多菌灵与咪鲜胺、多菌灵与戊唑醇、多菌灵与吡唑醚菌酯、咪鲜胺与戊唑醇、咪鲜胺与吡唑醚菌酯及戊唑醇与吡唑醚菌酯的决定系数分别为0.004 6、0.011 4、0.063 1、0.200 9、0.046 8、0.007 6,在P=0.05水平上均不显著,表明草莓枯萎病病菌对这4种不同作用机制的杀菌剂的敏感性之间均无显著相关性。
3 结论与讨论
植物病原菌的鉴定及对药剂的室内敏感性测定与筛选工作,是正确指导田间病害防治的前提。本研究首次系统分离了上海市主要草莓产区呈现草莓枯(黄)萎综合症样株的病原菌种群,并采用传统的形态学和现代分子生物学相结合的方法,对病原菌进行鉴定。鉴定结果表明,所有分离菌株均属尖孢镰刀菌,其分类地位为半知菌亚门、瘤座菌科、镰孢属、尖孢镰刀菌(F.oxysporum),该结果与吴祥等的报道[4-7]相一致。
值得与同行探讨的是,本研究取样时间为草莓定植期初期,取样病株为枯(黄)萎病综合症病株,即发病幼苗新生叶失绿变黄或弯曲畸形、复叶上的两侧小叶不对称呈畸形(典型的大小叶)、叶色黄化的病株 而非萎蔫枯死的枯萎病症株。组织分离均
用根颈内部的褐色组织,所有分离菌株从菌落培养特征上可以初步判定为镰孢霉属(Fusarium spp.),没有一个菌株的菌落形态类似轮枝孢属(Verticillium spp.)。类似的,从江苏省苏南地区镇江市、苏州市和无锡市的显枯(黄)复合症病株上,也只分离得镰孢霉属致病真菌。为此,从上述病原菌分离鉴定结果似乎可以得出,苏南和上海地区危害草莓根部显枯(黄)萎病症的病原菌,都是镰孢霉属真菌,而非轮枝孢属真菌。
本研究检测了上海市嘉定区、青浦区和金山区3个草莓主产区的草莓枯萎病病菌群体,对目前生产上常用的苯并咪唑类、咪唑类、甾醇脱甲基抑制剂类和甲氧基丙烯酸酯类杀菌剂的敏感性。上海地区草莓枯萎病菌种群对多菌灵的EC50均值为0.449 4 mg/L,略小于顾春波等报道的山东省草莓枯萎病病菌对多菌灵的敏感基线EC50均值(0.561 mg/L)[8],而与陈宏州等报道的江苏省草莓枯萎病病菌抗多菌灵菌株的EC50均值 (24.278 3 mg/L)[9],和杨焕青等报道的山东省抗多菌灵的草莓枯萎病病菌菌株的EC50(49.490 0 mg/L)有极显著性差异[10]。本研究中草莓枯萎病病菌种群间对多菌灵的最大与最小EC50的比值只有1.8(0.302 7~0.556 2 mg/L),且菌株敏感性频率分布呈连续性单峰曲线,可以把EC50均值(0.449 4 mg/L)作為上海地区草莓枯萎病病种群抗药性检测的敏感基线。综上分析,可以得出上海地区草莓枯萎病菌种群对多菌灵敏感。
裴龙飞等报道112株蔬菜尖孢镰刀菌(F.oxysporum)对咪鲜胺的平均EC50为0.030 1 mg/L,并将此值定为抗性检测的敏感基线[11]。本研究取样的34个菌株EC50均值(0.025 5 mg/L)小于报道的敏感基线值,但菌株间的最大和最小EC50比值达到134.7(0.001 1~0.148 2 mg/L),且菌株敏感性频率呈不连续分布,因此种群中可能产生了敏感性下降的亚群体。本研究取样菌群中只有6株菌株的EC50(0.040 6~0.148 2 mg/L)超过报道值,其余28株菌株中EC50值小于0.01 mg/L(0.0010~0.009 9 mg/L)的有13株菌株,有15株菌株的EC50在0.0100~0.029 8 mg/L之间。基于上述原因,在上海地区草莓枯萎病病菌对咪鲜胺的敏感基线EC50的确立时,应取去除EC50陡然增高的2株菌株(16cf25和16cf04)后的EC50均值(0.018 8 mg/L)为抗药性检测的敏感基线较为适合,还需要从分子水平确定EC50陡然增高的2株菌株是抗性菌株,还是种群间的极端变异株菌株。
上海地区草莓枯萎病病菌取样种群对戊唑醇的EC50均值为0.122 7 mg/L,低于顾春波等报道的山东省草莓枯萎病菌敏感菌株种群对戊唑醇的EC50(0.213 0、0.357 0、0.470 5 mg/L)[8,10,12],近似于陈宏州报道江苏省草莓枯萎病菌对戊唑醇的EC50(0.154 4 mg/L)[9]。本研究中草莓枯萎病病菌种群间对戊唑醇的最大与最小EC50比值为8.3(0.036 1~0.299 7 mg/L),且种群敏感性频率分布呈连续性单峰曲线,可以把取样种群EC50均值(0.122 7 mg/L)作为上海地区草莓枯萎病病菌对戊唑醇抗药性检测的基线,并指出上海地区草莓枯萎病病菌种群对戊唑醇敏感,没有出现敏感性下降的亚群体。
文献检索表明,国内外有关草莓枯萎病病菌对吡唑醚菌酯敏感基线的研究尚未见报道,本研究中取样种群对吡唑醚菌酯的EC50均值为0.467 5 mg/L,种群间对吡唑醚菌酯的最大与最小EC50比值为46.78(0.036 8~1.721 6 mg/L)。取样的34株菌株中有4株菌株的EC50陡增,超过1.0 mg/L。因此,在确定种群对吡唑醚菌酯的敏感性基线时,应取去除EC50陡增的4株菌株后种群的EC50均值为宜,本研究中确定的草莓枯萎病病菌对吡唑醚菌酯的抗药性检测基线的EC50为0.334 7mg/L,仅供参考。取样种群病菌对吡唑醚菌酯的敏感性频率呈不连续分布,说明上海地区草莓枯萎病对吡唑醚菌酯可能产生了敏感性下降的亚种群。我们还需要从分子水平上确定EC50陡增的4株菌株是抗性菌株,还是极端变异菌株。
草莓枯萎菌是土壤传播病害,病原菌抗药性在跨区域间流行传播的可能性较小。本研究表明,不同地区间枯萎病病菌种群对同一药剂的敏感性间有天然异质性差异(除试验操作外)的可能性,但相邻地区来源的草莓枯萎病病菌对同种杀菌剂的敏感性之间没有显著性差异(P>0.05)。因此,有必要研究上海地区草莓枯萎病病菌种群对药剂的敏感性,便于与其他省份的报道相对比。本研究中确定的上海地区草莓枯萎病病菌种群对多菌灵、咪鲜胺和戊唑醇的敏感基线值都小于其他省份的报道值,说明不能通过直接参考其他省份的数据,来当作上海地区草莓枯萎病病菌种群对药剂的敏感性基线。
在本研究中,虽然取样菌株不是未接触过药剂的野生菌株,但鉴于上海地区还未有草莓枯萎病病菌种群对苯并咪唑类、咪唑类、甾醇脱甲基抑制剂类和甲氧基丙烯酸酯类杀菌剂的敏感性研究。因此,可以把本研究中草莓枯萎病病菌种群的平均EC50(有些去除陡增大的值)作为抗药性检测的敏感基线。需指出的是,由于任何敏感基线的建立都是各自实验室特有的,因此,本研究中建立的敏感基线值仅供同行研究时参考。
参考文献:
[1]方中达. 植病研究方法[M]. 北京:农业出版社,1979:124-125.
[2]White T J,Bruns T,Lee S,et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[J]. PCR Protocols,1990,38:315-322.
[3]Chen L,Zhu S,Lu X,et al. Assessing the risk that Phytophthora melonis can develop a point mutation (V1109L) in CesA3 conferring resistance to carboxylic acid amide fungicides[J]. PLoS One,2012,7(7):e42069.
[4]吴 祥,姚克兵,吉沐祥,等. 句容地区草莓枯萎病病原菌的分离鉴定及田间防治[J]. 江苏农业学报,2015,31(4):764-770.
[5]伊海静,陈 艳,刘正坪,等. 草莓枯萎病菌的分离鉴定及防治药剂筛选[J]. 西北农业学报,2016,25(4):626-635.
[6]于红梅,赵密珍,王 静,等. 草莓枯萎病菌的分离、鉴定及生物学特性[J]. 江苏农业科学,2013,41(11):124-127.
[7]王振华,张建坤,龚国祥,等. 草莓枯萎病菌的分离与鉴定[J]. 湖北农业科学,2014,53(14):3297-3299.
[8]顾春波,史晓斌,姜莉莉,等. 草莓枯萎病菌对多菌灵的抗性及其抗性菌株生物学特性[J]. 植物保护学报,2010,37(3):266-272.
[9]陈宏州,庄义庆,杨敬辉. 黄麻链霉菌NF0919菌株对草莓枯萎病的生防活性初探[J]. 江西农业学报,2014,26(11):54-57.
[10]杨焕青,王开运,范 昆,等. 草莓枯萎病菌的生物学特性及7种杀菌剂对其抑制作用[J]. 植物保护学报,2008,35(2):169-174.
[11]裴龙飞,朱发娣,柴阿丽,等. 中国华北地区瓜类尖孢镰刀菌对咪鲜胺的敏感性及抗药突变株生物学性状研究[J]. 农药学学报,2016,18(5):575-581.
[12]林才华,王开运,顾春波,等. 山东省草莓枯萎病菌对四种三唑类杀菌剂的敏感性检测[J]. 植物保护学报,2009,36(1):55-60.
