高寒草原土壤有机碳矿化对水氮添加的响应
2020-04-15张梦瑶高永恒
朱 灵, 张梦瑶, 高永恒,2
(1.中国科学院 水利部成都山地灾害与环境研究所, 四川 成都 610041; 2.中国科学院 成都生物研究所, 四川 成都 610041)
草原生态系统是全球面积最大的陆地生态系统,全球草原生态系统碳储量约1.20×1015kg C,其中90%以上碳储存在土壤中[1]。全球变化背景下,降雨量与氮沉降呈上升趋势[2-3],降水和氮沉降变化会通过影响土壤的化学性质、微生物、酶活性等而影响土壤有机碳矿化过程。截止目前在温带或者低海拔地区开展了不少有关水氮变化对土壤碳矿化影响的研究[4],主要有促进、抑制以及无显著影响3种结论[5-7]。氮沉降和降水变化主要通过提高土壤中的微生物量、土壤碳分解酶的活性等促进碳矿化[5],或造成土壤有机碳周转减慢、土壤酸化等抑制碳矿化[6]。高海拔寒冷地区的高寒草原对气候变化响应敏感[8],但土壤碳矿化对水氮变化的响应研究较少。
青藏高原作为全球最高的地理单位正经历着降水变化和氮沉降增加的影响,研究预测到2050年青藏高原氮沉降量将达到40 kg/(hm2·a)[9];为期55 a的降水观测也表明青藏高原主体部分年降水量以6.24 mm/10 a的倾向率增多[10]。高寒草原作为青藏高原的重要组成部分,对气候变化响应敏感,但土壤碳矿化的研究多关注对单一氮添加和温度变化的响应[11],对水氮添加的响应研究较少。本研究通过对藏北高寒草原土壤进行室内模拟水氮添加,研究高寒草原土壤有机碳矿化的变化,并分析水氮添加后土壤酶活性、土壤碳的变化,为深入认识氮沉降增加和降水变化情形下青藏高原高寒草原土壤碳矿化的响应过程和机理提供基础依据。
1 材料与方法
1.1 研究区概况
本次试验研究区在西藏自治区那曲地区申扎县境内(30°57′N,88°42′E),海拔4 675 m。研究区气候属于高原亚寒带干旱季风性气候,寒冷干燥。年均气温0℃左右,最低温1月份的平均气温为-10.1 ℃,高温期7月份的平均气温为9.6 ℃。年降雨量为300 mm,降水主要集中在5—9月。紫外辐射强度大,年均太阳辐射为2 915.5 h,霜期持续 279.1 d。研究区植被类型以高寒草原为主,植被盖度约为40%,群落优势种为多年生禾草紫花针茅(Stipapurpurea)和青藏苔草(Carexmoorcrofii)[12]。本文选用围封5 a的草原作为试验地,根据中国土壤系统分类方法,试验地土壤主要为寒性旱成土,表层土壤包含91%的砂质土,7%的泥沙和2%的黏土,0—10 cm土壤中有机碳和全氮的含量分别为62.05 g/kg与3.13 g/kg,pH=8.43[13]。
1.2 研究方法
1.2.1 样品采集及处理 2017年6月在样地选取空间上地形一致、土壤条件相似的3处10 m×10 m的大样方,按照简单随机抽样的原则,在大样方内在随机设置3个1 m×1 m的小样方。清除小样方土壤表面植被凋落物层后,用铁锹取0—15 cm土壤并清除土壤中肉眼可见杂物,再把每个大样方里3个土样混合均匀,3个大样方共计得到3个土样,4 ℃保存在便携式冰箱里尽快送回实验室。在实验室里过2 mm土壤筛后放至通风处自然风干,另取一部分过筛土用研钵磨细后过0.149 mm的土壤筛测定土壤理化性质。
1.2.2 土壤基本性质测定 采用下述方法测定田间水量(WHC),用取10 g土壤,置于覆有滤纸的漏斗中,用合适的橡胶塞堵塞漏斗的长颈口,添加足够的水将漏斗内的土壤全部浸泡。浸泡2 h后,取走漏斗长颈口的橡胶塞,让水分自由滴下。保持水分的自由滴流8 h后,取出漏斗内的湿土放置于铝盒中,记录湿土和铝盒的总重量,再把装有湿土的铝盒置于105 ℃的烘箱中烘干8 h至恒重,再取出铝盒迅速测量干土和铝盒总重量;土壤pH值用pH计测定(水∶干土=5∶1);溶解性有机碳(DOC)采用TOC5000仪测定[14];土壤微生物生物量碳(MBC)、土壤微生物生物量氮(MBN)采用氯仿熏蒸法测定[15];土壤脲酶、蔗糖酶和β-葡萄糖苷酶活性用土壤酶 ELISA 试剂盒测定[16]。
1.2.3 培养试验设计 预培养保持土壤含水量在田间持水的40%,取过2 mm土壤筛的自然风干土100 g,放入250 ml三角瓶中,水分换算后把水均匀喷洒于瓶中风干土上。土壤培养温度设置为20 ℃,等于土样采集时野外原位土壤温度,首先进行连续7 d的预培养,以恢复土壤微生物活性[17],接着进行连续90 d的培养试验。在培养期间,通过称重法给土壤补水以保持40%的田间持水量[18]。为了探索不同土壤水分条件下微生物的代谢性能,本试验共设置45%,60%,75 %和90% 4个水分梯度。预培养的土壤含水量为40%WHC,预培养结束后,在40%WHC的基础上通过称重法进行水分的补给,以达到培养期间45%,60%,75 %,90%WHC 4个水分条件。水分添加后,把所有三角瓶于黑暗环境置于20 ℃的人工培养箱中培养24 h后添加氮。每个水分梯度处理下分别以NH4NO3水溶液的形式输入无机氮肥,1个对照(0 mg/g)和3个氮添加梯度(0.2,0.4,0.8 mg/g),文中记为N0,N0.2,N0.4,N0.8。N0.2处理接近当地草原施肥量,结合高寒草原土壤最大氮载荷,设置N0.4,N0.8处理以探究低氮和高氮添加对高寒草原土壤碳矿化的影响,不同氮添加下各3个重复。经换算室内培养氮添加量分别等同于0,2.5,5,10 g/(m2/a)(以N计)的田间添加量。
1.2.4 CO2排放通量的测定 在培养后第 1,3,8,15,22,29,36,43,50,60,70,80,90 d测定土壤的CO2排放量,培养第1,45,90 d分别为培养初、中、末期。测定前用橡胶塞密封培养瓶2 h,用注射器连通三通阀抽取20 ml气体,用气相色谱仪分析CO2浓度,用来表示土壤微生物呼吸强度。CO2的通量单位为mg/kg·h,CO2的通量F的计算公式为:
式中:ρ为CO2在标准状态下气体的密度,为1.965 kg/m3;V为培养瓶内气体的有效体积(m3); ΔC为气体浓度差(1 mg/L);m为培养土烘干重(kg); Δt为培养时间(h);T为进气时的室温(℃)。
1.2.5 数据处理 试验地土壤视为同一土壤类型,水氮添加对土壤碳矿化的影响采用SPSS 21.0进行双因素方差分析和Pearson相关性分析,不同梯度的水或者氮处理之间用最小显著差异(LSD法,p<0.05)进行检验,图形绘制使用Origin 9.0。
2 结果与分析
2.1 土壤有机碳矿化对水氮添加的响应
培养初期(图1a),45%WHC与60%WHC条件下,随着氮添加的增高,土壤CO2排放通量呈上升趋势,但在75%,90%WHC高水分条件下,土壤CO2排放通量明显下降。在此阶段,水氮交互作用对土壤有机碳矿化有显著影响。培养中期(图1b),CO2累积排放通量占整个培养期间的53.42%~60.59%,这是由于在这段期间内土壤中微生物的活性较高。培养末期(图1c),在最接近土壤原始水分含量下(45%WHC),高氮添加抑制了土壤碳矿化。虽然水氮交互作用对土壤有机碳矿化在统计学上没有达到显著影响,但在90%WHC水分添加下缓解了高氮添加对土壤矿化过程的抑制作用,60%,75%WHC条件下氮添加促进土壤碳矿化过程。
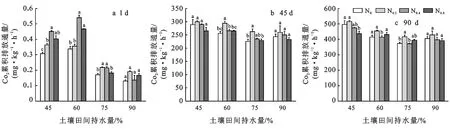
注:①图中不同小写字母表示差异显著,p0,N0.2,N0.4,N0.8表示氮添加梯度,氮添加量分别为0,0.2,0.4,0.8 mg/g。下同。
2.2 土壤溶解性有机碳的变化
培养初期(图2a),45%,60%,75%WHC条件下,N0.2,N0.4低氮处理下土壤DOC含量与对照没有显著差异。45%WHC水分条件下,随着施氮量增加,土壤DOC含量呈上升趋势,高氮添加有利于土壤DOC的积累。但在60%,75%,90%WHC水分条件下,未表现出土壤DOC含量随施氮的增加而上升。培养中期,水氮交互作用对DOC含量有显著影响。在中期与末期阶段(图2b,2c),90%WHC高水分条件下的 DOC含量始终显著高于其余 3个水分状态(p<0.05),土壤DOC含量受水分添加的影响更敏感,与方差分析结果一致。

图2 不同培养阶段土壤溶解性有机碳(DOC)动态变化
2.3 土壤微生物量碳、氮的变化
培养初期水氮添加对土壤MBC含量均有显著影响(见表1),不同水平氮添加下,土壤微生物量碳含量随着水分含量的增多不同程度上升(见表2)。氮添加对土壤MBC含量也有显著影响,同一水分条件下,N0.2处理较N0处理下的土壤MBC含量高,N0.4,N0.8较N0处理下的土壤MBC含量低。4个不同水分条件下,最低MBC含量均出现在N0.8处理下,说明氮添加超过一定阈值后,会造成土壤MBC含量下降。中期水分对土壤MBC含量有显著影响,氮添加与水氮交互作用对其影响不显著(见表2)。45%,60%,75%WHC的水分条件下,不同水平水氮添加后,土壤MBC含量较培养初期时有所上升,只有个别处理土壤MBC含量下降(W45%+N0.2和W60%+N0.2)。90%WHC的水分条件下,4个不同水平氮添加后,中期的土壤MBC含量反而均低于培养初期。从培养的初、中、末3个阶段里的土壤MBC峰值来看,在为期90 d的培养中,土壤MBC含量先上升再下降。
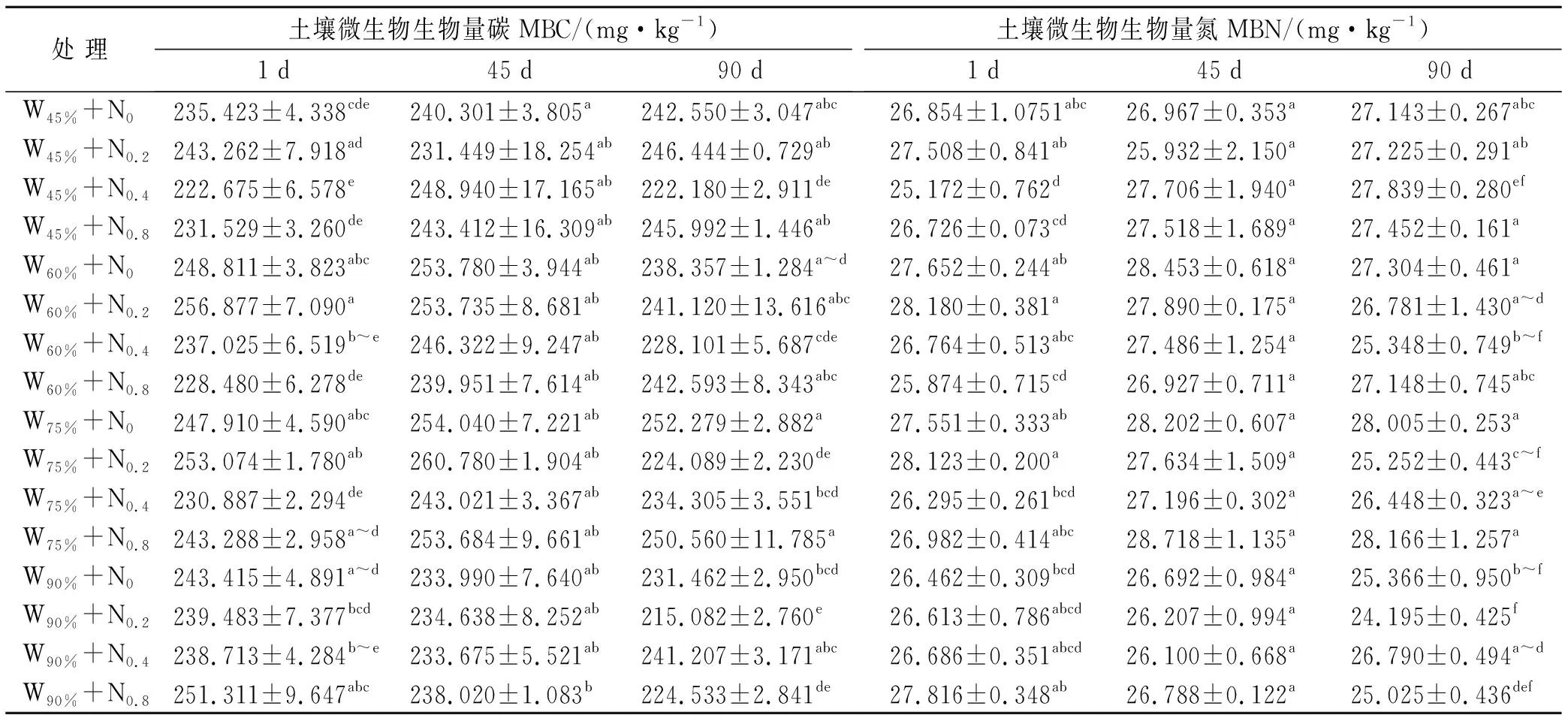
表1 不同培养阶段土壤微生物生物量碳和土壤微生物生物量氮对水氮添加的响应
注:①表中同列数据后不同小写字母表示在相同培养时间下土壤微生物生物量碳MBC,土壤微生物生物量氮MBN含量差异显著,p<0.05; ②表中N0,N0.2,N0.4,N0.8表示氮添加梯度,氮添加量分别为0,0.2,0.4,0.8 mg/g; ③W45%,W60%,W75%,W90%表示4个水分梯度,为土壤田间持水量为45%,60%,75%和90%。下同。
培养初期,与N0处理相比,N0.8处理降低土壤MBN含量,但高氮对土壤MBN含量的负作用在高水分条件下得到缓解。培养中期,水氮交互作用对土壤MBN含量影响更加明显,75%WHC与90%WHC下,均是N0.8处理下土壤MBN含量达到最大。3个阶段里土壤MBN峰值先上升再下降,总体上看土壤MBN含量较稳定,不同处理下差异较小。
2.4 土壤酶活性变化
在培养初期时(图3a,3d,3g),4个不同的水分条件下,与土壤原始含氮量相比,高氮处理后,土壤脲酶、蔗糖酶、β-葡萄糖苷酶活性均降低,相比于45%WHC条件下,随着水分的添加,高氮处理对3种酶活的抑制得到不同程度的缓解。在培养中期,总体来看,除90%WHC条件下,其他不同水氮处理下的土壤脲酶活性均较培养第1 d有上升(图3b)。土壤蔗糖酶活性对水分添加更敏感,与未进行氮添加处理的蔗糖酶活性相比,45%,60%,75%WHC下不同水分氮添加处理后,土壤蔗糖酶活性上升(图3e),这与初期时均是未对土壤进行施氮处理下的土壤蔗糖酶活性最大有较大改变。培养末期(图3c,3f,3i),不同水氮处理下的脲酶活性均比第45 d时低,蔗糖酶活性,β-葡萄糖苷酶活性总体呈降低趋势,高氮添加抑制酶活性更加明显。
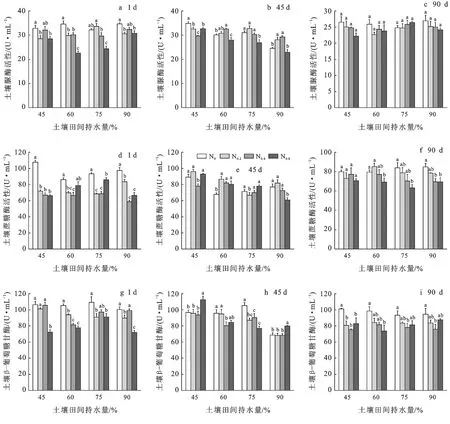
图3 不同培养阶段土壤酶活性的动态变化
2.5 CO2排放通量与土壤溶解性有机碳、土壤微生物生物量碳及酶活的相关分析
土壤DOC含量与CO2累积排放通量在培养初期呈正相关(R=0.017,p=0.476,见表3),随着培养的进行,在中、末期呈显著负相关关系(R=-0.616,p=0.006;R=-0.820,p<0.001),这说明随着水氮的添加,虽然缓解了研究区干旱、氮素不足的情况,土壤DOC含量呈上升趋势,但DOC生物可利用性降低。土壤MBC含量与CO2累积排放通量关系在统计学意义上虽然没达到显著,但是随着培养时间的进行,土壤MBC含量的增加有利于有机碳矿化过程的进行。在初期,土壤脲酶、蔗糖酶、β-葡萄糖苷酶与CO2累积排放通量均呈负相关关系(R=-0.319,p=0.114;R=-0.275,p=0.151;R=-0.229,p=0.197),这说明在初期适宜的水氮添加虽然提高了酶活性,但由于研究区受有机质不足等的限制,所以CO2排放通量未表现出随着土壤酶活的上升而增加。在培养中期,水氮添加缓解了水分不足、营养匮乏下的限制作用,促进土壤中有机物质的溶解,提高了参与土壤碳矿化相关微生物的活性,CO2排放通量与土壤酶活表现出显著正相关关系,中期CO2累积排放通量达到了整个培养期间的53.42%~60.59%。
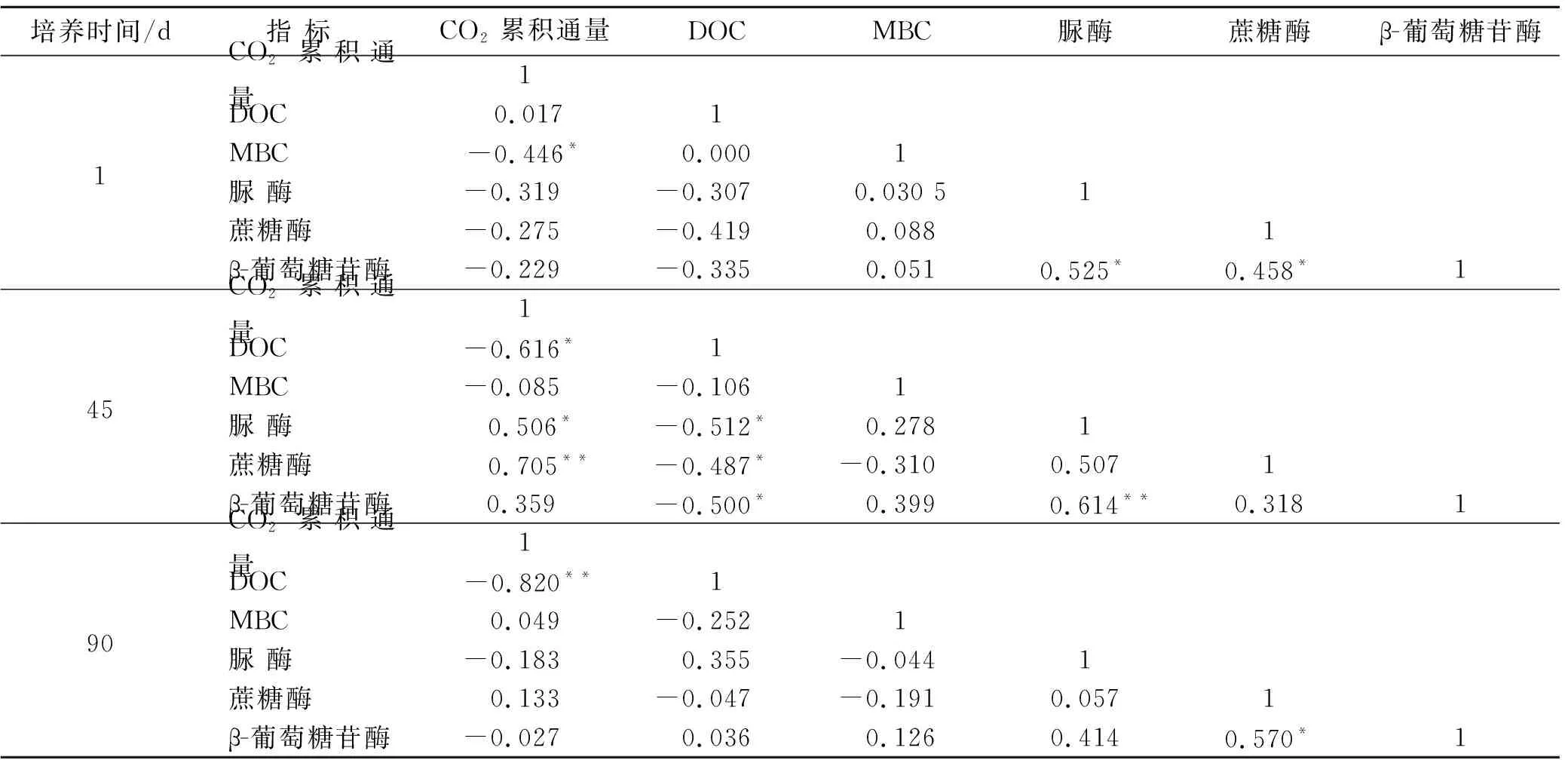
表3 CO2累积排放通量与土壤指标的Pearson相关性分析
注:①表中数值为Pearson相关系数,记为R; ②*表示在置信度(单侧)为0.05时,相关性显著**表示在置信度(单侧)为0.01时,相关性极显著。
3 讨 论
3.1 土壤有机碳矿化
在培养初期,N0.4,N0.8高氮添加处理下的CO2排放通量高于N0,N0.2低氮添加下的CO2排放通量,但是随着培养时间的延长,氮素添加反而抑制了土壤有机碳矿化过程,这是由于在初期,土壤中碳源充足,且研究区土壤原始含氮量较低,易氧化分解的物质受氮素限制[19],所以当外加氮源后,提高了原本受氮素限制的微生物活性及其相关酶活[20-21],表现为氮添加促进土壤有机碳矿化过程。随着培养的进行,土壤中可利用碳源的降低,且有研究表明,高氮添加增加了有机物的芳香性和复杂性[22],导致微生物碳源受限制;此外,氮添加增加了土壤氮的有效性,增加了离子强度并降低了土壤pH值[23],降低了土壤酶活性,表现为累积CO2排放通量的降低。
在培养初期,水氮交互作用对土壤碳矿化有显著影响,在中期和末期,随着水分含量的增加可以有效减缓高氮添加对土壤碳矿化的抑制作用。这是由于水分对土壤有机碳矿化的影响主要是通过改变土壤通透性来实现,土壤碳矿化作用是一个需氧过程,在接近土壤原始水分条件下(本研究区为45%WHC),高氮对土壤微生物量、土壤酶活等的抑制作用更容易表现出来。也就说,当水分条件不是土壤碳矿化作用的限值因素时,其他影响土壤碳矿化作用的因素才容易表现出来,这与其他研究结果一致[19,24]。当水分过高时,土壤处于厌氧环境,土壤含氧量成为土壤碳矿化过程的主要调控因子,高氮添加的抑制作用受阻,对外表现为高水分添加减缓了高氮添加对土壤有机碳矿化的抑制作用。以上结果说明,土壤碳矿化过程对水分添加的响应更敏感,氮添加对土壤碳矿化作用的影响依赖于水分添加。
3.2 土壤溶解性有机碳
土壤DOC含量与土壤有机碳矿化相关[25-26],容易受土壤理化性质影响,如土壤水分、pH值、温度等。在适宜的水分添加会加速土壤中可溶性有机物质的溶解,并且研究表明土壤中的团聚体在高土壤含水量状态下发生裂解释放出被矿质土壤吸附的有机物质[27],此外,DOC是土壤微生物容易利用的碳源,在高水分条件下微生物活性降低,利用DOC能力下降,这也就解释了本次研究中90%WHC下 DOC含量高于其余3个水分下DOC 含量。本研究表明,与培养第1 d未添加氮的土壤DOC含量相比,在不同时期里,不同氮量添加后土壤DOC含量均上升,这是由于本研究中的土壤原始含氮量较低,低氮添加加速了土壤腐殖化进程[28],也促进了土壤中的根系分泌物如碳水化合物、氨基酸等和微生物的代谢产物的降解作用,从而使得土壤中的 DOC 含量有所增加;高氮添加抑制木质素降解真菌的活性,增加水溶性产物的释放[29],且高氮刺激一些木质纤维素放线菌的活性,其代谢产生可溶性多酚[30],增加土壤DOC含量。
在培养中、后期,土壤碳矿化与土壤DOC含量呈显著负相关关系,这可能与土壤水分的影响以及土壤性质改变有关。高水分条件下,土壤通透性下降,氮添加造成土壤pH降低,这些都影响土壤酶活、土壤微生物数量、活性等;此外,也说明虽然水氮添加后土壤DOC含量上升,但微生物可利用的DOC却减少,例如上述提到的多酚类物质。
3.3 土壤微生物量碳、氮

3.4 土壤酶活性
本次研究中的土壤采自受水分和氮素含量限制的区域,适宜的水分条件下(干旱地为45%~75%)进行低氮添加提高了土壤脲酶活性。这是由于水氮添加缓解了水分不足、营养匮乏下的限制作用,促进土壤中有机物质的溶解,提高了参与土壤碳矿化相关微生物的活性,酶活性也随之增加。且施氮肥为土壤脲酶的酶促反应提供了大量的基质,刺激了土壤脲酶活性[35],这也就解释了与土壤原始含氮量相比,一定程度的氮肥添加可以提高脲酶活性。在培养的中、后期,随着水分含量的增加,蔗糖酶活性呈降低趋势,这说明当土壤水分含量较高时,土壤通透性降低导致孔隙度下降而抑制了土壤蔗糖酶活性,与脲酶相比,蔗糖酶对水分添加的响应更加敏感。总的来说,适宜的水氮添加下,土壤酶活性呈增强趋势,这是由于水分可以促进氮素有效性。特别是在高寒草原地区,水氮是重要的限值因素,适宜的添加,提高了微生物活性及酶活。当土壤水分含量超过田间最大持水量的75%,通透性下降,且高氮添加土壤中氮达到饱和后,盐基离子损耗,土壤酸化[23],从而降低了酶活性。
4 结 论
(1) 在45%~75%WHC水分条件下,低氮添加(<0.4 mg/g)(以N计)促进了微生物对碳底物的代谢活性和利用,提高了土壤的碳矿化能力。45%WHC条件下高氮添加(>0.8 mg/g)抑制土壤有机碳矿化过程。
(2) 土壤碳矿化受水分调控更加敏感。水氮存在交互作用,氮添加对土壤碳矿化作用的影响依赖于水分添加,高水分处理(>90%WHC)可以缓解高氮添加对土壤碳矿化的抑制作用。
(3) 研究区土壤碳矿化的最适水分条件为60%WHC,最适氮添加量为0.2 mg/g(以N计),水分含量与氮添加阈值分别为75%WHC与0.4 mg/g,超过阈值便会抑制土壤碳矿化。
