大黄素对TGF-β1诱导的人肾小管上皮细胞上皮间质转分化及Mfn2表达的影响
2020-04-15龙脉李梦婕柯本黄金菁房向东
龙脉,李梦婕,柯本,黄金菁,房向东
慢性肾脏病(chronic kidney disease,CKD)患病率逐年上升,已成为全球公共卫生与健康问题[1]。肾间质纤维化(renal interstitial fibrosis,RIF)是各种不同病因CKD 进行性发展至终末期肾病(end stage renal disease,ESRD)的共同病理状态,其特征性病变为肾小管萎缩、大量炎性细胞浸润、肌成纤维细胞活化,导致细胞外基质成分过度堆积,最终取代正常肾脏结构,造成肾脏功能不全与丧失[2]。大黄素(emodin,EM)是中药大黄的有效活性成分,属于蒽醌类物质,具有抑菌、抗炎、调节免疫、抗肿瘤、保肝利胆、利尿、改善肾功能等药理作用[3]。研究认为,大黄素可以改善大鼠肾脏纤维化[4],但是大黄素长期给药会对小鼠肾脏产生毒性作用[5]。线粒体融合蛋白2(mitofusin2,Mfn2)是线粒体外膜上的跨膜蛋白,主要参与线粒体外膜融合,在线粒体能量代谢、细胞葡萄糖水平、细胞增殖、凋亡、自噬等方面发挥着重要作用[6]。线粒体功能障碍及功能受损参与了糖尿病肾病的发生和发展[7],Mfn2 过表达下调了胶原蛋白Ⅳ的表达,显示出对糖尿病肾病的保护作用[8]。目前关于Mfn2 在肾脏纤维化中的研究少见。本研究旨在探讨在转化生长因子β1(transforming growth factor β1,TGF-β1)刺激后人肾小管上皮HK-2 细胞中Mfn2 的表达水平,观察大黄素干预后Mfn2的表达水平变化,探讨大黄素对肾脏纤维化的保护作用机制及其与线粒体功能的关系。
1 材料与方法
1.1 主要试剂与仪器 HK-2细胞(武汉普诺赛生命科技有限公司),DMEM/F12培养基及胎牛血清(以色列BI公司,04-001-1-A),重组人TGF-β1(美国Peprotech公司,100-21),大黄素(Sigma,E7881),CCK-8试剂盒(北京博奥森生物技术有限公司,BA00208),RIPA 裂解液、苯甲基磺酰氟(PMSF)及Western blot 试剂盒(北京索莱宝科技有限公司),兔抗Mfn2单克隆抗体(英国Abacm 公司,ab124773),兔抗α-平滑肌肌动蛋白(α-SMA)多克隆抗体、兔抗结缔组织生长因子(CTGF)多克隆抗体及兔抗E-钙黏蛋白(E-cadherin)多克隆抗体(北京博奥森生物技术有限公司,货号分别为bs-10196R、bs-0743R、bs-1519R),兔抗GAPDH 多克隆抗体(武汉三鹰生物技术有限公司,10494-1-AP),辣根过氧化物酶标记的山羊抗兔IgG 二抗(博士德生物工程公司,BA1060),CO2培养箱(SANYO,MCO-15AC),倒置显微镜(日本OLYMPUS-CX41),SDS-PAGE微型凝胶电泳及转膜设备(美国BIO-RAD 公司),全自动化学发光图像分析系统(上海天能科技有限公司,Tanon-5200),低温高速离心机(德国Sartorius-3k30)。
1.2 方法
1.2.1 细胞培养 HK-2 细胞用含10%胎牛血清的DMEM/F12 培养基培养,加入1%的青霉素和链霉素双抗,于37 ℃,5%CO2条件下进行培养,细胞融合至80%,0.25%胰蛋白酶消化,隔天换液,2~3 d 传代 1 次,取对数生长期HK-2 细胞进行后续实验。
1.2.2 大黄素母液 精确称取大黄素10 mg,并用666.67 μL的DMSO超声溶解,得到浓度为50 mmol/L的大黄素母液,使用时DMEM/F12培养基稀释。
1.2.3 CCK-8 法检测大黄素对HK-2 细胞增殖活性的影响 在96孔板中接种HK-2细胞悬液(每孔100 μL,约5 000个细胞),置于37 ℃、5%CO2培养箱中培养。待细胞贴壁,融合至50%左右,弃去上清用磷酸盐缓冲液(PBS)洗2遍,换无血清培养基饥饿。24 h后弃去无血清培养基,向各孔中加入不同浓度(0、10、20、40、80、160 μmol/L)的大黄素溶液,设置空白对照组,每组设5个平行复孔。将培养板于培养箱孵育48 h后,每孔加入10 μL CCK-8溶液,避免产生气泡,放培养箱孵育2 h,用酶标仪测定450 nm 处的吸光度(A)值。计算:细胞存活率(%)=[A(加药)-A(空白)]/[A(0 加药)-A(空白)]×100%。实验重复3次。
1.2.4 实验分组及干预 根据CCK-8实验结果,为避免高浓度EM 干预对HK-2 细胞活性的影响,最终选择浓度为10、20、40 μmol/L 的EM 进行后续实验。因此,实验分空白对照组、TGF-β1 组、TGF-β1+EM(10、20、40 μmol/L)组。培养HK-2 细胞,将细胞接种在6 孔板中,待细胞融合至50%左右,换无血清培养基饥饿24 h,大黄素干预组加入不同浓度EM,30 min 后 TGF-β1 组和各浓度大黄素干预组给予 10 μg/L 的TGF-β1刺激48 h,收集细胞进行Western blot免疫印迹分析。
1.2.5 Western blot法检测Mfn2、α-SMA、CTGF及E-cadherin蛋白表达 各组6 孔板中的细胞用预冷的PBS 清洗2 遍,加入RIPA裂解液,刮取细胞提取总蛋白,取上清后采用BCA法进行蛋白定量,余蛋白样品加6×蛋白上样缓冲液,金属浴100 ℃变性6 min。SDS-聚丙烯酰胺凝胶电泳分离蛋白(75 V 30 min,110 V 65 min),湿转(200 mA,90 min),5%脱脂奶粉室温封闭 2 h,孵育一抗,Mfn2(1∶2 000),α-SMA(1∶2 000),CTGF(1∶2 000),E-cadherin(1∶1 000),GAPDH(1∶50 000),4 ℃摇床过夜。次日,洗膜、室温孵育辣根过氧化物酶标记的山羊抗兔IgG 二抗(1∶8 000)1 h,洗膜,ECL 显影液曝光,Image J软件进行半定量分析。实验重复3次。
1.3 统计学方法 采用SPSS 25.0统计软件对数据进行统计分析。符合正态分布的计量资料以均数±标准差()表示,2组间均数比较采用两独立样本t检验,多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度大黄素对HK-2细胞增殖的影响 0、10、20、40、80、160 μmol/L 的大黄素处理组的HK-2细胞的存活率(%)分别为100.00±0.00、90.89±2.17、88.52±1.67、87.72±2.00、63.46±1.73、52.19±2.60,呈逐渐降低趋势(n=3,F=287.553,P<0.01)。
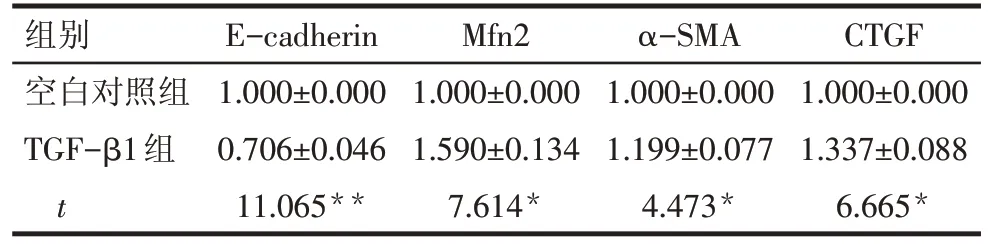
2.2 TGF-β1 刺激后HK-2 细胞中上皮间质转分化(EMT)相关蛋白E-cadherin、α-SMA、CTGF 表达的变化 与空白对照组相比,TGF-β1 组α-SMA 及CTGF蛋白水平升高,E-cadherin蛋白表达降低(P<0.05),见表1、图1。
Tab.1 Expression levels of EMT-related proteins after TGF-β1 stimulation in HK-2 cells表1 TGF-β1刺激后HK-2细胞EMT相关蛋白表达水平(n=3,)
Tab.1 Expression levels of EMT-related proteins after TGF-β1 stimulation in HK-2 cells表1 TGF-β1刺激后HK-2细胞EMT相关蛋白表达水平(n=3,)
*P<0.05,**P<0.01
组别空白对照组TGF-β1组t E-cadherin 1.000±0.000 0.706±0.046 11.065**Mfn2 1.000±0.000 1.590±0.134 7.614*α-SMA 1.000±0.000 1.199±0.077 4.473*CTGF 1.000±0.000 1.337±0.088 6.665*
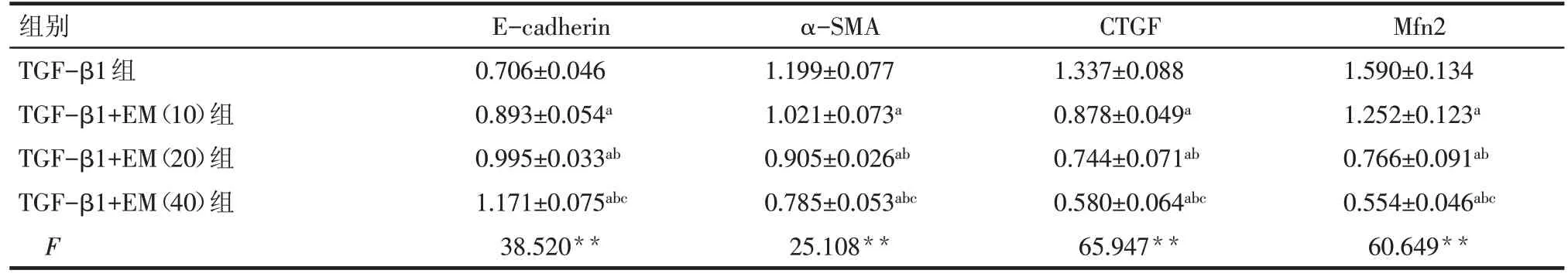
2.3 大黄素对TGF-β1 诱导的HK-2 细胞中E-cadherin、α-SMA、CTGF 蛋白表达的影响 与TGF-β1组相比,给予各浓度大黄素干预后,HK-2细胞中α-SMA 及 CTGF 蛋白水平降低,E-cadherin 蛋白表达升高(P<0.05),且大黄素浓度越高,作用越明显,见表2、图1。
2.4 大黄素对TGF-β1诱导的HK-2细胞中Mfn2蛋白表达的影响 与空白对照组相比,TGF-β1 刺激后,HK-2 细胞中Mfn2 蛋白表达增加(P<0.05),各浓度大黄素干预后,Mfn2蛋白表达水平较单纯给予TGF-β1 刺激时表达减少(P<0.01),且大黄素浓度越高,抑制作用越明显,见表1、2,图1。
3 讨论
近年来,尽管CKD 治疗取得一定的进展,目前仍无特效药物或其他手段对CKD 患者进行有效根治性治疗,伴随肾间质纤维化的进展,最终发展为终末期肾病[9]。肾间质纤维化是CKD的最常见病理表现,主要特征为成纤维细胞的增殖、细胞外基质(extracellular matrix,ECM)的积累以及肾单位功能性丧失[2]。肾小管上皮细胞EMT是活化的肌成纤维细胞的重要来源之一,是RIF的核心环节,主要表现为上皮细胞失去黏附能力、α-SMA表达和肌动蛋白的重组、基底膜破坏、细胞迁移和侵袭能力增强[10]。TGF-β1为公认的促纤维化因子,可刺激肾小管上皮细胞的EMT,促进RIF 的进展[11]。在TGF-β1 诱导后,肾小管上皮细胞发生表型转化,上皮标志蛋白E-cadherin 表达减少,间充质标志蛋白α-SMA 表达增加[12]。结缔组 织 生长因子(connective tissue growth factor,CTGF)作为一种促纤维化因子,可通过与表皮生长因子受体(epidermal growth factor receptor,EGFR)结合,调节成纤维细胞ECM 的合成和诱导肾小管上皮细胞的 EMT 产生[13]。Wong 等[14]研究认为,外源性TGF-β1诱导成纤维细胞后CTGF表达水平升高,体内外CTGF的表达依赖TGF-β1信号通路,CTGF 是TGF-β1 的下游信号分子。因此,E-cadherin、α-SMA 和 CTGF 蛋白都是发生 EMT 时的标志蛋白。本实验结果显示,与空白对照组相比,在给予TGF-β1诱导后,Western Blot检测到HK-2细胞中α-SMA和CTGF蛋白表达增多,E-cadherin蛋白表达减少,表明TGF-β1 刺激后HK-2 细胞发生了EMT,提示成功建立了肾小管上皮细胞EMT模型。
大黄素为中药大黄的有效成分之一,在肾脏中有着利尿及改善肾功能的药理作用[3]。越来越多的研究表明,大黄素对肾脏具有保护及治疗作用。Ma等[4]研究认为,大黄素可能通过下调TGF-β1/Smad信号通路改善大鼠肾脏纤维化,显示出大黄素的抗肾脏纤维化作用。Guan等[15]研究发现,大黄素通过抑制TGF-β1 信号传导并随后抑制EMT、成纤维细胞活化和ECM沉积,来减轻博来霉素(BLM)诱导的肺纤维化。另外,窦芳等[16]研究表明,大黄素通过抑制 Akt/mTOR 通路,改善 TGF-β1 诱导的 HK-2 细胞纤维化相关蛋白的表达,减少细胞损伤,从而延缓肾纤维化进展。本研究结果显示,不同浓度的大黄素均对HK-2 细胞的增殖有抑制作用,但是以80、160 μmol/L 浓度的抑制作用更加明显,考虑到高浓度大黄素对HK-2 细胞的毒性作用,因此以10、20、40 μmol/L 浓度进行后续的实验。结果显示,在HK-2细胞中给予TGF-β1刺激后,发生了EMT,在给予大黄素干预后,α-SMA 和CTGF 蛋白表达减少,E-cadherin蛋白表达增加,表明大黄素明显改善了肾小管上皮细胞EMT,从而显示出其抗肾脏纤维化作用。此外,大黄素浓度越高,抑制作用越明显,显示出剂量依赖性。
Tab.2 Expression levels of E-cadherin,α-SMA,CTGF and Mfn2 in HK-2 cells表2 各组HK-2细胞中E-cadherin、α-SMA、CTGF 、Mfn2蛋白表达水平 (n=3,)
Tab.2 Expression levels of E-cadherin,α-SMA,CTGF and Mfn2 in HK-2 cells表2 各组HK-2细胞中E-cadherin、α-SMA、CTGF 、Mfn2蛋白表达水平 (n=3,)
*P<0.05,**P<0.01;a与TGF-β1对照组比较,b与TGF-β1(10)组比较,c与TGF-β1(20)组比较,P<0.05
组别TGF-β1组TGF-β1+EM(10)组TGF-β1+EM(20)组TGF-β1+EM(40)组F E-cadherin 0.706±0.046 0.893±0.054a 0.995±0.033ab 1.171±0.075abc 38.520**α-SMA 1.199±0.077 1.021±0.073a 0.905±0.026ab 0.785±0.053abc 25.108**CTGF 1.337±0.088 0.878±0.049a 0.744±0.071ab 0.580±0.064abc 65.947**Mfn2 1.590±0.134 1.252±0.123a 0.766±0.091ab 0.554±0.046abc 60.649**
Mfn2是一种高度保守的跨膜GTP酶类,广泛表达于心、肾、骨骼肌、肝、脑等组织器官,尤以心、肾和脑最为丰富。Mfn2定位于细胞内线粒体外膜,具有促进线粒体融合和维持线粒体正常结构的功能,在高血压、冠心病、内分泌疾病、肿瘤等多种疾病中发挥着关键作用[17]。在糖尿病肾病大鼠模型中,Mfn2的过表达减轻了模型大鼠的肾脏病理改变,抑制了胶原蛋白Ⅳ的合成,改善了氧化应激和线粒体功能,在糖尿病肾病早期起着保护作用[18]。目前,还少见关于Mfn2与肾纤维化方面的进展。本研究中,与空白对照组相比,在给予TGF-β1 诱导后的肾小管上皮细胞中,Mfn2蛋白水平升高,给予大黄素干预后,Mfn2 蛋白水平又随之降低,且大黄素浓度越高,抑制作用越明显,表明在肾小管上皮细胞发生EMT时,Mfn2 表达上调,而大黄素的干预又使Mfn2 表达下降,因此,笔者考虑大黄素可能会通过减少TGF-β 1诱导的Mfn2表达来改善肾脏纤维化。
综上所述,TGF-β1 可以诱导HK-2 细胞发生EMT;大黄素能显著逆转 TGF-β1 诱导的HK-2 细胞转分化作用,保护受损的HK-2细胞,早期阻断这一过程可能预防或延缓肾间质纤维化的发生;Mfn2表达水平在肾小管上皮细胞发生EMT后发生改变,提示Mfn2及线粒体功能与肾脏纤维化的密切联系,其可能是肾脏发生纤维化的早期生物标志物;大黄素能降低EMT后Mfn2的表达水平,可能通过调节线粒体功能来减缓肾脏纤维化,发挥肾脏保护作用。
