双靶向配体化力达霉素的急性和亚急性毒性
2020-04-14曹睿秦秀军魏锦萍叶程宋文凭李亮邵荣光
曹睿,秦秀军,魏锦萍,叶程,宋文凭,李亮,邵荣光
(1.中国医学科学院北京协和医学院医药生物技术研究所,北京 100050;2.华北理工大学生命科学学院,河北唐山 063020;3.中国辐射防护研究院,山西太原 030006)
双靶向配体化力达霉素(dual targeting ligandbased lidamycin,DTLL)是由我所自主研发的一种类似于抗体药物偶联物(antibody-drug conjugate,ADC)功能的免疫融合蛋白,既能发挥抗体靶向作用,又具有药物的肿瘤细胞毒性。DTLL 是由烯二炔类抗生素力达霉素的发色团和靶向表皮生长因子受体1/2(epithelial growth factor receptor 1/2,EGFR 1/2)的融合蛋白(包括针对EGFR1/ 2 的靶向肽与力达霉素辅基蛋白)经过体外分子重建而获得[1]。其中,作为细胞毒效应部分的力达霉素发色团,极易发生芳构化而失活。因此,在构建融合蛋白时,包含了具有稳定发色团作用的辅基蛋白。不同于传统的ADC药物设计思路,DTLL中的靶向肽采用特异性靶向EGFR的配体EGF中C环的22个氨基酸残基和抗人EGFR2(HER-2)单链抗体C6.5重链的CDR3 区,即完全实现了抗体药物的小型化,使其更容易穿透组织,又能够携带具高效细胞毒性的力达霉素发色团到达肿瘤实质部位发挥疗效。DTLL 作为新型ADC 类药物,其体外抗肿瘤作用机制主要为与EGFR/HER-2 高表达的肿瘤细胞特异性结合,内吞入细胞后引起特定序列的DNA双链断裂并诱导肿瘤细胞凋亡,具有强烈的杀伤作用。动物实验研究表明,其明显抑制卵巢癌[2]、食管癌[3]、乳腺癌和胰腺癌等异种移植瘤的生长,有望成为一种新型的抗肿瘤药物。
为促进该药的临床应用,评价DTLL 的毒副作用和安全性,并估算其半数致死浓度(LD50)和最大耐受剂量,本研究通过急性毒性试验和亚急性毒性试验观察该药物对机体产生的中毒反应及其严重程度[4],同时探讨其毒性作用可能的靶器官,确定毒性剂量效应关系,为DTLL 进入临床试验阶段提供实验依据,为临床安全用药的剂量设计和毒副反应监测提供参考。
1 材料与方法
1.1 动物、药物、试剂和仪器
昆明小鼠60 只,雌雄各半,4~5 周龄,SPF 级;SD 大鼠120 只,雌雄各半,6~7 周龄,SPF 级;均购自中国食品药品检定研究院,生产许可称号SCXK-(京)2014-0013,动物饲养于中国辐射防护研究院药物安全评价中心,许可证号SYXK(晋)2013-0002,由获得资格认证的人员按照动物房常规以标准饲养笼内饲养。饲养室温度为20.3~21.7℃,湿度为46.5%~48.7%,12/12 h 明暗交替,每笼5 只,每周换笼2次;动物饲料,北京科澳协力饲料有限公司〔SCXK-(京)2014-0010〕;动物垫料,江苏省协同医药生物工程有限责任公司(DB32/T 2129-2012)。DTLL 冻干粉针(中国医学科学院医药生物技术研究所,相对分子质量为1.8×104,纯度>95%,批号:P10327 和P20327);氯化钠注射液(石家庄鹏海制药有限公司)。Histocentre 3 石蜡包埋机、Finesse 325 石蜡切片机和Excelsior 全自动组织脱水机(英国Shandon);BX53 荧光显微成像系统(日本Olympus);HEMAVET 950 全自动五分类动物血液分析仪(美国Drew Scientific 公司);AC9900 电解质分析仪(江苏奥迪康医学科技有限公司);Konelab PRIME 30 全自动生化分析仪(美国Thermo Fisher公司);H-100尿液分析仪(长春迪瑞医疗科技股份有限公司)。
1.2 急性毒性试验小鼠分组、给药和体质量测定
给药前将小鼠称重,根据小鼠体质量按分段均衡随机分组法分别进行分组,每组10只,共6组,分别为正常对照组及DTLL 1.44,2.05,2.93,4.19 和5.99 mg·m-2组,每组均雌雄各半[5]。与临床拟用途径一致,小鼠经尾静脉注射给药。给药体积为33.3 mL·m-2,给药频次为24 h内给药1次[6]。分别于给药前及给药后第3,7和14天(给药前为第0天,给药当天为第1天)测体质量。
1.3 亚急性毒性试验小鼠分组、给药及体质量和摄食量测定
给药前SD 大鼠称重,根据大鼠体质量按分段均衡随机分组法分别进行分组,每组30只,共4组,分别为正常对照组及DTLL 61,122和245 μg·m-2组,每组均雌雄各半[5]。与临床拟用途径一致,大鼠经尾静脉注射给药。给药体积为34 mL·m-2,每周给药1 次,连续给药4 周,此为给药期(给药当天为第1 天,第1~28 天为给药期);随继续观察4 周,此为恢复期(第29~56 天为恢复期);共56 d。给药第1 天测量大鼠体质量和摄食量,每周1 次。每周摄食量(g)=〔每周投放饲料量(g)-每周剩余饲料量(g)〕/每笼大鼠数。
1.4 生存状态的监测
给药后2~3 h 内严密观察动物的毒性反应(中毒症状、中毒发生时间、持续时间和恢复期等)以及动物的死亡情况(死亡时间和濒死前反应等)。记录所有动物的死亡情况和出现的症状,以及症状的起始时间、严重程度和持续时间等。实验期间每天观察1次,观察内容为动物外观、神经系统(行为及反应、异常运动、对刺激的反应和神经反射)、呼吸系统(呼吸及其频率和分泌物)、胃肠系统(粪便性状和腹部形态)、泌尿生殖系统(会阴部污秽和外生殖器肿胀)和眼(眼睑下垂、眼球突出和震颤等)[7-8]。
1.5 大体解剖检查
急性毒性试验期间,昆明小鼠中若有死亡立即尸检,结束时所有存活小鼠均进行大体解剖检查。亚急性毒性试验中,在给药结束后(第28天)和恢复期结束后(第56天)均进行解剖学监测,观察大鼠是否有外伤、出血、浮肿和肿瘤等,口、鼻、肛门、阴道等有无异常分泌物、渗出物及黏膜有无出血。动物处死后进行解剖检查,观察胸腹部皮下有无出血、感染等;检查腹部或胸腔主要组织和脏器的位置、颜色、大小、质地等有无异常,腹腔或胸腔有无积液及积液的性质和量等;检查咽颈部和脑有无出血及炎性渗出物,主要组织及脏器有无异常等[9]。
1.6 组织病理学检查
急性毒性试验和亚急性毒性试验中对各组小鼠或大鼠脏器组织取材,摘取的脏器置4%甲醛中固定24 h 后弃甲醛,重新加4%甲醛继续固定48 h 以上,进行组织选块。其中肝组织取2块,肾组织包括肾皮质、髓质和肾盂,其他组织各取1块进行组织学检查。组织切块经常规脱水、石蜡包埋、切片、HE染色后封片,光镜下进行组织病理检查[10]。
1.7 大鼠血液和尿液指标检查
亚急性毒性试验期间,SD 大鼠给药结束后次日(第29天),每组雌雄大鼠各取10只,ip给予戊巴比妥钠(50 mg·kg-1)麻醉。经腹主动脉取血,EDTA-2K 抗凝后采用HEMAVET 950 全自动五分类动物血液分析仪测定一般血液学指标,其余分离血清后用相关仪器测定生化指标。在取血前12~16 h 大鼠禁食。恢复期结束次日(第57 天)取全部剩余大鼠,按上述方法取血处死,测相应指标。尿液检查:动物用代谢笼采尿,采用试纸条法,使用H-100 尿液分析仪测定尿液的葡萄糖(glucose,Glu)、胆红素(bilirubin,Bil)、酮体(ketone body,KET)、尿比重(specific gravity,SG)、潜血(occult blood,BLD)、pH 值、蛋白(protein,PRO)、尿胆素原(urobilinogen,UBG)、亚硝酸盐(nitrite,NIT)和尿白细胞(leukocyte,LEU)。尿外观(颜色、浊度)由肉眼进行观察记录。
1.8 统计学分析
实验结果数据用表示。实验中SD 大鼠的体质量、摄食量、血液学和生化指标数据,采用SPSS 统计软件进行统计学分析,多组间比较采用单因素方差分析法(one-way ANOVA),组间两两比较采用t检验。死亡动物分布情况采用DAS 1.0统计软件以正规Bliss 法计算。尿液检查结果采用秩和检验分析。P<0.05为差异具有统计学意义。
2 结果
2.1 DTLL急性毒性
2.1.1 DTLL对小鼠存活的影响
急性毒性试验中,正常对照组小鼠在实验期间全部存活,无死亡。各实验组小鼠死亡时间分布在给药后第4~12天。其中DTLL 2.05 mg·m-2组雄鼠死亡1 只,DTLL 2.93 mg·m-2组死亡9 只(雌鼠4 只,雄鼠5只),DTLL 4.19和5.99 mg·m-2组雌性小鼠全部死亡(图1)。经Bliss法计算,DTLL的LD50为2.45 mg·m-2,小鼠存活情况与性别无显著关联。
2.1.2 DTLL对小鼠体质量的影响
试验期间,昆明小鼠未见由于药物以外原因引起的异常。给药后第3天,DTLL 4.19和5.99 mg·m-2组体质量与正常对照组相比显著降低(P<0.01)。给药后第7 天,DTLL 1.44,2.05 和2.93 mg·m-2组雌鼠体质量均显著低于正常对照组(P<0.01),4.19 和5.99 mg·m-2组雄鼠体质量与正常对照组相比也明显降低(P<0.01)。给药后第14 天,DTLL 1.44 和2.05 mg·m-2组雌、雄小鼠体质量均显著低于正常对照组(P<0.05)(图2A 和B)。表明DTLL 1.44~5.99 mg·m-2剂量范围内可导致小鼠体质量降低,但该影响与性别无显著相关性。
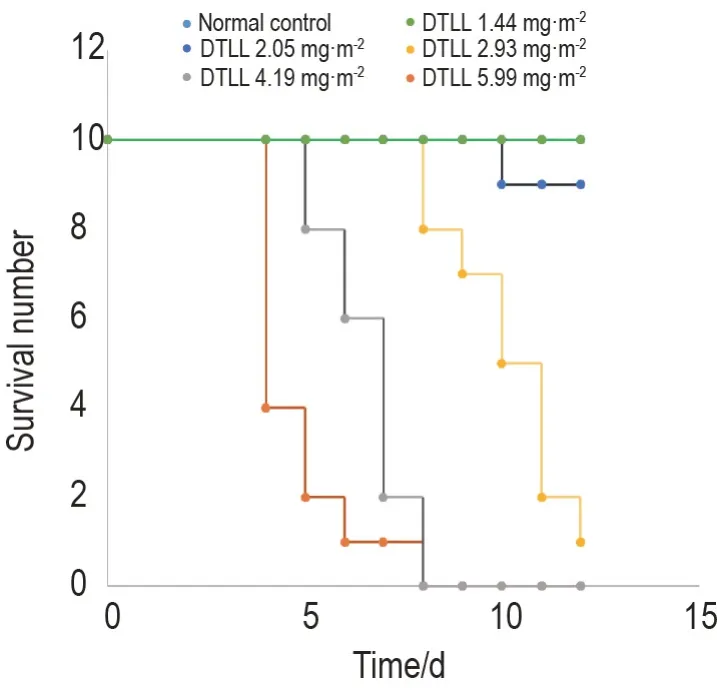
Fig.1 Survival curve of KM mice treated with dual targeting ligand-based lidamycin(DTLL)in acute toxicity test. KM mice were randomly divided into normal control and DTLL 1.44,2.05,2.93,4.19 and 5.99 mg·m-2 groups.DTLL was injected via tail vein once within 24 h.The number of surviving mice was observed every day for additional 14 d.n=10.
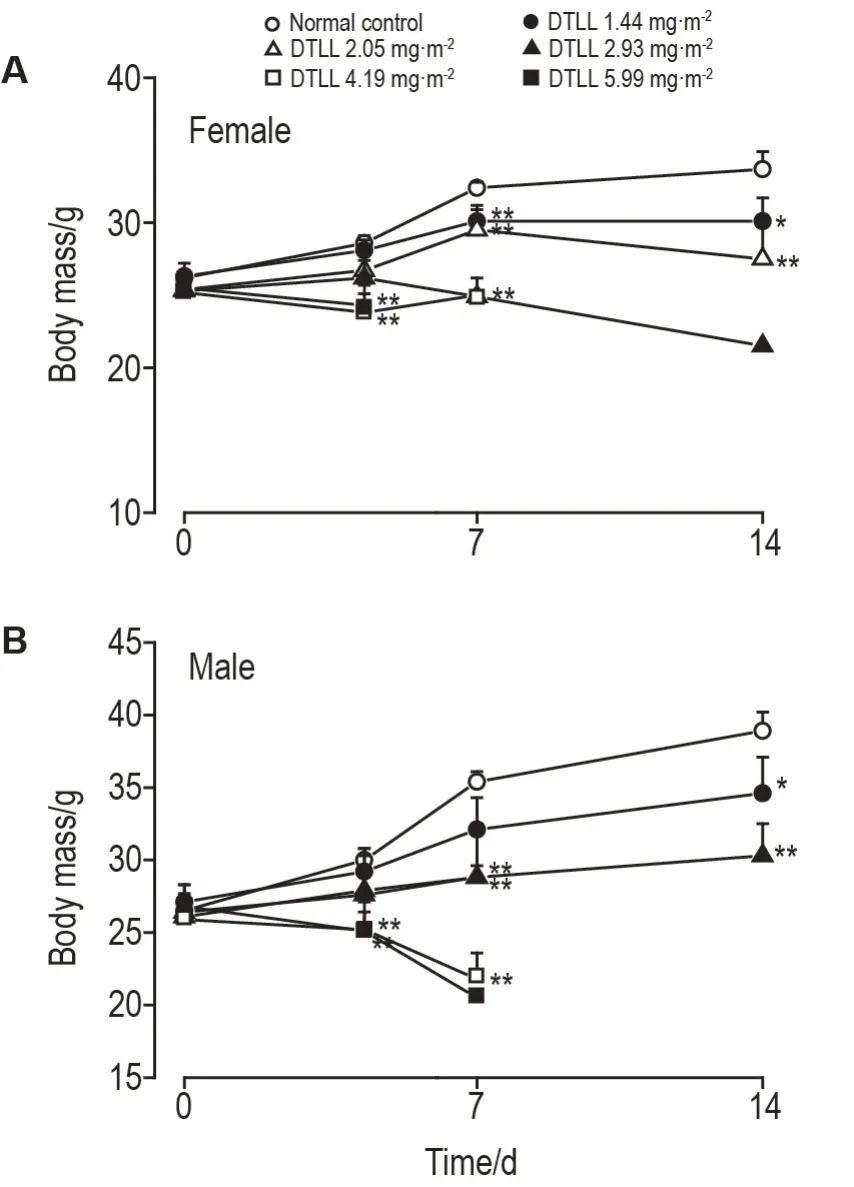
Fig.2 Effect of DTLL on body mass of KM mice in acute toxicity. See Fig.1 for the mouse treatment.Mouse body mass was measured before treatment and on the 3rd,7th and 14th day after administration for additional 14 d. ,n=5.*P<0.05,**P<0.01,compared with normal control group.
2.1.3 DTLL对小鼠生存状态的影响
给药后前3 d,各给药组昆明小鼠均未观察到明显异常症状。第4天,DTLL 4.19和5.99 mg·m-2组部分小鼠出现被毛不光滑、行动迟缓、眼睑闭合等症状,并有小鼠开始陆续死亡;第8天,DTLL 2.93 mg·m-2组部分小鼠也出现上述症状,并开始陆续死亡;第10 天,DTLL 2.05 mg·m-2组1 只雄鼠死亡;第14天,DTLL 2.05 mg·m-2组部分小鼠出现被毛不光滑症状,DTLL 2.93 mg·m-2组存活小鼠仍有被毛不光滑、行动迟缓等症状。正常对照组和DTLL 1.44 mg·m-2组小鼠未观察到明显异常症状。小鼠症状出现时间和死亡时间、死亡数量均有一定的剂量效应关系。实验结果提示DTLL可能有延迟性毒性。
2.1.4 DTLL对小鼠脏器的影响
试验期间正常对照组小鼠解剖观察无任何异常。死亡小鼠主要集中在DTLL 2.93,4.19 和5.99 mg·m-2组,其主要病变为皮下、胃和肠浅黄色或黄色,肠出血,肝、脾和肾灰白色等。观察14 d结束后的存活小鼠:DTLL 2.05 mg·m-2组小鼠主要病变为腹水,胃肠局部出血,肝、脾和肾颜色变浅;DTLL 2.93 mg·m-2组小鼠主要病变为肝和脾颜色变浅;DTLL 1.44 mg·m-2组小鼠未观察到明显异常。
2.1.5 DTLL对小鼠脏器病理变化的影响
DTLL 2.05,2.93,4.19和5.99 mg·m-2组小鼠给药后脾出现萎缩,边缘区消失,甚至白髓消失,随后出现不同程度的红系、粒系、巨核系的髓外造血,以及肠不同程度的急性出血,提示DTLL 可能引起造血功能的障碍,同时也出现淋巴细胞和浆细胞增生,提示其可能引起免疫抑制。DTLL 对于肝的影响主要表现为大剂量组出现肝细胞嗜酸性病变、核皱缩,多发灶状肝细胞坏死,以及后期出现的肝细胞再生等病理变化,表明其可引起明显的肝毒性。而对肾的影响主要表现为不同程度的肾小管上皮细胞肿胀,且部分肾的局部肾小管上皮细胞坏死、脱落,在后期病变程度明显减轻,提示药物可能会引起轻度的肾损伤[11](图3)。
2.2 DTLL亚急性毒性
2.2.1 DTLL对大鼠体质量的影响
试验期间(给药期+恢复期)未见正常对照组大鼠死亡。给药第1 天开始测量大鼠体质量,每周1次。各给药组雌性大鼠体质量与正常对照组比较均无统计学差异。从给药第8天开始至给药期结束,各给药组雄性大鼠体质量均低于正常对照组(P<0.01),且有一定的剂量效应关系(P<0.01,r=0.98)。至恢复期末,DTLL 122 和245 μg·m-2组体质量与正常对照组的差距逐渐增大。其中,在给药期1 周后和恢复期的7 次体质量测量,DTLL 245 μg·m-2组雄性大鼠均显著低于正常对照组(P<0.05;P<0.01);在给药期1 周后和恢复期2 周后的5 次体质量测量中,与正常对照组比,DTLL 122 μg·m-2组显著下降(P<0.05;P<0.01);而DTLL 61 μg·m-2组雄性大鼠体质量无统计学差异(图4A 和B)。以上结果表明,DTLL对雌性大鼠体质量影响不大,但大剂量对雄性大鼠体质量有明显影响,提示DTLL 对大鼠体质量的影响可能与性别有关。

Fig.3 Histopathological examination of various organs of KM mice treated with DTLL in acute toxicity test(HE staining).See Fig.1 for the mouse treatment.The black arrows show extramedullary hematopoiesis,shrinking spleens,small intestinal bleeding and cellular necrosis in livers and kidneys.

Fig.4 Effect of DTLL on body mass of SD rats in subacute toxicity test.SD rats were randomly divided into normal control and DTLL 61,122 and 245 μg·m-2 groups,respectively.DTLL was administered by injection in rat tail vein,once a week for 4 weeks before the rats were left recovering for 4 weeks after drug withdrawal.Body mass of rats was measured every week during experiments. ,n=15.*P<0.05,**P<0.01,compared with normal control group.
2.2.2 DTLL对大鼠摄食量的影响
给药第5 天开始测量大鼠摄食量,每周1 次。各给药组雌性大鼠摄食量与正常对照组比较均无统计学差异。从给药第12天开始至恢复期结束,各给药组雄性大鼠摄食量均低于正常对照组(P<0.05),且与剂量有关(P<0.05,r=0.95)。其中,给药第2,3和4周,DTLL 245 μg·m-2组雄性大鼠摄食量显著低于正常对照组(P<0.05);给药第2 周,DTLL 122 μg·m-2组雄性大鼠摄食量与正常对照组比较也显著减少(P<0.05);但给药期间,DTLL 61 μg·m-2组雄性大鼠的摄食量与正常对照组比均无差异;恢复期期间,各组例数较少而未进行统计学分析(图5)。结果表明,DTLL 61,122和245 μg·m-2对雌性大鼠摄食量影响不大,但122 和245 μg·m-2对雄性大鼠的摄食量有影响,提示其对大鼠摄食量的影响也与性别有关。
2.2.3 DTLL对大鼠生存状态的影响
给药前,实验大鼠行为活动正常,外观体征无异常,粪便颜色和形状均正常。给药期间,各给药组均未观察到明显异常症状。恢复期第4 周,DTLL 122 μg·m-2组有2 只雄性大鼠出现消瘦、被毛不光滑症状;DTLL 245 μg·m-2组有2 只雌性大鼠死亡,1只雄性大鼠出现明显的消瘦症状。

Fig.5 Food consumption of SD rats treated with DTLL in subacute toxicity test.See Fig.4 for the rat treatment.Food intake of SD rats was measured every week during experiments.,n=15.*P<0.05,compared with normal control group.
2.2.4 DTLL对大鼠脏器的影响
给药结束后,各给药组SD 大鼠可见肝表面灶状暗红色,呈淤血状,胃壁及肠壁血管扩张、充盈、呈淤血状等变化。恢复期结束时,DTLL 61 μg·m-2组可见肝体积增大和双肾淤血偏深红,其余未见异常。DTLL 122 μg·m-2组可见轻度腹水,脾体积增大;肝色灰白;双侧肾体积增大。DTLL 245 μg·m-2组主要可见胸或腹腔积液,肝体积增大,色深红或黑色,肺局部或全肺呈深红色、淤血状,脾体积增大,双侧肾体积增大等。
2.2.5 DTLL对大鼠脏器组织病理变化的影响
给药结束时,各剂量组的个别SD 大鼠心脏出现心肌炎、心肌间质炎症细胞浸润以及心肌纤维溶解。脾主要为生发中心增大、边缘区变窄或消失等。此外,DTLL 61和122 μg·m-2组脾还有白髓数量减少、血管充血、出血等变化。骨髓的主要组织病理学变化为成熟粒细胞增加、粒系细胞减少、嗜酸性粒细胞增多等,并且病变主要集中在DTLL 122和245 μg·m-2组。
恢复期结束时,DTLL 122和245 μg.m-2组个别大鼠出现心肌纤维溶解、心肌纤维化、心肌炎、小动脉管壁增厚和玻璃样病变。肝组织病理变化主要出现在恢复期结束,表现为纤维组织增生、肝窦扩张、充血、出血、肝细胞萎缩、肝细胞水样变、肝细胞脂肪变等,其中以DTLL 245 μg·m-2组表现较为明显。脾组织病理变化在DTLL 122 μg·m-2组,主要为生发中心增大、髓外造血、白髓数量减少、红髓充血、出血等;DTLL 245 μg·m-2组主要为白髓淋巴细胞减少、边缘区变窄/消失、髓外造血。肺组织病理变化主要为炎症细胞浸润、肺泡腔或间质水肿、肺泡壁或血管充血等。肾组织病理变化也主要出现在恢复期,表现为肾小球节段性坏死、肾小管嗜碱性变、管型、肾小管上皮细胞肿胀或水样变等,且病变主要集中在大剂量组。骨髓病理变化在DTLL 122 μg·m-2组,主要表现为嗜酸性粒细胞增多、粒系细胞减少、红系细胞增多、脂肪细胞增多;DTLL 245 μg·m-2组骨髓变化主要表现为巨核细胞增多、有核细胞减少(图6)。
2.2.6 DTLL对大鼠血液学指标的影响

Fig.6 Effect of DTLL on histopathological changes of various organs of SD rats treated with DTLL in subacute toxicity test(HE staining).See Fig.4 for the rat treatment.On the 56th day,the pathological changes were detected.The black arrows show inflammation of myocardial cells,hepatocyte lesion,enlargement in the splenic germinal center,infiltration of pulmonary inflammatory cells in the lung,renal tubular eosinophilic lesion and bone marrow eosinophilia in rats,respectively.
给药结束后,与正常对照组相比,DTLL 245 μg·m-2组雌性大鼠的白细胞计数(white blood cell count,WBC)、红细胞分布宽度(red blood cell volume distribution width,RDW)和血小板计数(platelet,PLT)显著增高(P<0.05,P<0.01),雄性大鼠WBC显著升高(P<0.05);其余血液学指标中,各给药组与正常对照组比较无差异。恢复期结束后(第56天),DTLL 245 μg·m-2组雌性大鼠的WBC、红细胞压积(hematocrit,HCT)、平均红细胞体积(mean corpuscular volume,MCV)和平均红细胞血红蛋白含量(mean corpsular hemoglobin,MCH)与正常对照组相比显著升高,其雄性大鼠WBC 仍显著高于正常对照组(P<0.05,P<0.01);122 μg·m-2组雄性大鼠红细胞计数(red blood cell count,RBC)和血红蛋白(hemoglobin,Hb)则显著低于正常对照组(P<0.05,P<0.01)(表1和表2)。提示DTLL 245 μg·m-2主要引起WBC升高及雌性大鼠RDW和PLT升高,停药后WBC 和RDW 未见恢复;停药后DTLL 122 μg·m-2组雄性大鼠RBC和Hb降低。其余指标与正常对照组相比无统计学差异(数据略)。
2.2.7 DTLL对大鼠血液生化指标的影响
给药结束后,各给药组雌性大鼠血清生化指标与正常对照组比较均无统计学差异(表3)。122 μg·m-2组雄性大鼠血清肌酸激酶(creatine kinase,CK)和乳酸脱氢酶(lactate dehydrogenase,LDH)低于正常对照组(P<0.05,P<0.01),DTLL 245 μg·m-2组雄性大鼠血清总胆固醇(total cholesterol,TCHO)显著高于正常对照组(P<0.05)(表3)。恢复期结束后,DTLL 245 μg·m-2组雌鼠和雄鼠血清谷丙转氨酶(glutamate pyruvate transaminase,GPT)和谷草转氨酶(glutamic oxaloacetic transaminase,GOT)水平显著高于正常对照组(P<0.01,P<0.05),尿素氮(urea nitrogen,BUN)、肌酐(creatinine,CREA)、总胆红素(total bilirubin,TBIL)、TCHO、甘油三酯(triglyceride,TG)、尿酸(uric acid,UA)、CK 和LDH 水平无明显变化(表4)。提示DTLL 245 μg·m-2可使大鼠在恢复期GPT和GOT显著升高,对其他指标无明显影响(数据略)。
2.2.8 DTLL对大鼠尿液指标的影响
给药结束后,DTLL 245 μg·m-2组雄性大鼠尿PRO 和LEU 与正常对照组比较显著升高(P<0.01),雄雌性大鼠的尿SG与正常对照组比较也显著增大(P<0.05,P<0.01)(表5)。恢复期结束后,DTLL 245 μg·m-2组雌性和雄性大鼠尿PRO 和LEU 与正常对照组比较仍有升高(P<0.05);同时DTLL 122 μg·m-2组雄性大鼠的BLD,PRO,LEU和pH 值与正常对照组比较亦显著升高(P<0.05)。由此表明,DTLL 245 μg·m-2可使大鼠尿液PRO 和LEU 异常,停药后未见恢复。DTLL 122 μg·m-2停药后还可引起雄性大鼠出现BLD,PRO,LEU和pH值等升高(P<0.05)(表6)。其余指标与正常对照组相比无明显变化(数据略)。

Tab.1 Effect of DTLL on hematological indexes of SD rats during administration period
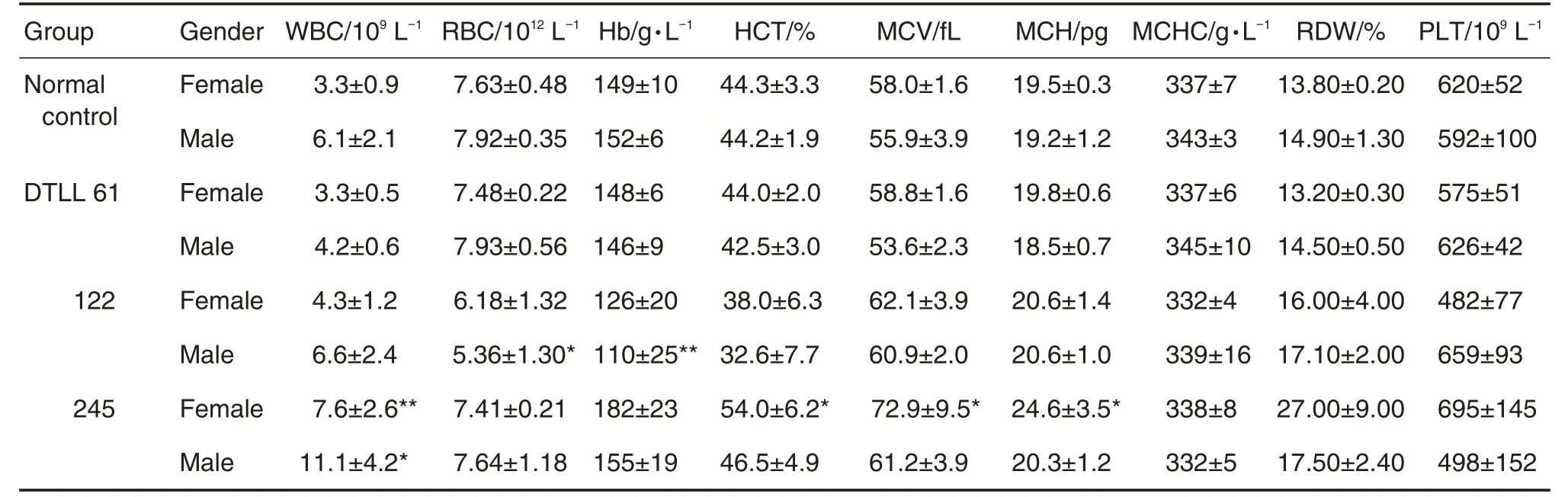
Tab.2 Effect of DTLL on hematological paramenters of SD rats during convalescence period
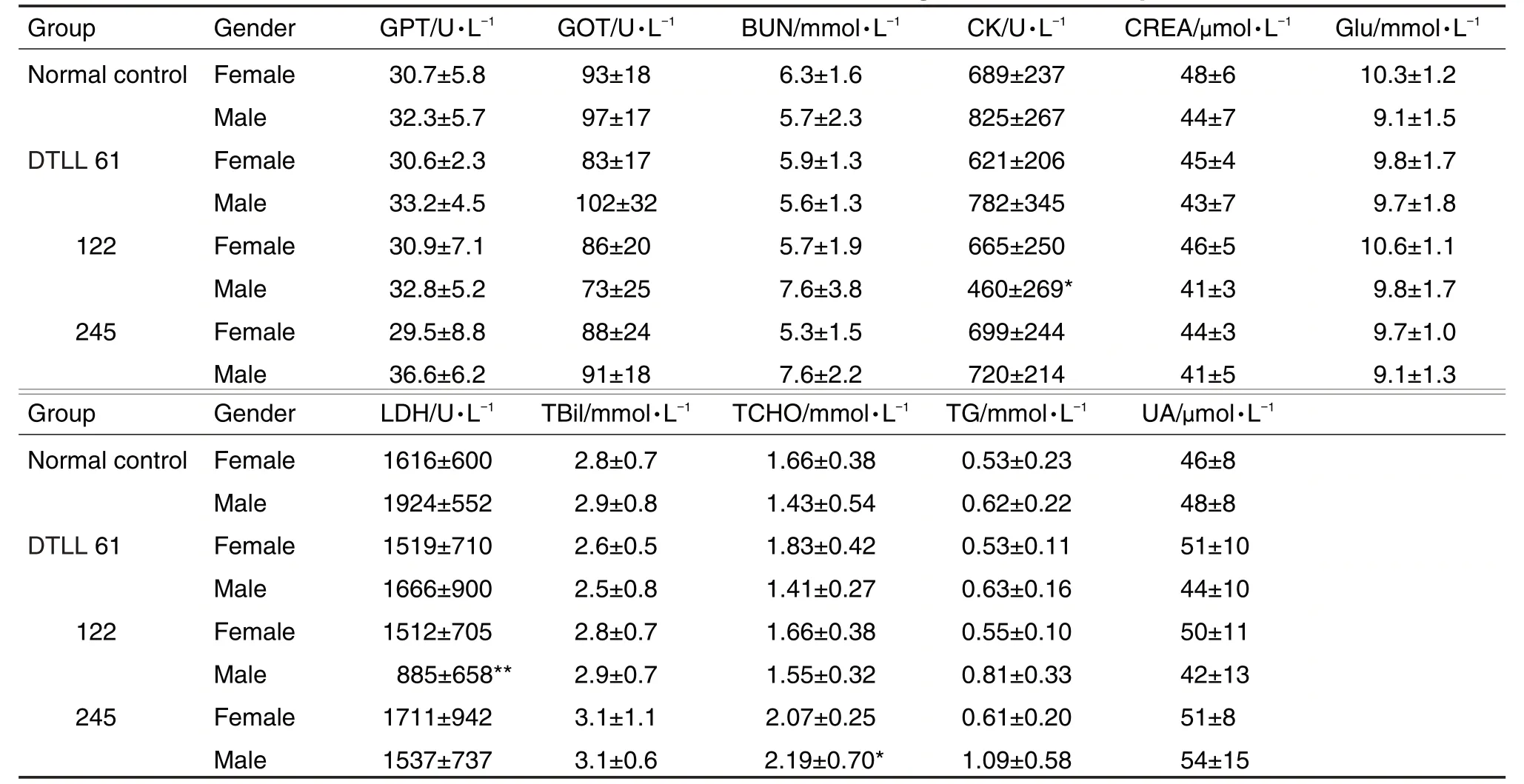
Tab.3 Effect of DTLL on blood biochemical indexes of SD rats during administration period

Tab.4 Effect of DTLL on blood biochemical indexes of SD rats during convalescence period

Tab.5 Effect of DTLL on urine indexes of SD rats during administration period

Tab.6 Effect of DTLL on urine indexes of SD rats during convalescence period
3 讨论
DTLL 是一种新型抗体偶联药物,在体外可特异性与高表达EGFR/HER-2的肿瘤细胞结合,进入细胞后引起特定序列的DNA双链断裂,诱导肿瘤细胞凋亡,对多种肿瘤细胞具有强烈杀伤作用,对多种裸鼠的人体移植肿瘤也都有显著疗效(4,9)。但必须慎重关注DTLL 可能产生的毒副反应,以便安全合理用药。
本研究急性毒性试验中,根据各组小鼠死亡情况,计算得出DTLL的LD50为2.45 μg·m-2。尾静脉注射给予DTLL后,小鼠症状出现时间和死亡时间、死亡数量均有一定的剂量效应关系,DTLL>2.05 mg·m-2剂量的给药组显示延迟性毒性,可引起免疫抑制,造血功能障碍及肝、肾毒性。亚急性毒性实验中,给药期间各给药组SD 大鼠均无明显的异常症状,停药后第4 周,各剂量组出现死亡和其他明显症状。结合恢复期大鼠体质量和摄食量的变化,也提示DTLL存在延迟性毒性[11]。此外,给予不同剂量的DTLL 会引起SD 大鼠WBC,RDW,PLT,GPT,GOT,TCHO和TG不同程度的变化,还发现肝、肾、脾和肺均会出现不同程度的组织病变,提示DTLL具有肝、肾毒性[12],同时脾和肺也是DTLL作用的靶器官。本研究还发现,DTLL 122 和245 mg·m-2组大鼠CK和LDH在给药结束以及恢复期结束期间都有一定程度的降低,组织病理学检查可见个别大鼠有心肌炎、心肌纤维溶解等变化,但病变均为散在分布,还不能判定DTLL具有心脏毒性。
力达霉素中的发色团属于细胞周期非特异性的细胞毒性药物,它与DNA小沟相互作用并造成特定序列的DNA 断裂,同时还能够诱导细胞发生凋亡。关于这一类细胞毒性药物,对于骨髓造血细胞的毒性通常表现为骨髓抑制、造血功能障碍和免疫抑制等。同时,由于其作用没有靶向性和特异性,也会对一些正常的实质性器官造成损伤。故本研究在急性毒性和亚急性毒性实验中均可发现,DTLL所引起的造血功能障碍和免疫抑制以及肝、肾、脾、肺的毒性,这些结果并不令人意外。众所周知,EGFR和HER-2广泛分布于哺乳动物上皮细胞、成纤维细胞、胶质细胞、角质细胞等细胞表面,DTLL中抗EGFR/HER-2 的靶向肽活性可能产生对下游通路的阻断作用,从而导致系统性毒副作用;并能减少其发色团部分的细胞毒活性在正常组织器官中的蓄积,减缓发色团对肺和肾的强烈毒性损伤;而由于靶向肽的存在,DTLL 与力达霉素单独给药相比其半衰期增加,可能延长了其体内滞留时间,表现出延迟性毒性反应,故而使DTLL 仅表现为较为耐受的轻微损伤。同时,与传统ADC 药物相比,尽管DTLL 的靶向性稍弱于完整单抗偶联而成的ADC,但其半衰期较短,可通过多次重复给药而保持其疗效较好地发挥。这也体现了DTLL作为新型ADC类药物增效减毒的特性。当然,在后续临床试验中,还应密切实时地关注DTLL治疗后对各脏器、各项生化指标的影响,预防延迟毒性的发生。
此外,本研究还存在一些局限性。在急性毒性试验中,由于各给药组小鼠数量较少且大剂量组死亡较多,未发现各个检测指标与小鼠性别的相关性。但当亚急性毒性试验中大鼠数量较多时,发现雄性大鼠在体质量和摄食量方面对DTLL的敏感程度大于雌性大鼠,而对其他检测指标而言,并未发现指标变化与大鼠性别的联系,这有待进行后续研究,以确定药物毒性反应与动物性别间的相关系。
综上所述,DTLL 作为一种双特异性靶向肿瘤的新型抗体偶联药物,治疗剂量时具有强效抗肿瘤作用,但在毒性剂量时也存在着一定的毒副反应和延迟性毒性,且治疗剂量与毒性剂量差异较小,提示其治疗窗口较窄,在给药过程中一定要控制好DTLL 的给药剂量和时间,在确保疗效的同时尽可能地规避不良反应[13]。本研究结果为推进DTLL的临床研究提供了理论依据。
