3种寄生真菌发酵液对大豆胞囊线虫4号生理小种毒力研究
2020-04-14许艳丽鲁建聪
许艳丽,鲁建聪,宋 洁,2
(1.中国科学院 东北地理与农业生态研究所,黑龙江 哈尔滨 150081;2.哈尔滨商业大学,黑龙江 哈尔滨 150028)
0 引 言
大豆长期连作会使土壤产生对大豆胞囊线虫(Soybean cyst nematodes,SCN)的抑制性,即人们所说的“线虫抑制性土壤”[1-2],大豆是我国北方的优势作物,黑龙江省是我国大豆的最大产区,播种面积占全国的50%左右[3]。在大豆主产区由于种植历史悠久,大豆胞囊线虫病发生比较普遍,在大豆适宜种植区常连作或迎茬种植,近年“线虫抑制性土壤”这种现象在我国大豆产区也有报道[4-7],孙漫红等研究认为大豆胞囊线虫抑制性土壤中空胞囊数量增多是由食线虫真菌所致[8]。Crump认为大豆胞囊线虫病的土壤中雌虫寄生真菌有厚垣轮枝菌(Verticilliumchlamydosporium)等[9],孙玉秋等研究发现连作15 a和16 a豆田大豆胞囊线虫二龄幼虫(J2)虫口密度低于迎茬和轮作田,二龄幼虫被毛孢菌(Hirsutellaminnesotensis)寄生率均高于其他大豆茬口[10]。宋洁等分离了大豆22 a连作、3 a连作和22 a小麦-玉米-大豆轮作土壤中大豆胞囊线虫寄生真菌,发现22 a连作土壤中厚垣轮枝菌远高于3 a连作和22 a连作的土壤。在22 a连作和轮作土中可检测到淡紫拟青霉,但3 a连作土中则没有分离到该菌。连作22 a大豆田分离的大豆胞囊线虫卵寄生真菌中厚垣轮枝菌和淡紫拟青霉明显高于连作3 a和轮作,因此,认为厚垣轮枝菌和淡紫拟青霉是该抑制性土壤中的优势寄生真菌[11]。孙玉秋等在黑龙江省、吉林省等地的大豆田土壤中分离到的真菌中淡紫拟青霉最多[12]。王克宁等从辽宁省、吉林省、黑龙江省、河北省、内蒙古自治区和山东省等地区的大豆连作土壤中分离到了真菌19个属,也包括淡紫拟青霉、厚垣轮枝菌和镰孢菌属[12]。
随着研究的不断深入,人们逐渐将研究重点转移到这些寄生真菌对大豆胞囊线虫的抑制作用上。厚垣轮枝菌作为兼性寄生菌,可寄生在大豆胞囊线虫的各个虫态,自然条件下可控制植物寄生线虫种群密度,有报道厚垣轮枝菌在黑龙江省、吉林省和辽宁省大豆田为优势大豆胞囊线虫卵寄生真菌[13]。赵晓辉等离体研究认为,大豆胞囊线虫抑制性土壤中分离的厚垣轮枝菌对大豆胞囊线虫3号生理小种二龄幼虫有强烈致死作用[14]。范圣长等在我国北方大豆田土中分离出了厚垣轮枝菌,该菌对线虫胞囊寄生率达100%[15]。淡紫拟青霉菌也能寄生多种植物线虫的卵和幼虫等,该菌在代谢过程中产生抑制线虫活性的物质,以此抑制植物线虫卵孵化,并强烈抑制J2活性,减少植物线虫密度,被认为是重要的生防真菌[16]。孙漫红等报道了淡紫拟青霉M-14菌株代谢产物可强烈抑制大豆胞囊线虫卵孵化[17]。镰孢菌属(Fusariumspp.)是一类庞大真菌,可引起作物枯萎病和根腐病,该属的某些种也是植物病原物的生防菌。陈立杰等在6 a连作大豆田分离真菌,发现镰孢菌分离比例最高[18]。赵晓辉等也报道镰孢菌在大豆胞囊线虫抑制性土壤中和线虫胞囊上分离频率最高,其中禾谷镰孢菌(F.graminearum)和尖镰孢菌芬芳变种(F.oxysporumvar.,现更名为芬芳镰孢(Fusariumredolens))可明显抑制大豆胞囊线虫3号生理小种卵孵化,并对J2有致死作用[19]。在美国也有报道称镰孢菌是大豆胞囊线虫胞囊的优势寄生菌[20]。
我国以往研究寄生真菌对大豆胞囊线虫的抑制作用多是以3号生理小种为靶目标,但除3号小种外,其他小种在我国也有分布,其中4号小种在我国分布也很普遍,该小种主要分布在山西省、江苏省、山东省、河南省、河北省及安徽省等地[5],且4号生理小种毒性较强。因此,本研究旨在探讨北方分离的大豆胞囊线虫优势寄生真菌对在其他地区分布的4号小种毒性,明确寄生真菌对其抑制作用,采用大豆胞囊线虫优势寄生菌发酵液,测定对大豆胞囊线虫4号小种胞囊、卵孵化抑制和对二龄幼虫致死作用,为我国大豆生产中胞囊线虫的生物生态防控提供理论依据。
1 材料和方法
1.1 供试真菌和供试线虫
供试真菌有淡紫拟青霉(Paecilomyceslilacinus)4个菌株(P-1、P-V、P-40和P-E)、镰孢菌属(Fusariumspp.)4个菌株(F-1、F-5、F-9和F-V)和厚垣轮枝菌(Verticilliumchlamydosporium)4个菌株(V-25、V-1、V-2和V-21)。供试真菌菌株均由中国科学院黑土区农业生态重点实验室从大豆胞囊线虫抑制性土壤中分离、鉴定并保存。供试大豆胞囊线虫4号生理小种取自山西太原,在温室盆栽大豆苗上保存。
1.2 寄生真菌发酵原液制备
菌株活化供试培养基:马铃薯葡萄糖琼脂培养基(PDA)、马铃薯葡萄糖培养液(PDB)[21]。挑取供试菌株的菌丝在PDA培养基上活化7 d,然后打取直径4 mm菌块,接种到PDB培养液中,30 ℃、180 r·min-1震荡培养24 h,作为种子液。取种子液接种到PDB中,再以相同条件震荡培养5d,4 ℃离心20 min (10 000 r·min-1),用细菌过滤器对上清液过滤,成为寄生真菌发酵液原液[22]。
1.3 分离大豆胞囊线虫胞囊和卵及制备卵和二龄幼虫悬浮液
取盆栽大豆根围5~20 cm土进行线虫胞囊分离。将新鲜土在烧杯中加清水搅拌,然后浸泡1h后过套筛(20目和80目),将80目筛上残留物收集(用63%蔗糖)到离心管内,离心5 min(2 500 r·min-1),将残留物过滤,挑取成熟饱满的胞囊放4 ℃冰箱中保存备用。
饱满胞囊在套筛(200目和500目)中进行研磨,收集残留物,用0.5% NaClO溶液消毒,再用清水进行冲洗,用灭菌水制备成线虫卵悬浮液,浓度为5 000个·mL-1,放到4℃冰箱保存。
将保存的线虫卵放置在420目筛网布上,放入内装有0.4 mmol·L-1ZnCl2溶液的卵孵化池中,在25 ℃培养箱里孵化,根据试验要求制成相应浓度的J2悬浮液。
1.4 寄生真菌发酵原液和稀释液对大豆胞囊线虫胞囊孵化毒力测定
将分离出的新鲜饱满胞囊放置于24孔细胞培养板内(每孔放10个),在每孔里分别加入2 mL寄生真菌发酵原液、5×、10×、20×和50×稀释液,对照加灭菌水,3次重复,25 ℃培养箱中培养。每隔3d记录孵化出线虫数量,计算孵化抑制率。
线虫孵化抑制率(%)=(对照孵化线虫数-处理孵化线虫数)/对照孵化线虫数×100%
1.5 寄生真菌发酵原液和稀释液对大豆胞囊线虫卵孵化毒力测定
在细胞培养板中加入大豆胞囊线虫卵悬浮液,每孔加0.4 μL(约200粒),各孔再分别加入2 mL寄生真菌发酵液原液、5×、10×、20×和50×稀释液,以灭菌水为对照,3次重复,在25 ℃培养箱中培养。每隔3 d记录孵化出线虫数。并计算线虫孵化率和相对抑制率。
线虫孵化率(%)=孵化线虫数/供试卵数×100%
相对抑制率(%)=(对照孵化率-处理孵化率)/对照孵化率×100%
1.6 寄生真菌发酵原液和稀释液对大豆胞囊线虫J2毒力测定
在细胞培养板中加入大豆胞囊线虫J2悬浮液(每孔约加入50条),各孔里再加入2mL寄生真菌发酵液原液或5×、10×、20×和50×稀释液,以灭菌为对照,3次重复,25 ℃培养箱中培养。分别在1 h、6 h、12 h、24 h、48 h和72 h后记录线虫死亡数量,并计算线虫死亡率。
线虫死亡率(%)=死亡线虫数/供试线虫数×100%
1.7 数据统计与分析
采用Microsoft Excel 2007和SPSS 17.0进行数据分析及处理。
2 结果与分析
2.1 寄生真菌发酵液对大豆胞囊线虫胞囊孵化的毒力
2.1.1 寄生真菌发酵原液对大豆胞囊线虫胞囊孵化抑制作用。孵化处理20 d后对大豆胞囊线虫在真菌发酵原液中胞囊孵化调查显示,3个属寄生真菌发酵原液对线虫胞囊孵化均有抑制作用(表1)。对胞囊孵化抑制率在50.6%~85.6%;其中镰孢菌F-9菌株发酵液和淡紫拟青霉的P-E菌株发酵液的抑制率在相同菌中抑制率最高,分别是82.6%和85.6%,均与相同菌中其他3个菌株差异显著(P<0.05)。
2.1.2 寄生真菌发酵稀释液对大豆胞囊线虫胞囊孵化抑制作用。孵化20 d后对大豆胞囊线虫在寄生真菌发酵稀释液中胞囊孵化结果调查表明,12个菌株稀释液均对大豆胞囊线虫胞囊孵化有抑制作用(表2),其抑制作用随发酵菌液的稀释倍数升高而逐渐降低,5×稀释液的抑制作用较其他稀释浓度都强,50×稀释液的抑制作用最弱。5×稀释液中, F-9、P-E、V-25、V-2菌液抑制率都接近80%,显著高于相同菌的其他菌株;50×发酵稀释液对胞囊仍有抑制作用,抑制率范围在28.3%~39.3%。3种菌液里F-9、P-E和V-25在不同稀释倍数菌液中,都对胞囊孵化有明显的抑制作用。

表1 寄生真菌发酵原液中大豆胞囊线虫胞囊孵化抑制率Table 1 Hatch inhibition rates of SCN cyst in fermentation filtrates of parasitic fungi
注:数字后字母为Duncan′S新复极差测验结果,小写英文字母表示差异显著(P<0.05),字母相同为差异不显著。下同。
Note:Means in column followed by the same letter indicate no significant differences according to the Duncan′s multiple range test.The same is as below.
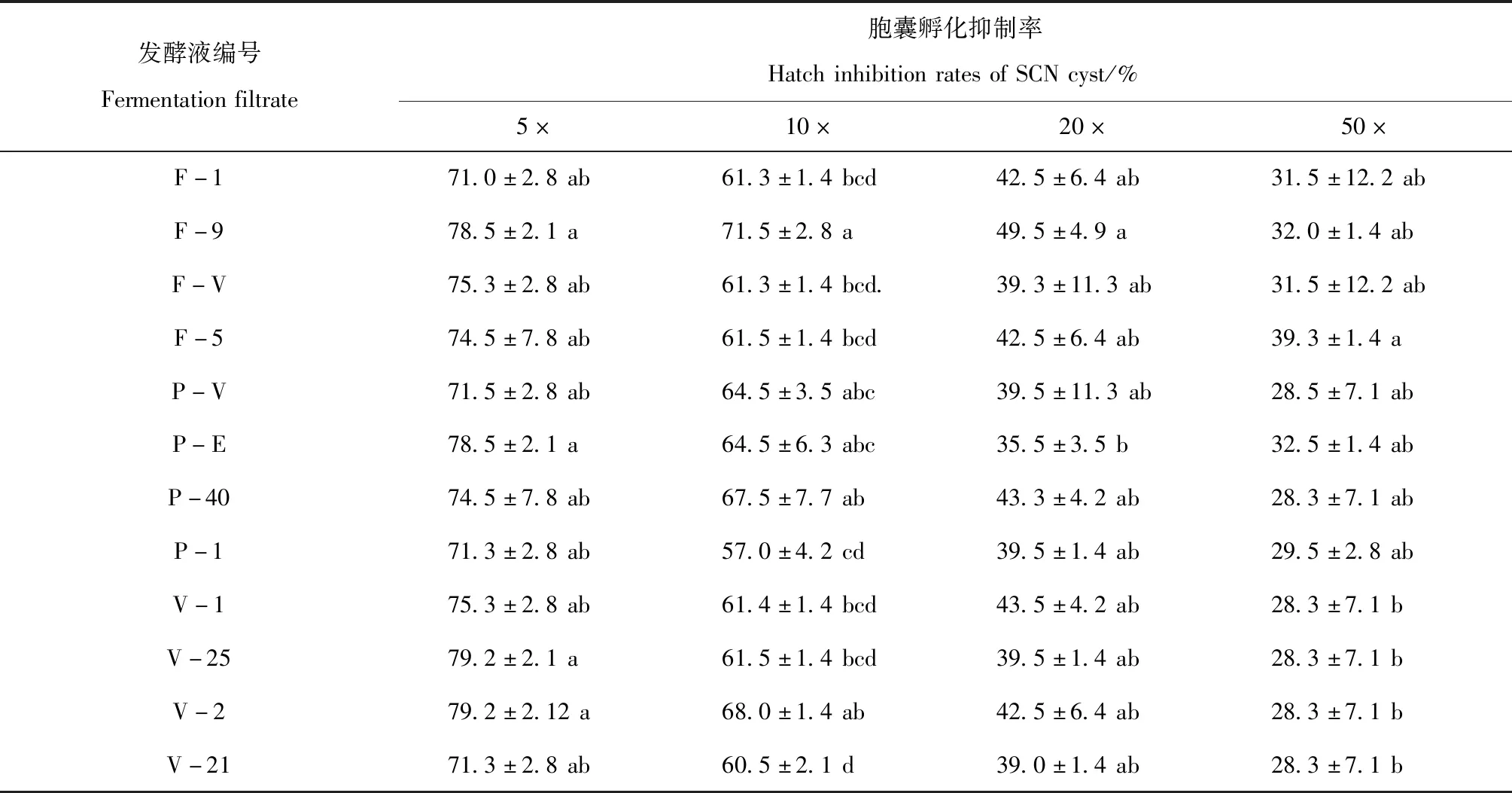
表2 寄生真菌发酵稀释液中大豆胞囊线虫胞囊孵化抑制率Table 2 Hatch inhibition rates of SCN cyst of race 4 in fermentation filtrate diluents of parasitic fungi
2.2 寄生真菌发酵液对大豆胞囊线虫卵孵化毒力
2.2.1 寄生真菌发酵原液对大豆胞囊线虫卵孵化抑制作用。处理20 d后对大豆胞囊线虫在寄生真菌发酵原液中卵孵化结果调查显示,12个寄生真菌菌株发酵原液对大豆胞囊线虫卵孵化均具有抑制性,在不同的发酵液之间,抑制作用不同(表3)。12个寄生真菌发酵原液卵孵化率在2.8%~4.4%,相对抑制率在51.3%~69.7%,卵孵化率均低于灭菌水(9.1%),且与灭菌水的卵孵化率存在显著差异(P<0.05);其中P-E和V-25的发酵原液卵孵化率最低,为2.8%,相对抑制率最高,为69.7%,与其他发酵原液相比存在显著差异,说明P-E和V-25发酵原液对大豆胞囊线虫卵孵化具有明显的抑制作用。
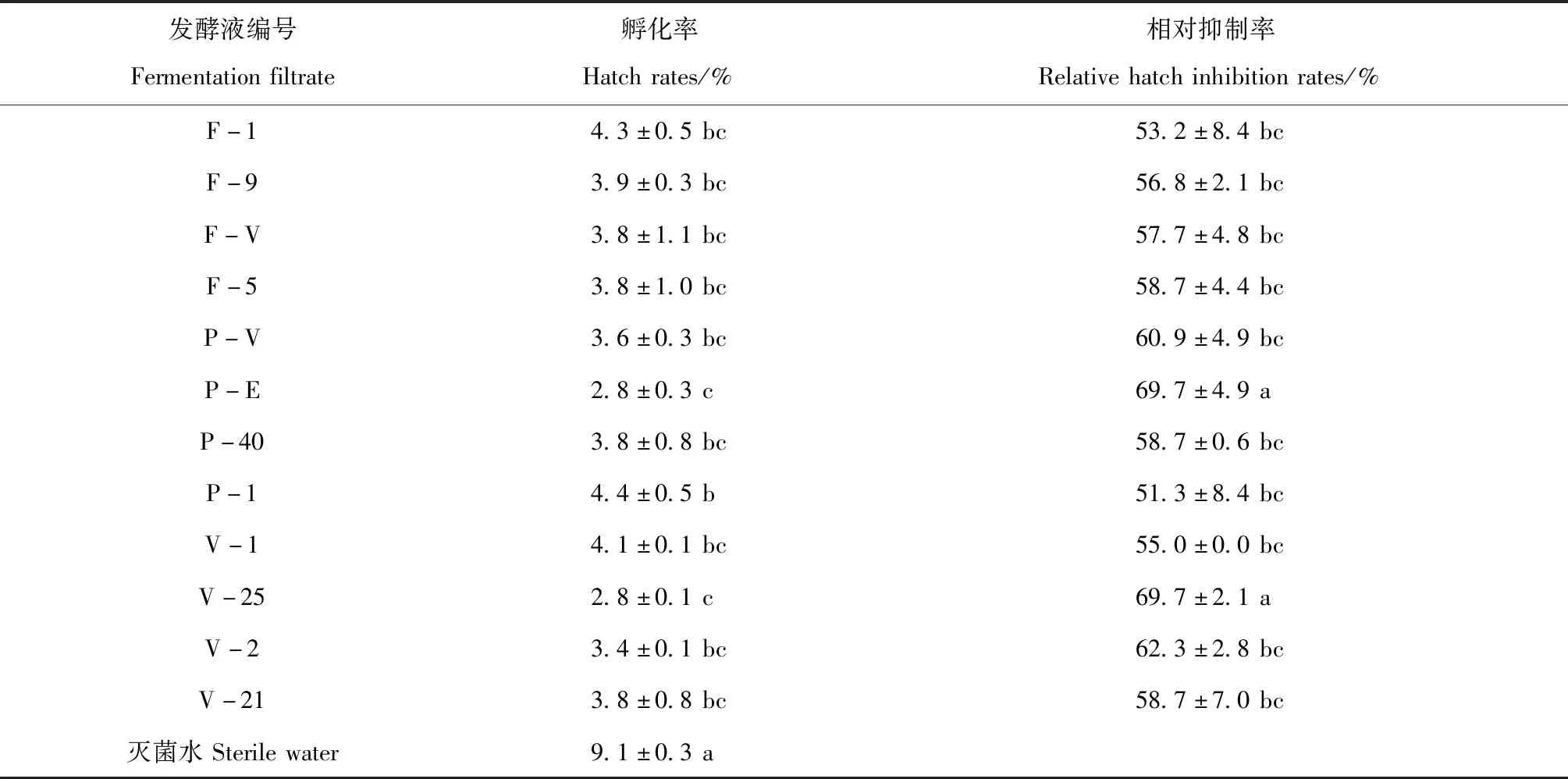
表3 寄生真菌发酵原液中大豆胞囊线虫卵孵化率和相对抑制率Table 3 Hatch rates and relative hatch inhibition rates of SCN eggs in fermentation filtrate of parasitic fungi
2.2.2 寄生真菌发酵稀释液对大豆胞囊线虫卵孵化抑制作用。处理20 d后对大豆胞囊线虫在寄生真菌发酵稀释液中卵孵化结果调查表明,卵孵化率随寄生真菌菌液稀释倍数的增加而升高(表4),卵孵化抑制率相反(表5)。5×稀释液中卵孵化量最低,相对孵化抑制率高,50×稀释液卵孵化量高,卵孵化抑制率低,但均与对照产生显著性差异(P<0.05)。
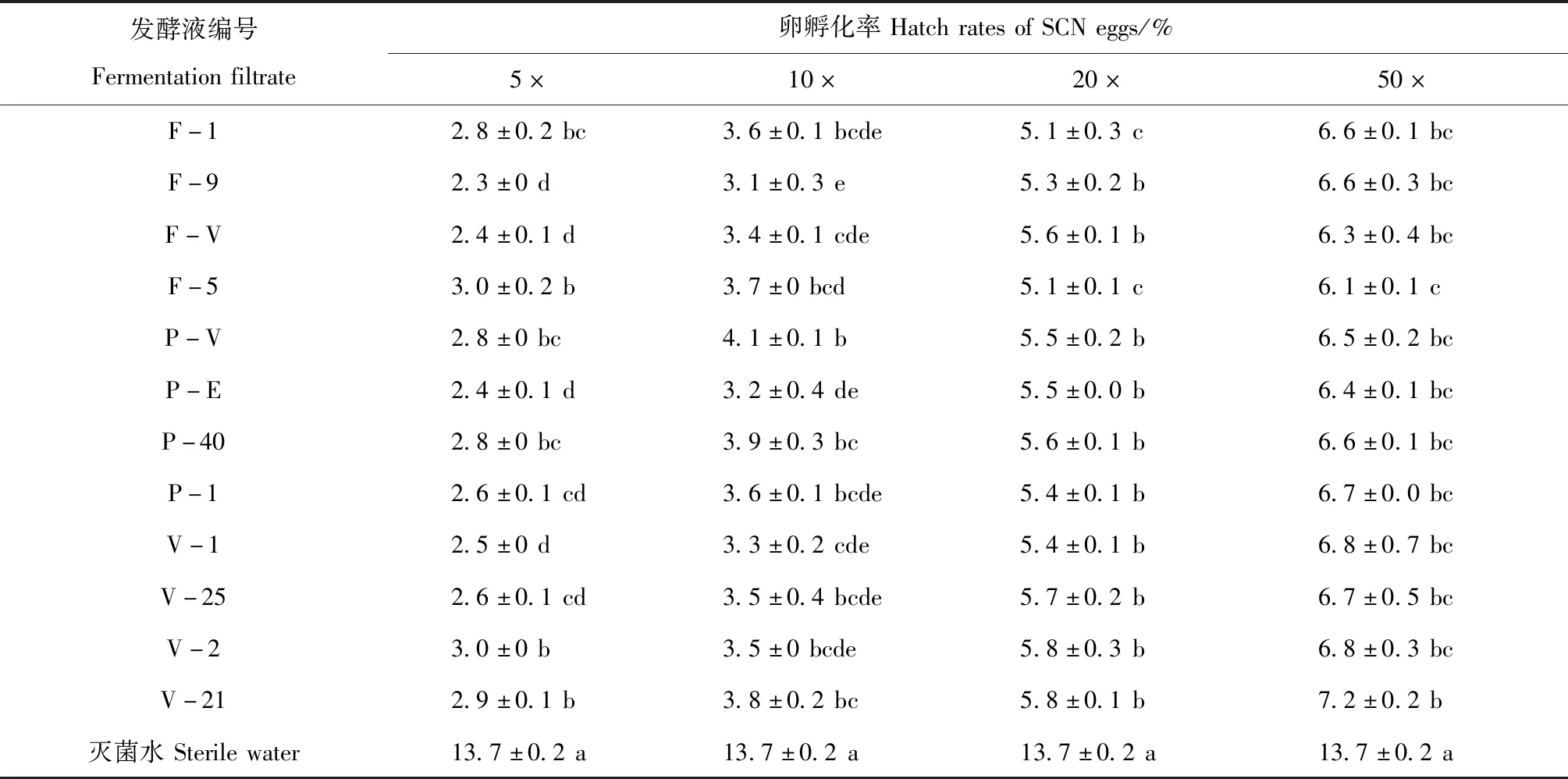
表4 寄生真菌发酵稀释液中大豆胞囊线早卵孵化率Table 4 Hatch rates of SCN eggs in fermentation filtrate diluents of parasitic fungi
5×稀释液中F-9发酵稀释液孵化率最低(2.3%),相对抑制率最高(83.0%),代谢物F-5、V-2孵化率均最高(3.0%),相对抑制率最低(78.0%)。而在50×稀释液中,V-21卵孵化率最高(7.2%),相对抑制率最低(47.6%),代谢物F-5孵化率最低(6.1%),孵化抑制率最高(55.5%)。10×菌液中,孵化率范围为3.1%~4.1%,相对抑制率范围70.1%~77.4%,20×稀释液中,孵化率范围在5.1%~5.8%,相对抑制率范围在57.9%~62.8%,各菌液的孵化抑制率和相对抑制率分布较为均匀,但均与对照孵化率13.7%差异显著(表4)(P<0.05)。
12株寄生真菌发酵液5×稀释液中,对大豆胞囊线虫卵相对抑制率达到78.0%以上, 50×稀释液中,卵相对抑制率都在47.6%以上,对卵孵化相对抑制作用显著。
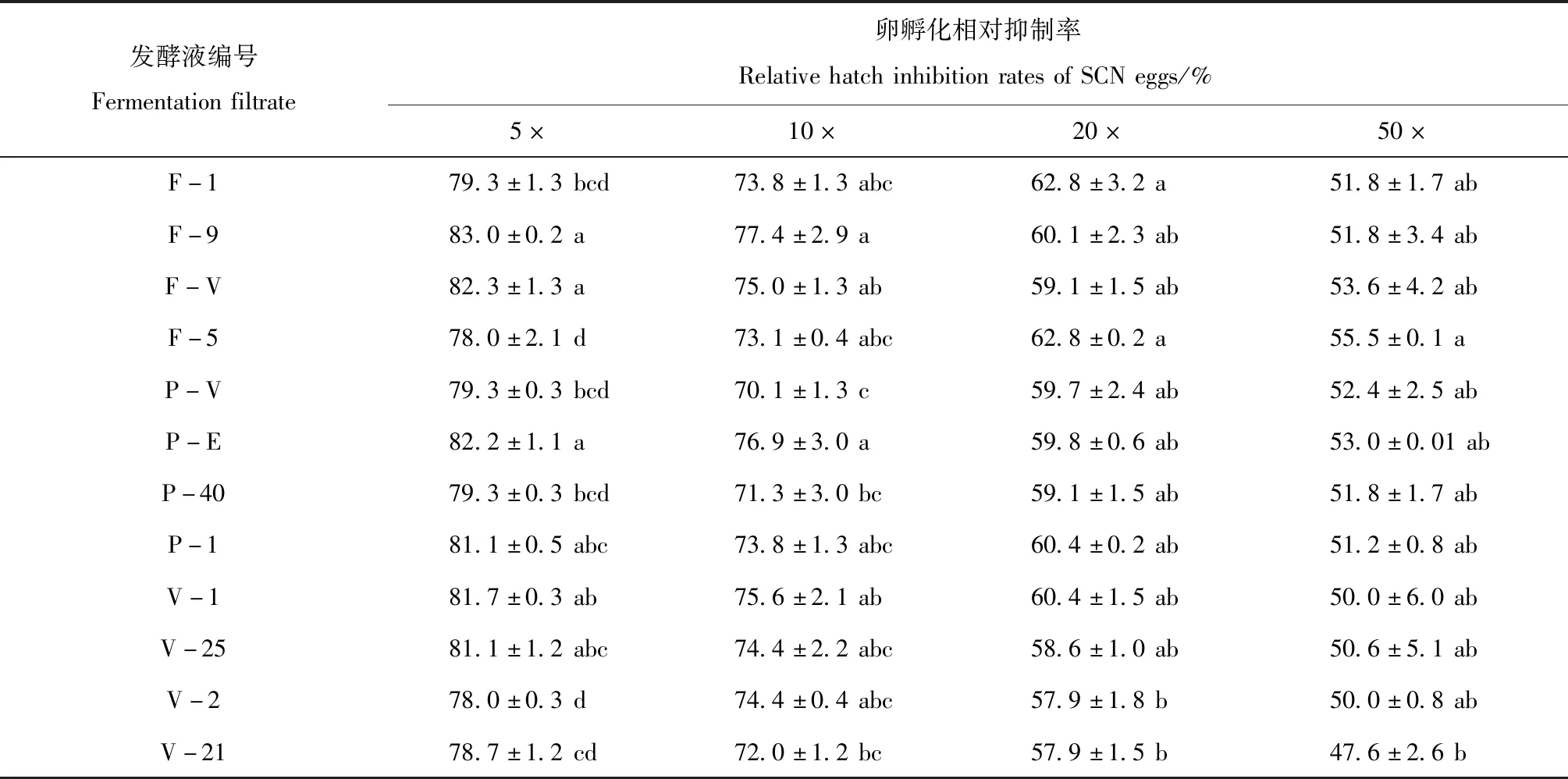
表5 寄生真菌稀释液中SCN卵孵化相对抑制率Table 5 Relative hatch inhibition rates of SCN eggs in fermentation filtrate diluents of parasitic fungi
2.3 寄生真菌发酵液对大豆胞囊线虫J2毒力
2.3.1 寄生真菌发酵原液对大豆胞囊线虫J2毒力。处理72 h后对大豆胞囊线虫在寄生真菌发酵原液中J2死亡率调查表明,灭菌水对照里J2在处理12 h时才有19%的死亡率,而处理1 h时,12株寄生菌发酵液里就有10株有J2死亡,说明它们对J2的击倒作用迅速;处理6 h开始12株寄生真菌菌株发酵液里都有J2死亡,之后12株寄生菌发酵液均对大豆胞囊线虫二龄幼虫致死作用高于灭菌水,并随着作用时间的延长抑制作用增强;在48 h时, F-9发酵原液中J2死亡率高达97.3%,与对照差异显著;在72 h时12株寄生菌发酵液的J2死亡率都在98%以上,其中在菌株F-9、F-V、P-E、P-V、V-25、V-2和V-21发酵原液中J2死亡率达到100%,12株寄生菌都与对照差异显著(表6)。
2.3.2 寄生真菌发酵稀释液对大豆胞囊线虫J2毒力。处理后对大豆胞囊线虫在寄生真菌发酵稀释液中J2死亡率调查表明,12个寄生菌株发酵稀释液对大豆胞囊线虫J2均具有致死作用,并随着发酵稀释液倍数的升高,J2的死亡率在降低,但随着作用时间的延长,J2死亡率逐步升高(7)。在不同的稀释倍数中,5倍稀释液毒力最高,50倍的最弱。
在处理1 h时5倍-20倍发酵稀释液中就有 J2出现死亡,6 h时所有12个菌株的5倍~50倍发酵稀释液中均有J2出现死亡,而此时灭菌水中仍没有出现J2死亡。灭菌水对照在12 h以后开始出现J2死亡,但死亡率远低于12个菌株。在12个菌株在12 h、24 h、72 h的5倍和10倍发酵稀释液里和48 h的5倍、10倍和20倍发酵稀释液里J2死亡率都明显高于对照,与灭菌水差异显著(P<0.05);12个菌株中F-9和V-25对J2致死作用明显,在24 h时,5倍稀释液中,J2死亡率达到50%以上,高于其他发酵稀释液。在72 h时,菌株F-9、P-E、V-25和V-21的5倍稀释液中J2死亡率已经达到了93%~96%,均与对照差异显著(P<0.05)。F-9、P-E、V-25发酵液在不同时段不同稀释倍数中对J2的抑制作用明显高于其他菌株。

表6 寄生真菌发酵原液中大豆胞囊线虫J2死亡率Table 6 Death rate of SCN J2 in fermentation filtrates of parasitic fungi
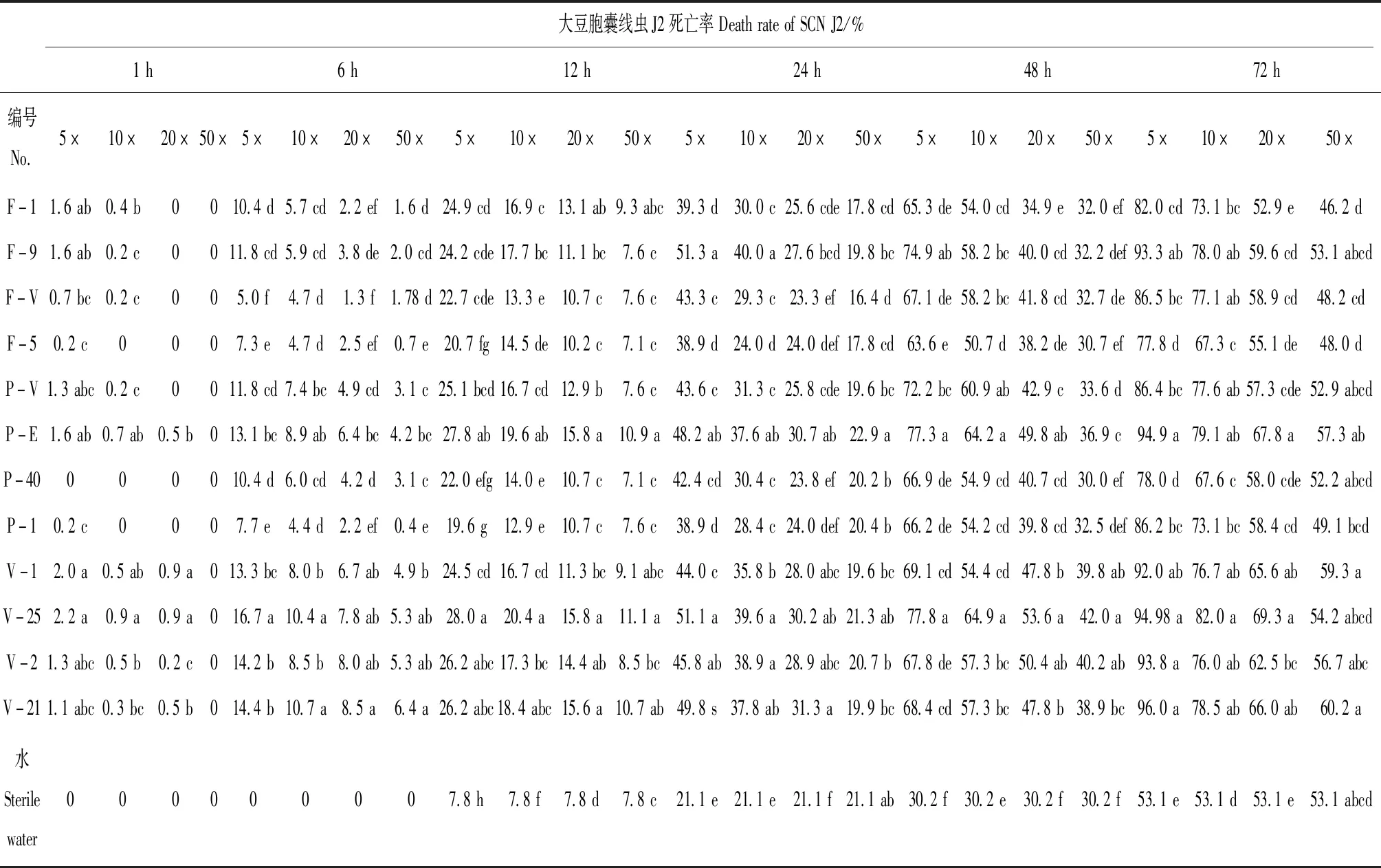
表7 寄生真菌发酵稀释液中大豆胞囊线虫J2死亡率Table 7 Death rate of SCN J2 in fermentation filtrate diluents of parasitic fungi
3 结论和讨论
供试的12株寄生真菌发酵液对大豆胞囊线虫4号小种都具有抑制作用,能够抑制其胞囊和卵孵化,并对二龄幼虫具有致死作用。其中,菌株F-9、P-E、V-25发酵原液及稀释发酵液对大豆胞囊线虫作用显著,胞囊孵化抑制率高的可达85%以上,稀释发酵液对卵孵化相对抑制率可达83.0%,对卵抑制作用高于对胞囊抑制作用。原液在72 h时,J2致死率达到100%,作用显著。
有关生防真菌代谢物(发酵液)对大豆胞囊线虫作用机制尚不完全明确,有报道代谢物产生酶类物质、产生毒素及其他对线虫有毒害的次生代谢物质[23],认为生防菌代谢物中存在具有抑制线虫或杀死线虫的活性物质。不同真菌产生不同的代谢产物,因此杀线活性也不尽相同。淡紫拟青霉菌可寄生胞囊线虫等多种植物病原线虫的各个虫态,并在代谢过程中产生具有杀线虫活性的物质,抑制线虫卵孵化,并强烈抑制二龄幼虫活性,从而控制线虫密度[16]。镰孢菌是一类庞大的真菌类群,种和同种菌株之间的特性也存在很大差异,在本研究中不同菌株间对大豆胞囊线虫抑制作用存在差异。Chen等[24]研究在大豆胞囊线虫胞囊上分离获得的茄腐镰孢菌(Fusariumsolani)的发酵液对二龄幼虫有毒力作用,而尖镰孢菌(F.oxysporum)对二龄幼虫和卵均没有抑制作用。试验中的3种寄生真菌对线虫的胞囊和卵孵化有抑制作用,也对二龄幼虫具有致死作用,在生防真菌中应用发酵液对胞囊孵化的作用尤为重要,胞囊可在土壤中长期存活,抑制其孵化即可抑制对寄主的侵染,守住第一道防线。生产上应用应以发酵液为主,活体菌剂虽然也有效,但应用量大,且易受土壤环境因素影响。因此,应加快开发寄生菌发酵滤液,促进病虫害生物防治技术,改善农田生态环境质量[25]。连作大豆田会引起大豆根际微生物群落结构的改变,近年我国在该领域研究取得了许多进展[26-27],还应在利用生态环境控制作物土传病虫害上开展深入研究,为大豆胞囊线虫等植物寄生线虫的生物生态控制提供理论依据。
致谢
感谢山西省农业科学院经济作物研究所刘学义研究员提供大豆胞囊线虫4号生理小种。
