大豆灰霉病和黑斑病拮抗菌株的筛选和鉴定
2020-04-13卢宝慧田春杰
吉 丽,田 磊,卢宝慧,田春杰
(1.中国科学院 东北地理与农业生态研究所 黑土区农业生态重点实验室,吉林 长春 130102;2.中国科学院大学,北京 100049;3.吉林农业大学 中药材学院,吉林 长春 130117)
0 引 言
大豆是我国重要的粮油兼用作物,在种植业结构中占有重要地位[1]。大豆病害中以真菌病害为主[2]。其中,葡萄孢属真菌(Botrytiscinerea)可引起豆科、茄科、葫芦科及蔷薇科等400余种植物患灰霉病[3-4],当大豆感染灰霉病时,叶片初期会出现小褐色病斑,随后逐渐发展成周边褐色、中部灰色或灰褐色的圆形或椭圆形以及其他不规则形状的病斑[5]。而半知菌亚门链格孢真菌(Alternariasp.)不仅会在大豆整个生长时期侵染大豆植株,引起大豆黑斑病病害,在人参、柑橘、甘蓝、枣果、黄瓜及月季等植物上均具有致病性[6-11]。从已有的报道得知,大豆灰霉病在北方居多,而大豆黑斑病在吉林省、辽宁省、黑龙江省、江苏省及四川省等省份均有发生[12]。虽然我国耕地面积只有全世界的8%,但化学农药用量却占全球35%,位居世界第一[13],而目前控制大豆灰霉病和黑斑病的主要方法仍是以化学杀菌剂为主。化学农药虽在短时间内会产生良好的经济效益,但随着时间推移它所引起的诸多问题也日益显现[14]。鉴于农残隐患以及绿色有机农业发展需求,生防菌剂的开发和应用迫在眉睫。其中部分生防菌如多粘类芽孢杆菌、解淀粉芽孢杆菌、假单胞菌、以及酵母菌、木霉菌和链霉菌等良好的生防效果已得到验证[15-20],并且对植物的生长还有一定促进作用。
在不同病原菌引起的植物侵染性病害中,约有70%的病害是由真菌引起的[21]。而真菌细胞壁的3%~60%是由几丁质构成的[22]。因此,本研究以筛选分解真菌细胞壁的重要成分几丁质为出发点,利用平板对峙法进一步筛选对大豆灰霉病和黑斑病有抑制作用的拮抗菌株,期望为开发具有应用价值的生防菌剂以及生物农药奠定基础,促进绿色有机农业的发展,也为后续高效的生防菌剂开发奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种来源。灰霉病(Botrytiscinerea)病原菌与黑斑病(Alternariatenuissima)病原菌[23-26]由吉林农业大学植物病理系高洁教授提供。
1.1.2 培养基。几丁质培养基:K2HPO41 g,MgSO4·7H2O 0.5 g,NaCl 0.5 g,NH4Cl 1 g,琼脂15 g加蒸馏水定容至1 000 ml,其中每80 ml几丁质培养基中加入20 ml浓度为1%胶体几丁质。PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂15~20 g,蒸馏水1 000 ml,pH自然。发酵培养基:葡萄糖10.0 g,酵母浸膏7.5 g,加蒸馏水定容至1 000 ml。
1.2 试验方法
1.2.1 土壤样品采集。采用五点取样法,收集江西省东乡地区(116°61′E,28°23′N)野生稻的根际土于无菌自封袋内,放于室温内备用。
1.2.2 拮抗菌株的分离、纯化。采用平板稀释涂布法,称取5 g土样放于装有45 ml无菌水的三角瓶中,120 rpm,震荡20 min后静置5 min,取上清进行10倍浓度梯度稀释。分别取10-1、10-2及10-3浓度的稀释液各80 μL,每个梯度涂布3个几丁质培养基平板,用无菌水代替稀释液做空白对照。倒置于25 ℃培养箱中培养2~3 d,观察菌落的生长及透明圈产生情况。
在几丁质培养基上,挑选透明圈较大但形态、颜色等不同的菌落,进行平板划线,直至菌落单一,编号,4 ℃冰箱保存。
1.2.3 拮抗菌的筛选。采用平板对峙法,测定拮抗菌株对黑斑病和灰霉病的抑菌活性。先将灰霉病和黑斑病在PDA平板上进行活化,挑选长势旺盛的灰霉病和黑斑病病原菌平板,用打孔器制成直径为7 mm的菌饼,倒置于PDA平板,将拮抗菌菌饼接种在距病原菌约2 cm处,其中以不接拮抗菌的平板为对照,每组3个重复,置于26 ℃下恒温培养箱中培养2~6 d,观察抑菌圈的大小。并在第2 d、4 d、6 d的时候记录病原菌的菌落最小半径以及对照菌落的半径,计算抑菌率。
抑菌率(%)=(对照菌落半径-病原菌菌落半径)/对照菌落半径×100
将初筛得到抑制效果较好的菌株的菌饼接种于121 ℃下高压灭菌过的发酵培养基中,置于26 ℃摇床,160 rpm恒温震荡48 h后,三层无菌纱布过滤,将不同菌株的滤液5 000 rpm离心5 min后收集菌体,无菌水洗涤2次后重悬浮无菌水中,血球计数板测定浓度并将其稀释浓度为107cfu·mL-1,备用。
1.2.4 菌株发酵液和化学农药对灰霉病和黑斑病抑制效果比较。农药稀释液制备:将市售灰霉病特效素(北美农大)和50%苯醚甲环唑(北美农大)按照使用说明分别对灰霉病特效素和苯醚甲环唑进行250倍稀释和500倍稀释。
拮抗试验:分别取100 μl 拮抗菌的发酵滤液、250倍灰霉病特效素稀释液、500倍灰霉稀释液、250倍苯醚甲环唑稀释液及500倍苯醚甲环唑稀释液涂布于PDA平板,平皿中央分别接种7 mm活化后的灰霉病和黑斑病病原菌菌饼,以无菌水为对照,每组3个重复,26 ℃下恒温培养,在第2 d、3 d、4 d、5 d测量病原菌的直径,计算抑菌率。
抑菌率(%)=(对照菌落直径-病原菌菌落直径)/对照菌落直径×100%
1.3 菌株鉴定
1.3.1 菌落形态观察与生理生化鉴定。参照《常见细菌系统鉴定手册》和《伯杰系统鉴定手册》中推荐的部分培养基和方法,对拮抗菌株进行形态学观察及生理生化鉴定,其中主要包括硝酸盐还原试验、接触酶反应、甲基红反应、V-P测定、淀粉水解、明胶液化、硫化氢反应、吲哚反应及耐盐性(2%、5%、7%和10%)。
1.3.2 16S rDNA序列扩增及系统发育分析。利用CTAB方法提取菌株的基因组,进行16S rDNA的扩增。PCR通用引物27 F(5′-AGAGTTTGATCCTGGCTCAG-3′),1492 R (5′-GGTTACCTTGTTACGACTT-3′),反应体系25 μl,Premix version 2.0 12.5 μl,27 F (10 μM) 1 μl,1492 R(10 μM)1 μl,DNA模板1 μl,无菌水补足至25 μl。反应条件为:94 ℃预变性4 min;94 ℃变性30 s,56 ℃退火50 s,72 ℃延伸90 s,35个循环;72 ℃终延伸10 min。扩增产物送到生工生物工程(上海)股份有限公司进行测序,所得序列上传到GenBank数据库。通过Blast分析与基因库中序列进行同源性比对,并用Mega 5.1软件中Neihbor-Joinhing构建系统发育进化树。
1.4 数据分析
应用Excel 2003和Graphpad Prism 6结果统计和数据处理。
2 结果分析
2.1 拮抗菌的分离筛选
利用几丁质培养基,从江西省东乡野生稻根际土壤中获得64株产透明圈较大的可分解几丁质的菌株。通过平板对峙法测定了拮抗菌株与灰霉病、黑斑病的拮抗效果,其中有5株拮抗菌(A2、A6、A10、F7和G6)对灰霉病和黑斑病有稳定的拮抗效果(图1,图2)。通过第2 d、4 d、6 d对灰霉病和黑斑病菌落半径的测量,得出抑菌率。从表1可知,拮抗菌株对灰霉病与黑斑病均有抑制作用,虽效果不同,但整体随着拮抗天数增加呈上升趋势。其中菌株A2和G6对灰霉病表现出较强的抑制作用,在2~6 d,拮抗作用分别高于78.3%和77.5%。对于黑斑病,菌株A2、F7和G6相对优势更加明显,对黑斑病的抑制率分别达78.7%、77.47%和79.9%。
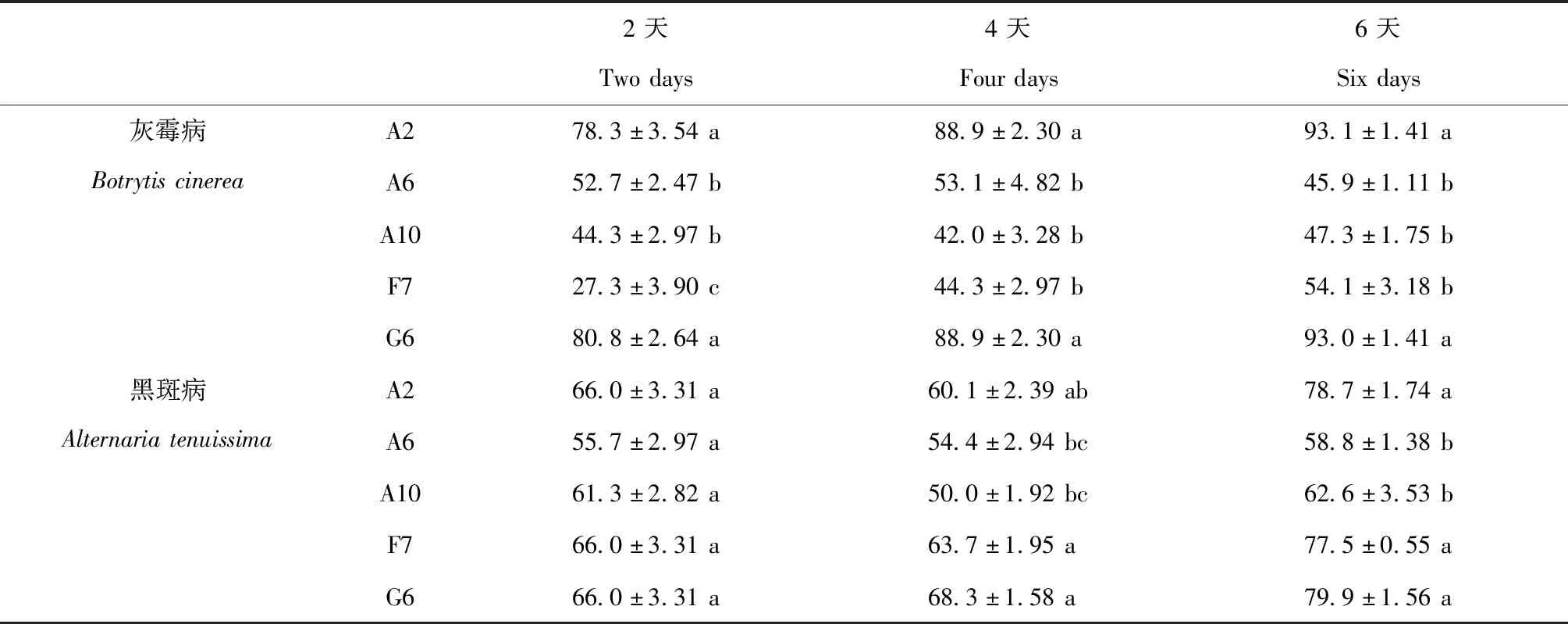
表1 不同天数拮抗菌株对灰霉病和黑斑病的抑制率(%)Table 1 Inhibition rates of antagonistic strains on Botrytis cinerea and Alternaria tenuissima in different days
注:数据为均值±标准差;同列数据后面的不同字母表示在0.05水平上差异显著(P<0.05);灰霉病和黑斑病是分开比较的。
Note:The data in the table is mean value±SD;Different letters in the same column indicate significant differences at 0.05 level(P<0.05);BotrytiscinereaandAlternariatenuissimaare compared separately.
2.2 菌株发酵液和化学农药的抑菌效果
随着天数的增加,拮抗菌的抑菌作用越来越强,而化学农药的抑菌效果则越来越弱。在第5 d时,拮抗菌株对灰霉病的抑制率能达到91.7%,而灰霉病特效素对灰霉病的抑制作用,随着天数的增加而降低,第2 d的抑制效果最佳为68%(图3)。从拮抗菌与苯醚甲环唑对黑斑病的抑制作用结果(图4)可知,A2、F7和G6随着天数增加,对黑斑抑制效果整体呈现上升趋势,分别在第5 d时,抑制效果达83.3%、86.7%和85.7%。A6在第4 d抑制效果最佳达87.0%,而A10在第5 d的抑制效果最佳为60.9%。苯醚甲环唑随着天数的增加抑菌效果逐渐降低,第2 d的抑制最好为47.3%。
2.3 拮抗菌生理生化特性及16S rDNA序列分析
生理生化试验测定结果表明,菌株A2属于接触酶阴性,菌株A6、A10、F7和G6属于接触酶阳性,菌株A2、A6、A10、F7和G6对甲基红反应、V-P反应以及吲哚反应均为阴性,不产生硫化氢,明胶液化和淀粉水解均为阳性,对NaCl的耐受性较高,在10% NaCl含量下仍能生长(表2)。

表2 拮抗菌的部分生理生化特性Table 2 Physiological and biochemical characteristics of antagonistic bacteria
注:“-”代表阴性,“+”代表阳性。
Note:“-” indicates negative,“+” indicates positive.
菌株A2、A6、A10、F7和G6经DNA测序后分别得到1431 bp、1422 bp、1438 bp、1431 bp和1428 bp序列。将DNA序列在NCBI数据库Blast比对后,经Mega 5.1构建系统进化树如图5所示,其中A2与Streptomycesmisionensis、Streptomycesbacterium、Streptomycessp.的聚类到一起;A6、A10、F7、G6分别与Micromonosporapurpureochromogenes、Paenibacillussp.、Streptomycesansochromogenes、Streptomycessp.和Streptomyceshygroscopicus聚类到一起。结合菌株的生理生化特征,将A2鉴定为Streptomycesmisionensis(米修链霉菌);A6鉴定为Micromonosporapurpureochromogenes(绛红产色小单孢菌);A10鉴定为Paenibacillussp.(类芽孢杆菌);F7鉴定为Streptomycesansochromogenes(圈卷产色链霉菌);G6鉴定为Streptomycessp.(链霉菌)。
3 讨 论
当前,植物病害防治措施已从单纯依赖化学防治逐渐转变为环境友好及经济效益较高的生物防治[27]。分离筛选具有良好的环境适应性、广谱抗菌和拮抗效果稳定的生防菌,是生物防治成功的关键步骤[28]。由于几丁质是构成病原真菌细胞壁的主要成分[29],而真菌生长条件相对简单且周期短[30],因此通过破坏真菌细胞壁骨架,从而影响真菌形态建成、生长发育和致病力可作为对抗真菌病害的有效途径之一[31]。本文通过从江西省东乡野生稻根际土壤中分离筛选了64株可分解几丁质的菌株,在64株菌株中经平板对峙试验,反复筛选,获得5株对灰霉病和黑斑病有稳定拮抗作用的菌株即A2、A6、A10、F7和G6。其中菌株A2、G6对灰霉病的拮抗效果相对较好,拮抗作用在93.0%之上;A2、F7和G6对黑斑病的拮抗作用相对较好,拮抗作用在77.0%之上。另外,5株菌的发酵滤液与市售化学农药比较,均表现出较好的抑菌效果。且随着作用天数的增加抑菌效果逐渐增强,如若将发酵滤液中的抑菌物质有效分离提取,生物农药将有望替代化学农药,对于抑菌物质的研究也是未来的研究热门。
根据菌株的生理生化特征以及16S rDNA分子测序技术,鉴定这5株菌分别为:米修链霉菌(Streptomycesmisionensis)、绛红产色小单孢菌(Micromonosporapurpureochromogenes)、圈卷产色链霉菌(Streptomycesansochromogenes)、链霉菌(Streptomycessp.)和类芽孢杆菌(Panenibacillussp.)。以上菌株在生物防治以及医药领域方面的贡献均有一定报道,如王真真等的研究证明了米修链霉菌对水稻稻瘟病具有良好防治作用[32],鹿连明等的研究中验证了米修链霉菌对柑橘青霉病菌和绿霉病菌的抑制作用[33]。小单胞菌是一类分布广泛可产生多种抗生素的稀有放线菌[34],其中绛红产色小单胞菌是庆大霉素B的主要产生菌[35],庆大霉素作为广谱抗生素在我国医药行业中有着至关重要的作用,因此绛红产色小单胞菌的开发和应用潜力巨大;圈卷产色链霉菌是尼可霉素的产生菌[36],尼可霉素是抗真菌农用抗生素有效成分之一[14],作为几丁质合成酶的抑制剂是新一代的抗真菌药物[37]。链霉菌是最主要的抗生素产生菌[38],其多种次级代谢产物在农业生产以及医药、食品等行业广泛应用[39]。类芽孢杆菌对细菌土传病害有较好的抑制效果,在真菌病害中,如番茄灰霉病、青枯病及烟草赤星病等均有良好的防治效果[40-41],王波的研究中发现多粘类芽孢杆菌XZ-2发酵液可以明显抑制大豆疫霉病菌、大豆炭疽病菌和大豆菌核病菌的菌丝生长[42]。因此本研究筛选鉴定的5株菌期望为生防菌的开发利用提供一定的技术支撑。
4 结 论
(1)菌株A2、A6、A10、F7和G6对灰霉病与黑斑病均有不同程度的抑制作用;(2)菌株发酵液对大豆灰霉病、黑斑病的抑制率高于化学农药灰霉病特效素和50%的苯醚甲环唑;(3)5株菌分别为:米修链霉菌(Streptomycesmisionensis)、绛红产色小单孢菌(Micromonosporapurpureochromogenes)、圈卷产色链霉菌(Streptomycesansochromogenes)、链霉菌(Streptomycessp.)和类芽孢杆菌(Panenibacillussp.)。
