磁性多壁碳纳米管固相萃取-液质联用法测定植物油中的黄曲霉毒素B1
2020-04-12吴静娜杨秀娟韦璐阳蒋越华农耀京
吴静娜 杨秀娟 韦璐阳 蒋越华 农耀京

摘 要:以化学共沉淀法制备的MWCNTs-Fe3O4为磁性吸附剂,结合高效液相色谱串联质谱测定植物油中的黄曲霉毒素。样品加入正己烷后,用pH=3.0、体积分数为12.5 %的乙腈—水溶液提取,最后加入MWCNTs-Fe3O4进行磁性固相萃取。优化了萃取剂、吸附剂用量、吸附时间、洗脱剂、洗脱时间等磁性固相萃取条件。结果表明,黄曲霉毒素AFB1其线性范围内线性关系良好,相关系数为0.9987,方法检出限为0.01 μg/kg,定量限为0.04 μg/kg。在样品中分别添加水平为5,10 和 20 μg/kg 的AFB1,回收率为81.5 %~104.5 %,相对标准偏差为1.5 %~4.3 %。该方法简便、快速、准确,可用于植物油中黄曲霉毒素AFB1的检测。
关键词:磁性固相萃取 黄曲霉毒素 多壁碳纳米管 高效液相色谱串联质谱
中图分类号:O657 文献标识码:A
Abstract:Aflatoxins in vegetable oil were determined by HPLC tandem mass spectrometry with MWCNTs-Fe3O4 which prepared by chemical co-precipitation as magnetic adsorbent. After adding n-hexane,the samples were extracted by acetonitrile-water solution with a pH of 3.0 and a volume fraction of 12.5%,and purified by MWCNTs-Fe3O4. The magnetic solid phase extraction conditions such as extraction agent,adsorbent dosage,adsorption time,eluent and eluent time were optimized. The results showed that aflatoxin AFB1 had a good linearity with the correlation coefficient of 0.9987. The LOD was 0.01μg/kg and the LOQ was 0.04μg/kg. The average recoveries at spiked levels of 5,10,20 μg/kg ranged from 81.5% to104.5% with relative standard deviations between 1.5% and 4.3%. The method is simple,rapid and accurate for the determination of AFB1 in vegetable oil.
Key words:Magnetic solid phase extraction;aflatoxin;multi-walled carbon nanotubes; HPLC-MS/MS
真菌毒素的污染已经成为食品安全关注的热点。玉米、花生、大米及植物油脂等粮油农产品及其制品在生产、流通、储存过程中由于易污染产生黄曲霉毒素及其代谢物。目前发现的黄曲霉毒素中,毒性最强的是黄曲霉毒素B1(AFB1),被世界卫生组织的癌症研究机构认定为 I 类致癌物[1-2]。随着食品安全管控越来越严格,世界各国对AFTs制定了严格的限量标准[3],其中日本要求最为严格:所有食品中均不能检出黄曲霉毒素;欧盟对不同类食物中AFB1的限量值为2.0~8.0 μg/kg;我国的限量标准[4]要求谷物及其制品、糧油中AFB1的限量值为5.0~20.0 μg/kg。
黄曲霉毒素的标准检测方法[5]主要为高效液相色谱法[6]、同位素稀释液相色谱—串联质谱法[7-8]和酶联免疫吸附测定法[9]。这些方法各有其优缺点,质谱法尽管灵敏度高,但是往往需要经过繁琐的前处理减少机制干扰;酶联免疫分析耗时短,但抗体价格高、种类少,假阳性检出率高等。植物油中的黄曲霉毒素由于浓度低且基质里含有的油脂、脂肪酸和色素等,会对测定造成严重干扰,降低分析的灵敏度[10]。因此,亟需建立一种同时检测和分离富集黄曲霉毒素的样品前处理方法。
磁性固相萃取(MSPE)技术[11]是一种快速高效的前处理方法。本研究在羧基化多壁碳纳米管的基础上合成MWCNTs-Fe3O4磁性纳米颗粒,利用多壁碳纳米管的π-π相互作用、氢键相互作用等作用力使黄曲霉毒素AFB1从基质中分离和富集。该法具有快速、简便、回收率高等特点,能够满足植物油中AFB1的检测分析,具有一定的实用价值。
1 材料与方法
1.1 主要仪器与试剂
超高压高效液相色谱仪(日本岛津公司);AB SCIEX-API3200 三重四级杆串联质谱仪(美国AB SCIEX公司);Thermo Helios G4CX电子显微镜(美国Thermo Scientific 公司);聚焦离子束纳米制备和加工系统(德国CarlZeiss公司);振荡培养箱(上海知楚仪器有限公司);真空干燥箱(天津市泰斯特仪器有限公司);加热磁力搅拌器(德国IKA公司);多壁碳纳米管(—COOH,20~30 nm,>98%,中国科学院成都有机化学有限公司);甲醇、乙酸乙酯、丙酮、乙腈、二氯甲烷(色谱纯,美国 Thermo Fisher公司);FeCl3·6H2O,FeCl2·4H2O、NaOH(分析纯,国药集团化学试剂有限公司);黄曲霉毒素AFB1标准品(青岛普瑞邦生物工程有限公司)。
1.2 WCNTs-Fe3O4的制备
采用共沉淀法制备WCNTs-Fe3O:称取5.2 g FeCl3·6H2O和2.0 g FeCl2·4H2O溶于25 mL除氧水中,加入1.0 mL 12 mol/L HCl加熱溶解,配置成Fe3+溶液备用。于250 mL 1.5 mol/L NaOH溶液加入2.0 g羧基化多壁碳纳米管(WCNTs-COOH),转入三颈烧瓶中,于85 ℃ 水浴(N2保护)加热超声搅拌30 min后,将Fe3+溶液逐滴加入生成MWCNTs-Fe3O4,用强磁铁吸附生成的WCNTs-Fe3O4纳米颗粒,弃去反应液,然后用去离子水清洗直至pH=7.0。最后将此磁性吸附材料于50 ℃真空干燥24 h,备用。
1.3 标准溶液的配制
混合标准曲线的工作配制:分别配制上机浓度为1.0、5.0、10.0、20.0、50.0 μg/L的AFB1标准溶液。
1.4 色谱条件
色谱柱:Shim-pack XR-ODSⅡ十八烷基硅烷键合硅胶色谱柱(2.0 mm×75 mm×2.2 μm);柱温:40 ℃;进样体积:5.0 μL;流速:0.30 mL/min;流动相采用不同比例的乙腈和0.1 %甲酸水溶液。梯度洗脱条件:0.01 min,V(乙腈)∶V(0.1%甲酸)为2∶98;5.00~5.50 min,V(乙腈)∶V(0.1%甲酸)为75∶25;8.00 min,V(乙腈)∶V(0.1%甲酸)为2∶98。
1.5 质谱条件
质谱条件:电喷雾电压:5500.0 V,离子源温度:550 ℃,气帘气压力55 psi,雾化气压力55 psi,加热气压力55 psi。电喷雾离子源(ESI),采用正离子MRM多反应监测扫描, AFB1母离子及子离子见表1。
1.6 样品前处理
称取植物油5.0 g,加入2.0 mL正已烷,混匀3 min后,再加入10.0 mL pH为3.0体积分数为12.5%乙腈水溶液,涡旋混匀,加入15.0 mg MWCNTs-Fe3O4,低速振荡吸附5 min,用强磁铁吸附磁性吸附剂,弃去上清液。加入1.0 mL乙腈振荡洗脱5 min。洗脱液氮吹近干,用甲醇定容至1.0 mL,HPLC-MS/MS上机检测。
2 结果与讨论
2.1 吸附剂MWCNTs-Fe3O4扫描电镜测试
将1.2所制备的MWCNTs-Fe3O4纳米颗粒经电镜扫描测定如图1所示,由图可知,该磁性纳米颗形状为球形,平均粒径为38 nm。
2.2 磁性固相萃取条件的优化
2.2.1 萃取剂的选择
黄曲霉毒素AFB1属于中等极性化合物,易溶于甲醇、乙腈和三氯甲烷等有机溶剂,本实验对比了12.5%甲醇—水、甲醇、12.5%乙腈—水、乙腈作为萃取剂时的萃取效果,萃取效率对回收率的影响见图2。由图可知,12.5%的乙腈-水提取效果最好,可能原因是适量的水能增大萃取剂在样品中的渗透能力,甲醇和乙腈浓度过高时,萃取剂与吸附剂间的竞争加强,造成回收率降低。因此本实验选择12.5%的乙腈—水体系作为萃取剂。
2.2.2 萃取剂pH的影响
AFB1在酸性条件下能稳定存在,因此需要对萃取剂的酸度选择进行优化,以保证萃取效率。本实验将12.5%乙腈—水萃取剂的pH分别调至1.0,2.0,3.0,4.0,5.0,6.0,7.0,pH对回收率的影响见图3。结果表明,pH在3.0到5.0时,AFB1的回收率均能达到80%以上, pH 为3.0时回收率最高。pH值继续增大,回收率开始降低,原因可能由于碱性增强使部分AFB1分解造成的。因此,本实验选择萃取剂的pH为3.0。
2.2.3 吸附时间的影响
在pH=3.0的12.5% 乙腈—水作为萃取剂的条件下,考察了吸附时间分别为1,3,5,10,15 min时对AFB1回收率的影响。结果见图4。由图可知,1 min至5min 时,AFB1的回收率随着时间增加而增大,回收率达到85%~95%间,基本达到吸附平衡。5min之后,AFB1的回收率基本不再变化。因此,吸附时间选择为5 min。
2.2.4MWCNTs-Fe3O4吸附剂用量的影响
吸附剂的用量也对萃取效率产生显著影响。本实验分别考察了吸附剂用量为1.0,5.0,15.0,20.0, 30.0 mg时的萃取效果。实验结果见图5,随着吸附用量的增加,AFB1的回收率逐渐增大,直至达到吸附平衡,此时吸附剂用量为15.0 mg。随着吸附剂用量继续增加,AFB1的回收率有下降的趋势,其原因可能是由于吸附剂用量大,容易造成洗脱阶段洗脱不完全。因此,吸附剂用量选择15.0 mg。
2.2.5 洗脱剂的选择
洗脱剂的极性直接影响洗脱效率。本实验选择了5种极性不同的洗脱剂考察洗脱效果,分别为:乙腈、甲醇、乙酸乙酯、二氯甲烷和丙酮。洗脱效果见图6。洗脱效果为乙腈>甲醇>乙酸乙酯>二氯甲烷>丙酮。主要原因是黄曲霉毒素AFB1为中等极性化合物,洗脱剂极性越大,洗脱能力越强。因此,本实验选择乙腈为洗脱剂。
2.2.6 洗脱时间的影响
适合的洗脱时间不仅能提高回收率,也可以缩短前处理时间。洗脱时间过长,造成回收率下降。实验分别考察了洗脱时间为1,3,5,10,15 min时对AFB1回收率的影响。由图7可知,5 min时,洗脱效果最好,AFB1的回收率最大。继续增加洗脱时间会导致部分已经洗脱的AFB1重新被吸附,造成回收率降低。因此,洗脱时间选择5 min。
3 方法评价
3.1 线性范围
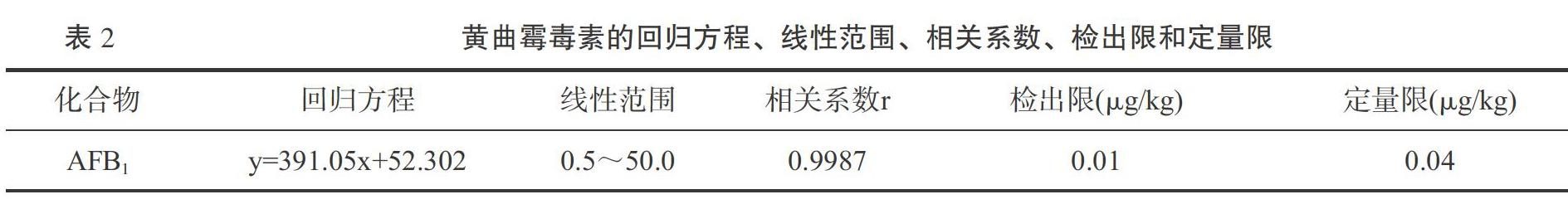
配制浓度分为1.0、5.0、10.0、20.0、50.0 μg/L的AFB1标准溶液,标准溶液的色谱图见图8。以质谱峰面积为纵坐标,AFB1浓度为横坐标作线性回归,回归方程、线性范围及相关系数见表2,由表中数据可知,AFB1 在0.5~50.0μg/L范围内线性关系良好,相关系数为0.9987。以3倍信噪比(S/N= 3)对应的浓度为方法检出限( LOD) ,10 倍信噪比(S/N=10)对应的浓度为定量限( LOQ) ,检出限为0.01 μg/kg,定量限为0.04 μg/kg。
3.2 方法的灵敏度、精密度和准确度
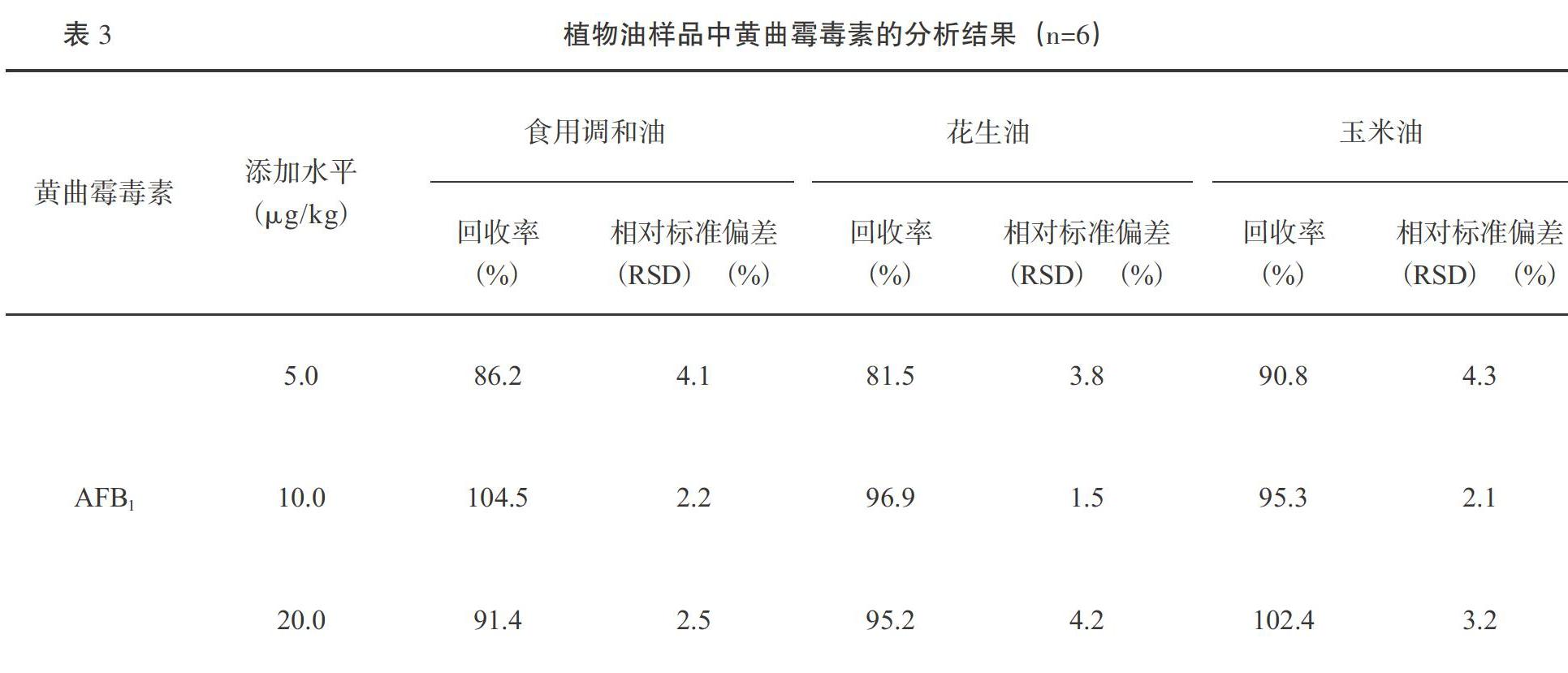
选用食用调和油、花生油和玉米油的空白样品作为基质,分别添加3个不同水平的AFB1,按照1.6方法进行样品前处理,利用HPLC-MS/MS平行测定6次,计算回收率以及相对标准偏差(RSD),具体结果见表3。
3.3 方法验证
随机购买市场销售的食用油样品10份(种类包含食用调和油、玉米油和花生油)进行检测,检出1份花生油样品含AFB1,含量为5.88 μg/kg,低于我国《食品安全国家标准食品中真菌毒素限量》中规定的花生油中AFB1的限量值20 μg/kg。其余9份样品中AFB1未检出。
4 结论
本文采用共沉淀法制备了磁性固相萃取吸附剂MWCNTs-Fe3O4,建立了磁性固相萃取结合HPLC-MS/MS检测食用植物油中黄曲霉毒素AFB1的检测方法。该前处理方法操作简便,减少了有毒有害有机试剂的使用,同时由于磁性固相萃取的分离和富集作用,降低了油脂样品中脂溶性物质、基质、杂质等干扰因素,使方法的灵敏度和精密度得到提高,能够满足植物油中黄曲霉毒素AFB1的检测要求。
参考文献
[1] 李彦伸,卢国柱,曲劲尧,等.霉菌毒素检测与脱毒技术研究进展[J].食品安全质量检测学报,2020,11(12):3919-3927.
[2] Ren Y, Zhang Y, Shao S, et al. Simultaneous determination of multi-component mycotoxin contaminants in foods and feeds by ultra-performance liquid chromatography tandem mass spec-trometry [J]. Journal of Chromatography A, 2007, 1143(1): 48-64.
[3] 吴限鑫,林秋君,郭春景,等.国内外主要粮油产品中真菌毒素限量-检测标准及风险评估现状分析[J].中国粮油学报,2019,34(9):130-136.
[4] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局. 食品安全国家标准食品中真菌毒素限量 GB2761-2017[S].北京:中国标准出版社,2017.
[5] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局. 食品安全国家标准食品中黄曲霉毒素B族和G族的测定GB5009.22-2016[S].北京:中国标准出版社,2016.
[6] 韩晓萌,杨臻慧,陆敏芳,等.HPLC检测植物油中黄曲霉毒素B1含量的不确定度评价[J].广州化学,2020,45(5):69-73.
[7] 史娜,侯彩云,路勇,等.QuEChERS-高效液相色谱—质谱法检测食品中14 种真菌毒素[J]. 食品科学,2014,35(16):190-196.
[8] 孟繁磊,宋志峰,谭莉,等.稳定同位素稀释-UPLC-MS/MS法测定饲料中4种黄曲霉毒素[J].饲料工业,2019,40(6):50-53.
[9] 潘明飛,李诗洁,郭丹丹,等.间接竞争酶联免疫分析方法检测花生中黄曲霉毒素B1[J].中国食品学报,2019,19(9):255-261.
[10] 何晓明,倪娟桢,赵月钧,等.MSPE-UPLC-MS/MS法测定植物油中8种真菌毒素[J]. 食品工业,2019,40(5):319-321.
[11] 刘勤,何丽君,杨君,等.离子液体基磁性固相萃取技术的研究进展[J]. 分析测试学报,2015,34(7):860-866.
