竹阔混交林土壤微生物生物量及酶活性特征研究①
2020-04-12张美曼范少辉官凤英晏颖杰尹子旭黄兰鹰
张美曼,范少辉,官凤英,晏颖杰,尹子旭,黄兰鹰
竹阔混交林土壤微生物生物量及酶活性特征研究①
张美曼,范少辉,官凤英*,晏颖杰,尹子旭,黄兰鹰
(国际竹藤中心竹藤科学与技术重点实验室,北京 100102)
土壤微生物生物量及土壤酶活性是土壤中重要的活性指标,研究竹阔混交林土壤微生物生物量与酶活性随混交比(混交林中阔叶树冠幅所占比例)的变化特征,对竹阔混交林土壤状况进行评价,为竹阔混交林经营过程中阔叶树冠幅的修剪提供一定理论基础。本文通过对福建省永安市天宝岩自然保护区竹阔混交林的调查,研究混交比(阔叶树冠幅与样地面积比)为0 ~ 10%、10% ~ 20%、20% ~ 30%、30% ~ 40%、40% 以上的竹阔混交林林分土壤微生物生物量及酶活性的分布特征。结果显示:混交比与土层对土壤微生物生物量氮(SMBN)、酶活性均有显著性影响,混交比对土壤微生物生物量碳(SMBC)的影响不显著。不同混交比下,SMBC、SMBN、土壤酶活性均表现为随土层加深而降低;SMBC含量在30% ~ 40% 混交比最高(357.67 mg/kg),SMBN含量在混交比为20% ~ 30% 时最高(127.00 mg/kg);混交比为20% ~ 30% 的竹阔混交林林分土壤脲酶、蔗糖酶、过氧化氢酶活性较高,土壤脲酶、蔗糖酶、过氧化氢酶在混交比为10% ~ 20% 时含量显著低于其他4种混交比;相关性分析表明,土壤脲酶、蔗糖酶、过氧化氢酶与土壤微生物生物量之间均呈正相关,其中土壤过氧化氢酶、脲酶分别与SMBC、SMBN呈显著正相关,土壤蔗糖酶和过氧化氢酶均与SMBN呈极显著相关性;SMBC与pH、全氮呈显著正相关,SMBN与土壤含水率、全氮呈极显著正相关;土壤脲酶、蔗糖酶、过氧化氢酶与土壤有机碳、全氮之间均呈极显著正相关。研究表明:林分中阔叶树混交比、土壤深度等都能对SMBC、SMBN、土壤酶活性产生影响,可见竹阔混交林中混交比对土壤状况有一定的影响,其中综合分析得出混交比20% ~ 30% 的林分其土壤微生物生物量与酶活性状况达到最佳。
竹阔混交林;混交比;土壤微生物生物量;酶活性
土壤微生物生物量是土壤微生物中体积小于5 000 µm3生物的总体重(不包括植物活体),是土壤活有机质中的一类,较活跃,极易随环境的变化而变化,能够反映出土壤中发生的极其微小变化[1-2]。土壤微生物生物量碳、氮被认为是土壤活性碳库、氮库,且极易被植物吸收[3],对其变化特征的研究能够直接反映出土壤的肥力状况,对土壤健康状况好坏的评价有重大意义,许多研究工作者已经用土壤微生物生物量的变化来评价一些因人为经营造成的土壤状况变化[4-8],早在18世纪Carter[4]已经把土壤微生物生物量当作评价因耕作造成的土壤微生物特性变化的指示指标。土壤酶是能在土壤中催化众多土壤生化反应的一类蛋白酶,且具有生物活性[9-11]。一般认为土壤酶来源于土壤微生物及植物根系[12]。土壤酶在土壤中扮演着重要角色,一度被认为是土壤生态系统中的核心,近年来国内外对森林土壤酶活性的研究较为关注[13-14],与广泛且稳定的土壤化学指标相比,土壤酶活性可以在较短时期内反映出土壤状况的变化[15],在某种程度上能够反映出土壤营养元素转化和物质循环的速率,同时土壤酶能够实现植物营养元素和有机质的循环转化,对土壤肥力的形成与积累有重要影响,可以作为评价土壤肥力的生物指标[16]。对土壤中酶活性的变化研究,对了解土壤营养元素的转变机理有积极作用[17-18]。
在我国南部广泛分布的毛竹因其可食用的笋与多功能的竹材有着重要的经济价值,同时由于其生长速度快、周期短、效率高等特点成为我国南方竹产区主要的林业经济植物。由于纯毛竹林土壤养分的消耗远远大于输入,且毛竹纯林自肥能力低下,导致长期经营的毛竹林出现土壤贫瘠状况,使得毛竹目前的经营状态距离可持续发展的目标有一定的差距[19]。近年来我国大力提倡科学造林,进行生态经营,根据大气和土壤的结构优化配置,混交林就是一种优良的经营方式[20]。竹阔混交林是竹木混交林的一种优良经营措施,且有研究表明竹阔混交林其林下凋落物丰富,可以有效改良土壤理化性质,加强土壤保水保肥能力,增加林分土壤有机质含量。而大多数农户对其认识不够,为追求经济利益,一味经营毛竹纯林,对阔叶树进行人为砍伐。已有大量学者从不同方面对竹阔混交林进行研究,但以阔叶树冠幅占竹阔混交林林地面积之比为混交比的研究较少,林内冠幅的变化会显著影响林下光照,竹阔混交林内阔叶树冠幅的大小对林内光照影响较为重要,林下光照条件的改变会影响到水分等进而影响林下土壤微生物特性,为此,本研究从阔叶树冠幅与样地面积之比作为混交比的角度出发,以福建不同混交比竹阔混交林为研究对象,应用常规方法,研究竹阔混交林不同混交比情况下微生物生物量与土壤酶活性分布变化规律,从而了解林地土壤养分流动、评价土壤质量;探究混交比对土壤状况的影响,为农户合理地选择竹阔混交比以及更好管理(修枝)竹阔混交林土壤提供理论依据。
1 材料与方法
1.1 研究区域概况
本研究的林分位于我国的天宝岩自然保护区内,天宝岩自然保护区位于福建省永安市东部的西洋、上坪、青水三乡(镇)交界处,地理坐标为117°28′03″ ~ 117°35′28″E、25°50′51″ ~ 26°01′20″N,保护区属中低山地貌,戴云山余脉,红壤,海拔580 ~ 1 604.8 m,中亚热带东南季风气候型。年平均气温15 ℃,绝对最低温度-11 ℃,绝对最高温度40 ℃;年平均相对湿度80% 以上,年平均无霜期290 d左右。保护区内的竹林覆盖率达96.8%,主要分布在海拔800 m以下,主要竹种为毛竹。毛竹的伴生树种有米锥()、栲树()、拟赤杨()、香樟()、枫香(、檫树()、楠木()、木荷(),小叶栎()、杨梅()、酸枣()等。
1.2 样地选择
采用立地条件相一致的方法,在对保护区竹阔混交林全面勘查的基础上,在天宝岩自然保护区内选择立地条件一致的竹阔混交林,采用典型取样法在其分布区域设置5种混交比例的样地,混交比例按照阔叶树冠幅投影面积之和占样方面积的百分比进行划分,分别为10%以下、10% ~ 20%、20% ~ 30%、30% ~ 40%、40% 以上,每种混交比例及对照样地随机设置3个重复,样地大小20 m × 20 m,共计15个样地。样地基本状况如下。
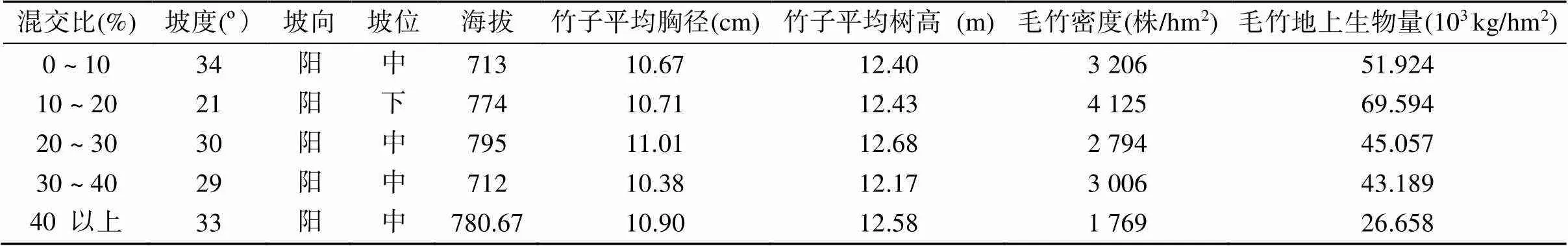
表1 调查样地的基本概况
1.3 研究方法
1.3.1 土壤样品的采集 2017年12月,在每一个样地内依照S型取样法随机8个点上取林间土壤样品,分层取样(0 ~ 10、10 ~ 30、30 ~ 50 cm),将每一个样地的8个取样点的土壤分层混匀,作为该样方的土样。将所采集的样方土样当即采用四分法均分为2份, 1份土样迅速冷藏,带回实验室置于4 ℃ 冰箱用于土壤微生物特性的测定;另1份土样带回实验室,置于室内通风处自然风干,挑除土壤中的杂物和细根,碾碎,过筛装入封口袋中,用于土壤营养含量及酶活性的测定。
每个样地内挖一个0 ~ 60 cm的剖面,用环刀分层取样(0 ~ 10、10 ~ 30、30 ~ 50 cm)用于土壤物理性质测定。
1.3.2 土壤样品的测定和分析 土壤微生生物量碳、氮(SMBC、SMBN)采用氯仿熏蒸-K2SO4浸提法测定[21];土壤酶活性测定:脲酶活性的测定采用苯酚钠-次氯酸钠比色法;蔗糖酶活性测定采用3,5-二硝基水杨酸比色法;过氧化氢酶测定采用高锰酸钾滴定法[22]。土壤含水量采用烘干法(105 ℃ 下不间断烘干24 h);pH采用酸度计进行测定(其中土︰水= 1︰2.5);土壤有机质采用重铬酸钾外加热氧化法测定;土壤全氮、全磷采用元素分析仪测定,测定结果如表2。
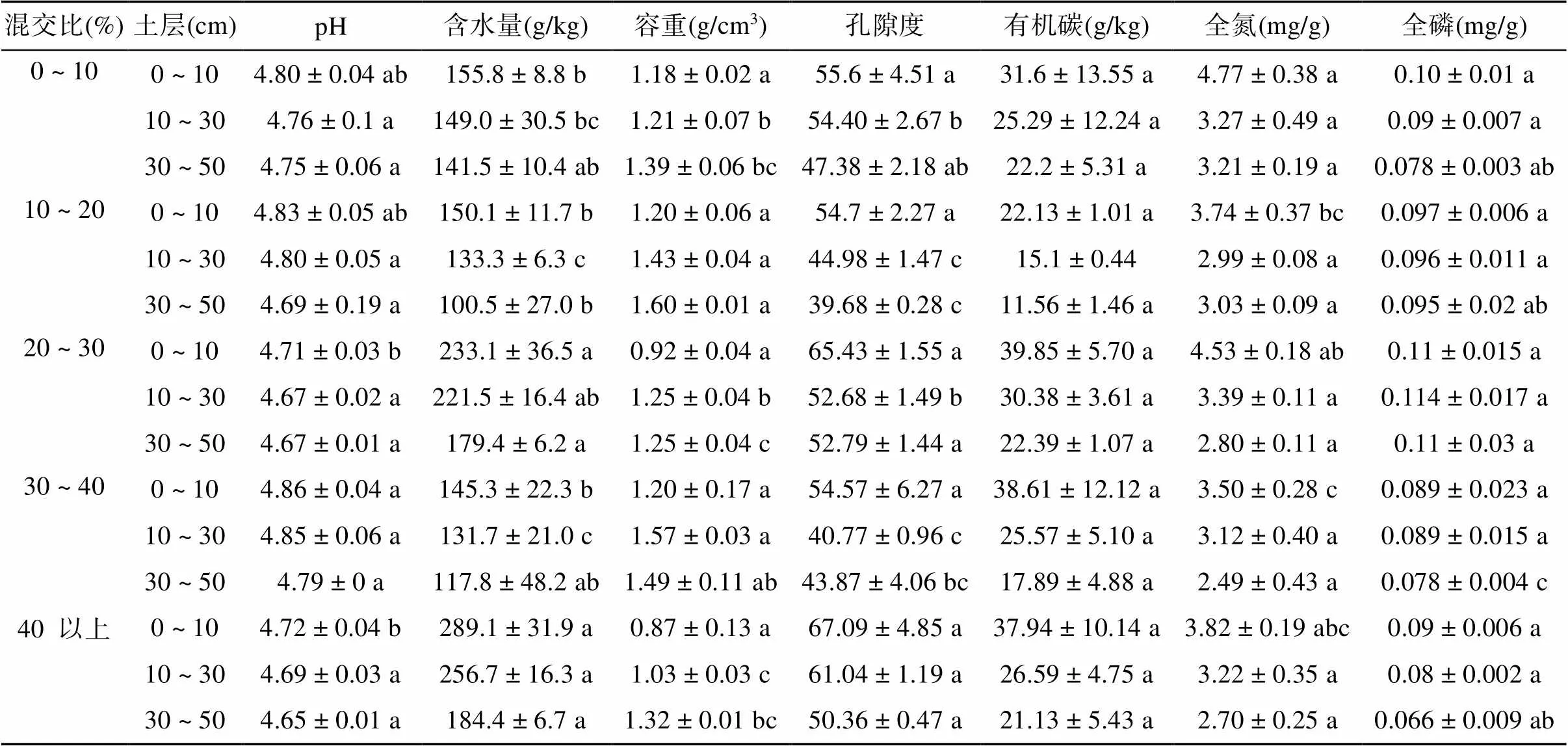
表2 土壤基本理化性质(n = 3)
注:表中数据小写字母不同表示同一土层不同混交比下差异显著 (<0.05)。
1.4 数据处理与统计分析
数据处理与分析采用Miscrosoft Excel 2013和SPSS 20.0软件,进行方差分析和相关性分析,多重比较采用LSD法,利用Pearson相关系数分析不同因子自建的相关关系。
2 结果
2.1 土壤微生物生物量碳对混交比和土层的响应
土壤微生物生物量碳(SMBC)在不同混交比及土层中的分布特征如图1A所示。在不同混交比下,SMBC含量介于224.67 ~ 357.67 mg/kg,且伴随着土层的加深,SMBC逐渐减小。通过对同一土层SMBC进行单因素方差分析结果表明,其混交比之间的差异不显著,同时进行双因素方差分析(表3),结果为混交比对SMBC没有显著影响(= 0.093),土壤深度对其有显著影响(= 0.000),混交比与土层深度对SMBC的交叉影响不显著(= 0.843)。
2.2 土壤微生物生物量氮对混交比和土层的响应
土壤微生物生物量氮(SMBN)含量分布特征如图1B所示。双因素方差分析表明(表3),混交比对SMBN有显著影响(= 0.000),土壤深度对SMBN也有显著性的影响,两者之间的共同作用没有显著影响(= 0.886)。在表土层(0 ~ 10 cm)混交比为20% ~ 30% 与40% 以上的SMBN含量显著大于其他混交比例下的林分;当土层为10 ~ 30 cm时,混交比为40% 以上的竹阔混交林SMBN含量最大(107.23 mg/kg),混交比为0 ~ 10% 的竹阔混交林SMBN含量最低(77.83 mg/kg)且显著低于其他4个林分;在30 ~ 50 cm土层竹阔混交林中SMBN含量在不同混交比条件下依次表现为40% 以上(100.87 mg/kg)>20% ~ 30%(82.7 mg/kg)> 30% ~ 40%(75.13 mg/kg)>20% ~ 30%(72.77 mg/kg)> 0 ~ 10%(61.97 mg/kg);从土壤各层来看,随土层的加深SMBN在逐渐变小。

(图中大写字母不同表示同一土层不同混交比下差异达到P<0.05显著水平,小写字母不同表示同一混交比不同土层下差异达到P<0.05显著水平)
2.3 不同混交比竹阔混交林土壤酶活性的分布特征
不同混交比竹阔混交林土壤酶活性分布特征如表4所示。通过双因素方差分析得出(表3),混交比对土壤脲酶、蔗糖酶、过氧化氢酶均有显著性影响(= 0.000、= 0.000、= 0.000),土壤深度对3种酶也有显著性影响(= 0.000、= 0.002、= 0.000),但二者的共同作用对3种酶均无显著性影响(= 0.945、= 0.408、= 0.667)。
土壤脲酶在5种混交比条件下均随土层的加深活性呈现降低的趋势。就表土层(0 ~ 10 cm)而言,其中混交比为10% ~ 20% 的脲酶活性显著低于其他4种林分,0 ~ 10%的脲酶活性最高,其次为40% 以上;在10 ~ 30 cm与30 ~ 50 cm土层中,不同竹阔混交林土壤脲酶活性均表现为0 ~ 10%>40% 以上>20% ~ 30%>30% ~ 40%>10% ~ 20%。
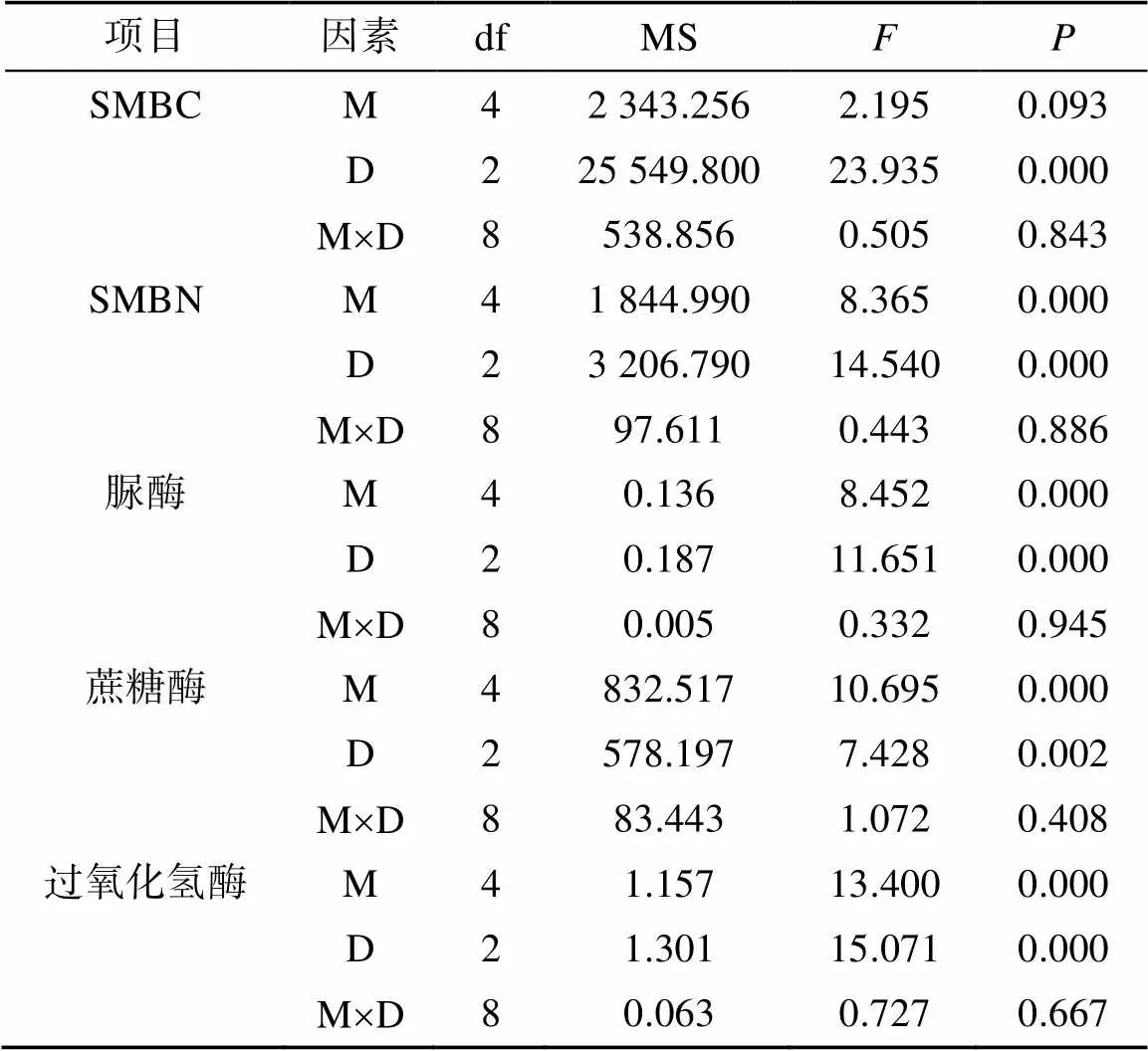
表3 竹阔混交林混交比(M)、土壤深度(D)对土壤微生物生物量及酶活性的方差分析
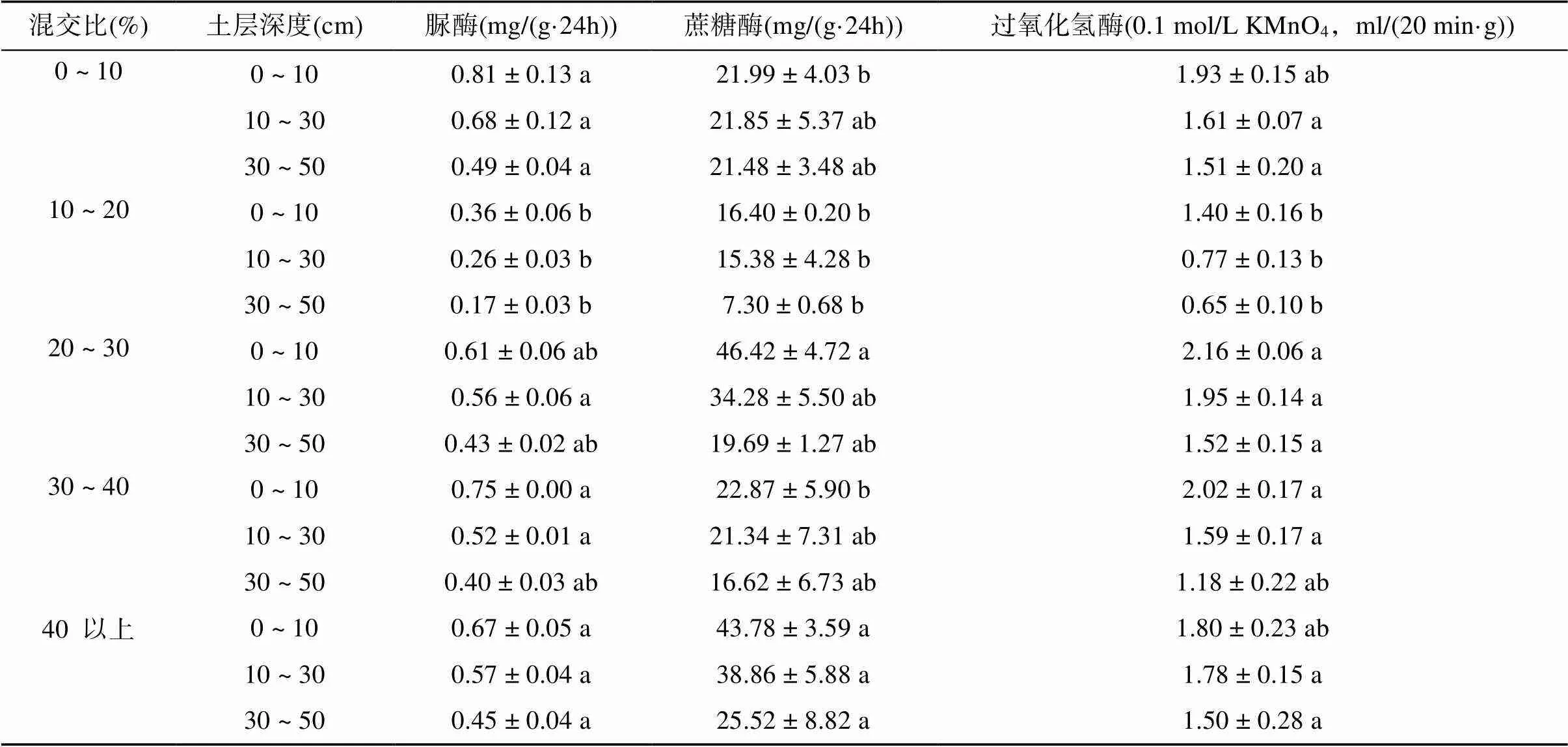
表4 不同混交比竹阔混交林土壤酶活性分布特征(n = 3)
注:表中数据小写字母不同表示同一土层不同混交比条件下竹阔混交林土壤酶活性差异显著 (<0.05)。
由表4看出,土壤蔗糖酶活性与土壤脲酶活性变化一致,均随着土层加深不同程度地减少。0 ~ 10 cm土层中,蔗糖酶活性在混交比为20% ~ 30% 的竹阔混交林中最高,在10% ~ 20% 下最低;10 ~ 30 cm土层情况下,40% 以上混交比情况下蔗糖酶活性较20% ~ 30% 混交比情况下稍高,10% ~ 20% 最低;30 ~ 50 cm土层与10 ~ 30 cm变化趋势相同。单因素方差分析中,0 ~ 10 cm土层中,混交比为20% ~ 30% 与40% 均与其他3种混交比有显著性差异。
如表4所示,伴随着土层加深土壤过氧化氢酶活性降低,同其他酶活性变化类似。表层土中(0 ~ 10 cm),20% ~ 30% 混交比竹阔混交林的过氧化氢酶活性最高,在其之后过氧化氢酶活性随着混交比的增加逐渐降低,其中混交比为10% ~ 20% 的竹阔混交林最低。10 ~ 30 cm与30 ~ 50 cm土层时,过氧化氢酶活性在5种混交比的竹阔混交林中的变化趋势与表土层一致。
2.4 不同混交比竹阔混交林土壤微生物生物量、土壤酶、土壤理化性质相关性
2.4.1 土壤微生物生物量与土壤酶相关性 对不同混交比竹阔混交林SMBC、SMBN与土壤酶活性进行线性相关性分析,结果如图2。结果表明土壤酶活性与SMBC、SMBN呈正相关关系,其中蔗糖酶和脲酶与SMBC的相关性不显著,与SMBN呈极显著正相关(<0.01);土壤过氧化氢酶与SMBC呈显著性正相关(<0.05),与SMBN呈极显著正相关(<0.01)。
2.4.2 土壤微生物生物量及酶活性与土壤养分的相关性 土壤微生物生物量与土壤理化性质之间的关系十分密切。土壤养分在一定程度上会影响土壤微生物生物量的积累,同时土壤微生物生物量反过来又对土壤养分和林地持续生产力具有重要的影响[23-24],两者之间进行相互转化与调节。因此,为了更好地说明两者之间的关系,采用了逐步回归分析,得到如下的最优回归方程:
1=-580.864+21.1141+168.2022
式中:1:SMBC;1:全氮;2:pH。全氮和pH对SMBC的偏相关性系数分别为0.392(<0.05)、0.374(<0.05),由此可知,全氮和pH对SMBC的贡献较大,随着全氮和pH的增加,SMBC含量也随之增加。
2=17.778+2.2101+10.4212
式中:2:SMBN;1:土壤含水率,= 0.000;2:全氮,= 0.005。土壤含水率和全氮对SMBN的偏相关系数分别为0.680(<0.01)、0.466(<0.01),可知土壤含水率和全氮对SMBN贡献率大,且随着二者的增加SMBN含量也急剧增加。
相关性分析表明(表5),5种混交比条件下竹阔混交林土壤脲酶、蔗糖酶、过氧化氢酶与土壤有机碳、全氮之间均呈极显著正相关(<0.01);土壤全磷与各种酶之间均未达到显著相关;土壤蔗糖酶活性与土壤含水量、pH之间均呈负相关关系,过氧化氢酶、脲酶与土壤含水量之间呈正相关关系,但相关性均不显著;土壤脲酶与蔗糖酶、过氧化氢酶之间均呈极显著正相关,蔗糖酶与过氧化氢酶之间也呈极显著正相关。
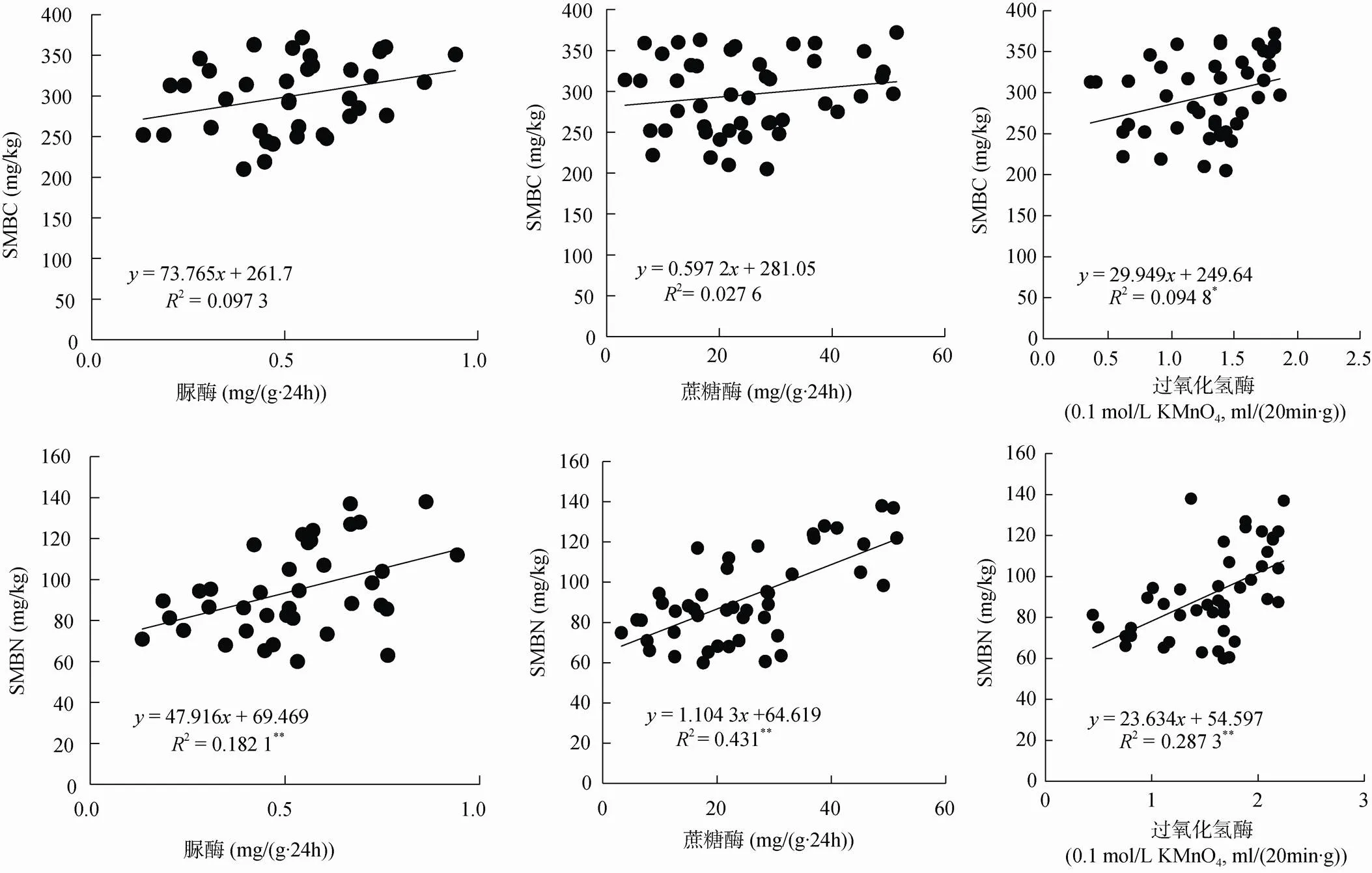
图 2 土壤酶活性与土壤微生物生物量的线性回归分析
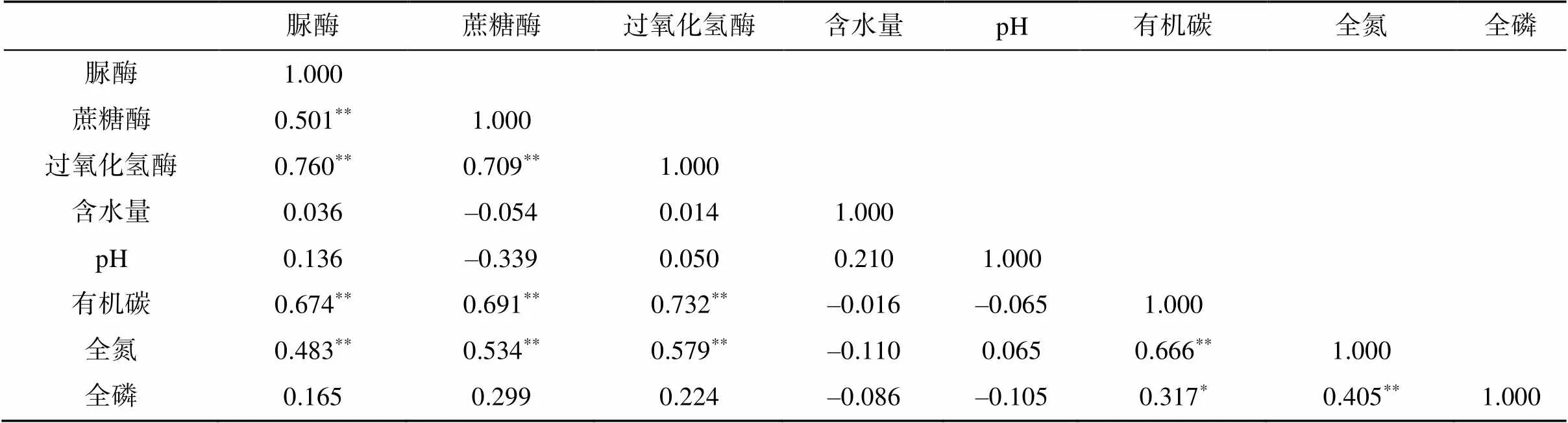
表5 土壤酶活性与土壤理化性质之间的相关系数
注:**表示相关性达到<0.01显著水平。
3 讨论
3.1 不同混交比竹阔混交林土壤微生物生物量的分布特征
土壤微生物生物量在土壤中的含量较少,但是它对环境的变化极其敏感,可以在较短时间内因环境变化以及人为活动的影响而发生较大幅度的变化,在土壤养分循环(尤其碳氮循环)中其活性最强[2, 25]。土壤养分、光照、植被类型、经营方式以及土地利用方式的不同均会造成土壤微生物生物量的不同[26-27],竹阔混交林因其混交比的不同,其林内微环境也会不同进而造成其微生物生物量存在差异。本研究表明(图1),土壤微生物生物量碳、氮(SMBC、SMBN)在不同混交比竹阔混交林中的含量不同,SMBC整体表现为混交比在0 ~ 40% 区间呈增加趋势,且整体表现为30% ~ 40% 混交比的竹阔混交林最高,混交比为20% ~ 30% 的稍次之,这主要是受林内光照以及植被类型的影响。相关研究表明,林内光照条件、热量条件以及凋落物等不同,会使得SMBC含量不同[28-29]。由于混交比的增加,林内阔叶树较多,其林内的阔叶树凋落物相对增加从而使得土壤微生物可利用的养分更多[30]。混交比在40% 以上的SMBC含量降低,可能与阔叶树增加,冠幅较大,林内光照条件较差,林下植被生长受限有关。SMBN的含量在混交比为20% ~ 30% 时最高,混交比为40% 以上稍次之。与SMBC表现不同,在本研究区内混交比为20% ~ 30% 有较好的林分空间结构、透光性以及林分稳定性,林下物种多样性也相对较好,因此林内植物对土壤氮素的固氮效果较好。且大量研究表明,土壤氮素矿化的过程中其中最主要的影响因子之一为土壤含水量,大多数研究表明土壤含水量会严重影响SMBN的含量[31],本研究中混交比为20% ~ 30% 和40% 以上的竹阔混交林土壤含水量较其他混交林高,所以SMBN含量也较其他混交林高。研究表明,随着土层加深,5种混交比竹阔混交林SMBC、SMBN含量均降低,这主要是由于林内表层植物凋落物多,表层土壤养分以及保水能力较强,从而导致土层加深,土壤微生物生物量含量随之减少。同时由差异性分析得出,在混交比为0 ~ 10% 时土层之间土壤微生物生物量含量差异显著,其他混交比之间差异不显著,这可能是由于低混交比时阔叶树较少,毛竹鞭根为浅根系,从而使得深层根系较少;而高混交比情况下,阔叶树增加,深层土壤根系增多,土壤微生物生物量受凋落物以及根系综合影响下导致低混交比状况下土层之间土壤微生物生物量差异显著。综合表明混交比为20% ~ 30% 的林分养分的转化、积累效果好。
3.2 不同混交比竹阔混交林土壤酶活性的分布特征
土壤酶活性被认为是评价土壤质量的重要指标之一[11-12],它在某种程度上能够反映出土壤营养元素转化和物质循环的速率,同时土壤酶能够实现植物营养元素和有机质的循环转化,其中土壤碳、氮、磷的循环、转化过程就需要土壤脲酶、蔗糖酶、磷酸酶等水解酶的参与[26],林地土壤养分、林分结构、植被类型、种植方式等均与土壤酶活性有密切关系[10]。本研究结果(表2)表明,土壤脲酶、蔗糖酶、过氧化氢酶活性在不同混交比情况下随着土层的加深(0 ~ 50 cm)逐渐降低,这与大多数研究结果一致[32]。主要是由于土壤表层存在较多凋落物,腐殖质含量多,且含有较多的微生物、植物、动物以及有机残体等,较多种类的土壤动物,微生物、植物使得其生理活性增加,释放的酶会增加[33],因此土壤表层酶活性较下层高。土壤脲酶有助于将土壤中的有机氮化物质转化为植物生长过程中可直接吸收利用的无机氮化物[34-35]。土壤中碳的循环过程需要蔗糖酶的参与,进而促进土壤中可溶性营养物质的产生,且与土壤有机质的关系较为密切[36]。由此可见,混交比为20% ~ 30% 的竹阔混交林土壤脲酶、蔗糖酶活性较高,土壤的碳氮循环较快,该混交比状况下竹阔混交林可以改善土壤中养分的循环。土壤过氧化氢酶主要是与土壤抗性有关的还原酶,它通过促进过氧化氢的分解从而防止有毒物质对生物体(植物、微生物等)的毒害[22,36-38]。本研究中土壤过氧化氢酶表现出混交比为20% ~ 30% 的竹阔混交林活性最高,且随着混交比从低到高呈现出先增加后降低的趋势,表明在竹阔混交林,林分冠层结构的变化对林内土壤的抗性有一定的影响,混交比为20% ~ 30% 的林内土壤环境的抗性较其他混交比要好。
综合结果分析得出本研究林分土壤脲酶活性与SMBC、SMBN呈显著正相关,与有机质、全氮极显著相关,且SMBC与pH、全氮呈显著正相关,SMBN与土壤含水率、全氮呈极显著正相关;因此土壤脲酶、土壤微生物生物量是表征土壤肥力水平的重要指标。土壤蔗糖酶与土壤有机质、全氮也表现出极显著的正相关关系,且与SMBC之间呈较好的相关性,表明土壤蔗糖酶能够有效地表明土壤中的生物活性状况,且蔗糖酶主要参与土壤中碳循环。过氧化氢酶活性与土壤有机质、全氮的相关性极显著,是影响土壤有机质、全氮的重要因素之一,随着过氧化氢酶活性的增加,土壤养分的积累越高效;且过氧化氢酶活性与SMBC、SMBN之间的相关性均表现为显著相关,表明土壤过氧化氢酶对土壤中活性碳等也有较大影响。由此,土壤微生物生物量、酶活性可作为土壤环境变化的微生物学指标。土壤中大多数的营养物质之间的循环与转化都离不开微生物的分解以及土壤酶的催化作用[3],绝大多数酶来源于微生物,而微生物的繁殖需要高含量的有机质,土壤肥力、土壤微生物和土壤酶活性之间是协同发展的,土壤微生生物量、酶活性可以较好地反映土壤肥力状况。
4 结论
1)福建永安天宝岩自然保护区竹阔混交林地SMBC含量在30% ~ 40% 混交比最高,混交比为20% ~ 30% 稍次之,SMBN的含量在混交比为20% ~ 30% 时最高。总体上看土壤微生物生物量含量在混交比20% ~ 30% 时较好,说明该阔叶树冠幅条件下,其土壤养分的矿化与积累能力强。
2)混交比为20% ~ 30% 的竹阔混交林土壤脲酶、蔗糖酶、过氧化氢酶活性较高,而混交比为10% ~ 20% 时酶活性显著低于其他4种混交比。
3)土壤脲酶、蔗糖酶、过氧化氢酶与土壤微生物生物量之间均呈正相关,其中土壤过氧化氢酶、脲酶分别与SMBC、SMBN呈显著正相关,土壤蔗糖酶和过氧化氢酶均与SMBN呈极显著相关性;SMBC与pH、全氮呈显著正相关,SMBN与土壤含水率、全氮呈极显著正相关。土壤脲酶、蔗糖酶、过氧化氢酶与土壤有机碳、全氮之间均呈极显著正相关。
综上所述,在进行竹林经营时,可以通过对竹阔混交林中阔叶树进行修枝,使得林内阔叶树冠幅面积占林地面积20% ~ 30% 之间,从而达到合理有效地对竹阔混交林进行经营。
[1] Jenkinson D S, Ladd J N. Microbial biomass in soil: Measurement and turnover//Paul E A, Ladd J N.Soil Biochemistry[M]. New York, USA: Marcel Dekker, 1981: 415–471.
[2] 张成霞, 南志标. 土壤微生物生物量的研究进展[J]. 草业科学, 2010, 27(6): 50–57.
[3] 张学鹏, 宁堂原, 杨燕, 等. 不同浓度石灰氮对黄瓜连作土壤微生物生物量及酶活性的影响[J]. 应用生态学报, 2015, 26(10): 3073–3082.
[4] Carter M R. Microbial biomass as an index for tillage-induced changes in soil biological properties[J]. Soil & Tillage Research, 1986, 7(1): 29–40.
[5] 徐阳春, 沈其荣, 冉炜. 长期免耕与施用有机肥对土壤微生物生物量碳、氮、磷的影响[J]. 土壤学报, 2002, 39(1): 89–96.
[6] 曹志平, 胡诚, 叶钟年, 等. 不同土壤培肥措施对华北高产农田土壤微生物生物量碳的影响[J]. 生态学报, 2006, 26(5): 1486–1493.
[7] 贾伟, 周怀平, 解文艳, 等. 长期有机无机肥配施对褐土微生物生物量碳、氮及酶活性的影响[J]. 植物营养与肥料学报, 2008, 14(4): 700–705.
[8] 贾伟, 周怀平, 解文艳, 等. 长期秸秆还田秋施肥对褐土微生物碳、氮量和酶活性的影响[J]. 华北农学报, 2008, 23(2): 138–142.
[9] 楼一平, 吴良如, 邵大方, 等. 毛竹纯林长期经营对林地土壤肥力的影响[J]. 林业科学研究, 1997,10(2): 125– 129.
[10] 杨瑞, 刘帅, 王紫泉, 等. 秦岭山脉典型林分土壤酶活性与土壤养分关系的探讨[J]. 土壤学报, 2016, 54(4): 1037–1046.
[11] Ladd J N . Soil Enzymes[M]// Soil Organic Matter and Biological Activity. Springer Netherlands, 1985.
[12] 李正才, 傅懋毅, 谢锦忠, 等. 毛竹竹阔混交林群落地力保持研究[J]. 竹子学报, 2003, 22(1): 32–37.
[13] Renella G, Ortigoza A L R, Landi L, et al. Additive effects of copper and zinc on cadmium toxicity on phosphatase activities and ATP content of soil as estimated by the ecological dose (ED 50)[J]. Soil Biology & Biochemistry, 2003, 35(9): 1203–1210.
[14] Shen G, Lu Y, Hong J. Combined effect of heavy metals and polycyclic aromatic hydrocarbons on urease activity in soil[J]. Ecotoxicology & Environmental Safety, 2006,63(3): 474–480.
[15] 王理德, 姚拓, 何芳兰, 等. 石羊河下游退耕区次生草地自然恢复过程及土壤酶活性的变化[J]. 草业学报, 2014, 23(4): 253–261.
[16] 杨皓, 范明毅, 李婕羚, 等. 喀斯特山区无籽刺梨种植基地土壤酶活性与肥力因子的关系[J]. 山地学报, 2016, 34(1): 28–37.
[17] 王伟波. 安徽岳西常绿阔叶林带四种群落类型土壤养分、微生物量与酶活性分布特征研究[D]. 上海: 华东师范大学, 2015: 9–12.
[18] GarcíaGil J C, Plaza C, Solerrovira P, et al. Long-term effects of municipal solid waste compost application on soil enzyme activities and microbial biomass[J]. Soil Biology & Biochemistry, 2000, 32(13): 1907–1913.
[19] 王雪芹. 毛竹林地土壤养分动态变化及微生物特性研究[D]. 杭州: 浙江大学, 2011: 18–22.
[20] 周亚琦, 董杰, 官凤英, 等. 竹阔混交林研究进展与展望[J]. 林业资源管理, 2016(3): 145–150.
[21] 鲍士旦. 土壤农化分析.3版[M]. 北京: 中国农业出版社, 2000.
[22] 关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986.
[23] Voroney R P, Paul E A, Anderson D W. Decomposition of wheat straw and stabilization of microbial products[J]. Canadian Journal of Soil Science, 1989, 69(1): 63–77.
[24] Taylor J P, Wilson B, Mills M S, et al. Comparison of microbial numbers and enzymatic activities in surface soils and subsoils using various techniques[J]. Soil Biology & Biochemistry, 2002, 34(3): 387–401.
[25] 秦华军, 何丙辉, 赵旋池, 等. 西南喀斯特山区寿竹林地土壤微生物量与酶活性在不同坡位和剖面层次的分布特征[J]. 环境科学, 2014, 35(9): 3580–3586.
[26] 杨佳佳, 安韶山, 张宏, 等. 黄土丘陵区小流域侵蚀环境对土壤微生物量及酶活性的影响[J]. 生态学报, 2015, 35(17): 5666–5674.
[27] 张地, 张育新, 曲来叶, 等. 坡位对东灵山辽东栎林土壤微生物量的影响[J]. 生态学报, 2012, 32(20): 6412–6421.
[28] 杨凯, 朱教君, 张金鑫, 等. 不同林龄落叶松人工林土壤微生物生物量碳氮的季节变化[J]. 生态学报, 2009, 29(10): 5500–5507.
[29] 吴然, 康峰峰, 韩海荣, 等. 山西太岳山不同林龄华北落叶松林土壤微生物特性[J]. 生态学杂志, 2016, 35(12): 3183–3190.
[30] Vance E D, Fsiii C. Substrate limitations to microbial activity in taiga forest floors[J]. Soil Biology & Biochemistry, 2001, 33(2): 173–188.
[31] 周建斌, 陈竹君, 李生秀. 土壤微生物量氮含量、矿化特性及其供氮作用[J]. 生态学报, 2001, 21(10): 1718–1725.
[32] 黄懿梅, 安韶山, 曲东, 等. 黄土丘陵区植被恢复过程中土壤酶活性的响应与演变[J]. 水土保持学报, 2007,21(1): 152–155.
[33] 曹慧, 孙辉, 杨浩, 等. 土壤酶活性及其对土壤质量的指示研究进展[J]. 应用与环境生物学报, 2003, 9(1): 105– 109.
[34] 叶江华, 王海斌, 李远华, 等. 不同树龄茶树根际土壤酶活性的变化分析[J]. 中国土壤与肥料, 2016(5): 25–29.
[35] 李阳, 王文全, 吐尔逊·吐尔洪. 再生水灌溉对葡萄叶片抗氧化酶和土壤酶的影响[J]. 植物生理学报, 2015(3): 295–301.
[36] 严君, 韩晓增, 王树起, 等. 不同形态氮素对种植大豆土壤中微生物数量及酶活性的影响[J]. 植物营养与肥料学报, 2010, 16(2): 341–347.
[37] Baldrian P . Microbial enzyme-catalyzed processes in soils and their analysis[J]. Soil and Environment - UZEI (Czech Republic), 2009, 55(9): 370–378.
[38] Cusack D F, Silver W L, Torn M S, et al. Changes in microbial community characteristics and soil organic matter with nitrogen additions in two tropical forests[J]. Ecology, 2011, 92(3): 621–632.
Study on Soil Microbial Biomass and Enzyme Activities in Mixed Forest of Bamboo and Broad-leaved Trees
ZHANG Meiman, FAN Shaohui, GUAN Fengying*, YAN Yingjie, YIN Zixu, HUANG Lanying
(International Center for Bamboo and Rattan & Key Laboratory of Science and Technology of Bamboo and Rattan, Beijing 100102, China)
In this study, the characteristics of soil microbial biomass and enzyme activities of bamboo and broad-leaved forests with different mixed ratios (0-10%, 10%-20%, 20%-30%, 30%-40%, and above 40%) were investigated in order to evaluate the effect of mixed ratio on soil conditions. Three sample plots (20 m´20 m in size) were set for each ratio, and soils of 8 sampling points were randomly collected in S-shape within each plot in December 2017. The results showed that the mixed ratio and soil depth significantly influenced soil microbial biomass nitrogen (SMBN) and enzyme activities, but influenced insignificantly soil microbial biomass carbon (SMBC). SMBC, SMBN and enzyme activities decreased with the increase of soil depth. SMBC was the highest (357.67 mg/kg) in the mixed ratio of 30%-40%, SMBN was the highest (127.00 mg/kg) in the mixed ratio of 20%-30%. The activities of soil urease, sucrase and catalase were higher in the mixed ratio of 20%–30%, while were the lowest in the mixing ratio of 10%-20%. Correlation analysis indicated that the activities of soil urease, sucrase and catalase were positively correlated with SMB, among of which, the activities of soil catalase and urease had significant positive correlation between SMBC and SMBN, while the activities of soil sucrase and catalase were significantly correlated with SMBN. SMBC was significantly positively correlated with pH and total nitrogen. There was a very significant positive correlation between SMBN and soil water content and total nitrogen. The activities of soil urease, sucrase and catalase were positively correlated with soil organic carbon, total nitrogen. In conclusion, the mixed ratio, soil depth could impact on SMBC, SMBN and enzyme activities significantly, the mix ratio has a certain impact on soil conditions, and the mixed ratio of 20%-30% has the best soil microbial status.
Bamboo and broad-leaved mixed forest; Mixed ratio; Microbial biomass; Enzyme activity
S714.3;S714.8
A
10.13758/j.cnki.tr.2020.01.014
张美曼, 范少辉, 官凤英, 等. 竹阔混交林土壤微生物生物量及酶活性特征研究. 土壤, 2020, 52(1): 97–105.
竹藤中心科研业务费专项(1632019005、1632018003)和林业科技创新平台运行补助项目(2019132146)资助。
张美曼(1992—),女,安徽蚌埠人,博士研究生,主要研究方向为竹林经营技术。E-mail: 1914899370@qq.com
