喀斯特生境下AMF侵染对任豆生长的影响
2020-04-11屈明华俞元春李生张金池
屈明华,俞元春,李生,张金池
1. 南京林业大学林学院南方现代林业协同创新中心,江苏 南京 210037;2. 中国林业科学研究院亚热带林业研究所,浙江 杭州 311400
菌根(mycorrhizal)是植物根系与土壤中某些特定真菌形成的共生体,能形成菌根的特定真菌称为菌根真菌(刘永俊,2008)。菌根按照在植物体内着生部位和形态特征分为内生菌根、外生菌根和内外生菌根(郭秀珍等,1989)。丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)属内生菌根真菌,广泛分布于自然界中,是土壤生态系统中重要组成部分,能与绝大多数植物根系形成共生体,促进植物养分吸收(尤其是P),提高植物抗旱性、抗盐性和抗冻害性(高丽霞等,2012;Aroca et al.,2007),增强植物对病原体和非生物应激抗性,对植物生长发育有重要作用(Maighal et al.,2016)。AMF与植物共生强化了宿主植物对养分吸收能力,尤其是不利土壤上发挥作用更大。菌根活化土壤养分能力可能与养分供应水平有关,低养分条件下更有利于土壤养分释放,营养缺乏条件下,菌根真菌生长和发育更容易获得不同程度提高,从而促进植物生长(Jackson et al.,2002)。AMF接种是煤矿塌陷区植被恢复的有效途径,摩西球囊霉(Funneliformis mosseae)、根内球囊霉(Rhizophagus intraradices)有效提高了长柄扁桃(Amygdalus pedunculataPall)地上部和根部生长,煤矿塌陷区土壤有效磷含量和酸性磷酸酶活性提高,根际土壤电导率增强(Bi et al.,2018),电导率增强的原因可能是AMF促进土壤养分增溶,增强了离子移动性。干旱胁迫下,AMF促进大豆苗叶面积和生长速度提高,增加豆荚产量(Pavithra et al.,2018)。干旱和水分胁迫下,接种摩西球囊霉和根内球囊霉显著提高青冈栎(Cyclobalanopsis glauca)株高、地径、叶面积和生物量,植株内磷和钾含量也获得不同程度提高。AMF定殖改善植物生长状态,提高养分吸收,调节渗透物质,提高抗氧化物酶活性,有利于退化地区植被恢复(Zhang et al.,2014)
喀斯特生态系统是由碳酸盐岩发育形成,占地球陆地表面积的15%,中国西南喀斯特地区面积约550000 km2,是世界上最大的喀斯特区域(梁月明等,2017)。喀斯特地区生态系统水土流失严重,基岩大面积裸露,土层瘠薄,土被不连续,土壤侵蚀严重容易导致养分流失(司建朋等,2019;杨应等,2017)。土壤蓄水能力差,高钙、高镁,生态系统脆弱(Chen et al.,2015),植物定植、更新困难。喀斯特植被恢复受微生物群落结构影响(林艳等,2019),在碳酸钙高达38.65%的土壤基质上对苹果砧木接种Glomus versiforme,Claroideoglomus etunicatum和Rhizophagus intraradices,3种AMF均促进苹果砧木生长,Glomus versiforme对苗高、茎粗、叶面积和生物量提高效应最大(Aram et al.,2015)。钙质土壤上,豆科牧草(Hedysarum coronariumL.)与土著AMF接种显著提高了牧草生物量,促进铁、锰吸收,植物体磷含量提高50%(Labidi et al.,2014)。喀斯特土壤上,任豆(Zenia insignis)接种摩西球囊霉和幼套球囊霉(Glomus etunicatum)均促进苗木生长,其中摩西球囊霉(HUN03B)促进效果最好,苗高、地径、植株鲜重和干重均最大(姜英等,2019)。豆科植物根际土壤中存在大量AM真菌资源,形成了“AM真菌-豆科植物-根瘤菌”共生关系(Antunes et al.,2006),豆科植物与菌根技术相结合被广泛应用于植树造林(唐明等,2006)、矿区植被恢复(刘德良等,2013)和污染土壤修复(高丽霞等,2009)等方面。喀斯特地区生态修复过程中,豆科植物具有植株高大,耐贫瘠,营养丰富,抗逆性和适应性强的特点,成为喀斯特地区生态治理的宝贵植物资源(吴涛等,2016)。任豆是中国华南石灰岩地区特有树种,主要分布于中国中亚热带与南亚热带岩溶地区。任豆萌芽性强,侧根粗壮发达,穿透能力强,能固氮且耐干旱瘠薄,可在石缝中生长,是中国南方绿化石山的优良速生树种,与AMF共生能够提高石漠化地区造林成活率和保存率(宋凤鸣等,2018)。
本研究以喀斯特侵蚀区土壤为基质,任豆为试验材料,供试AMF为喀斯特优势菌属——摩西球囊霉、根内球囊霉(魏源等,2011;施松梅等,2013),观察任豆根系侵染状况与其促生关系,探讨丛枝菌根真菌在喀斯特土壤上与植物共生效果,为喀斯特侵蚀区植被恢复提供微生物干扰途径。
1 材料和方法
1.1 试验材料
菌种摩西球囊霉、根内球囊霉由长江大学园林园艺学院提供,接种的菌剂含有孢子、菌丝片段和侵染根段。供试土壤采自贵州省普定县喀斯特高原生态综合治理试验示范区,分别为贫瘠喀斯特土壤和20年林龄滇柏(Cupressus duclouxiana)林下土壤,土壤理化性质见表1。土壤过2 mm筛孔,高压蒸汽灭菌(121 ℃,0.11 MPa,1 h)后作为试验基质。任豆种子采自喀斯特地区任豆次生林,试验前用10%的双氧水表面消毒15 min,灭菌水冲洗多次,备用。试验用塑料盆规格:上口径16 cm、下口径11 cm、高13 cm,用75%酒精表面擦拭消毒。
1.2 试验设计
试验采用完全随机区组设计,2种土壤处理和4个接种处理(2×4)。其中每个处理12个重复,接种处理设置为:接种摩西球囊霉处理(Fm)、接种根内球囊霉处理(Ri)、混合接种处理(Mixture inoculation,Mi)和不接种处理(Contrast check,CK)。接种方法:塑料花盆中装入灭菌土1.5 kg,称取菌剂平铺在灭菌土上,同时点播入消毒并催芽的任豆种子3粒,用灭菌土覆盖。单菌种接种处理按25 g/盆施加菌剂(孢子密度7—12个/g);混合接种处理:2种菌剂按1:1混合后,再称取25 g菌剂施入花盆中;对照处理不加菌剂,加入经微孔滤膜过滤的菌液和25 g高温灭菌后的混合菌剂,以保持除目的菌外和其它处理土壤微生物组成一致。各处理每3天用去离子水补充水分,以水分不流出盆底为准,不添加肥料(Aram et al.,2015)。幼苗正常生长30 d后,每盆定苗1株。2018年3月13日播种至2018年9月12日共培育180 d,分别在前期(60 d)、中期(150 d)、后期(收获期180 d)采集植物样品,每个处理随机选取其中3株(分别在12个重复花盆选择)进行相关指标测定。
1.3 测定指标
测量不同时期任豆苗株高、地径,然后从盆中小心取出完整单株,青黄交接处剪断,调查地上部分鲜质量、地下部分鲜质量。根部调查结束后将清洗干净的须根放入FAA固定液中固定,每株任豆苗剪取25条1 cm长根尖段进行侵染率测定。菌根的染色依次经过10% KOH浸泡并在90 ℃烘箱中加热透明 30 min,10% H2O2漂白 10 min,0.2 mol·L-1HCl酸化10 min,0.05%曲利苯蓝振荡染色10 min(吴强盛等,2014),菌根侵染率计算方法采用根段侵染率加权(Biermann et al.,1981),菌根依赖性计算方法采用马放等(2014)方法:

表1 供试土壤理化性质Table 1 Physical and chemical properties pot soil
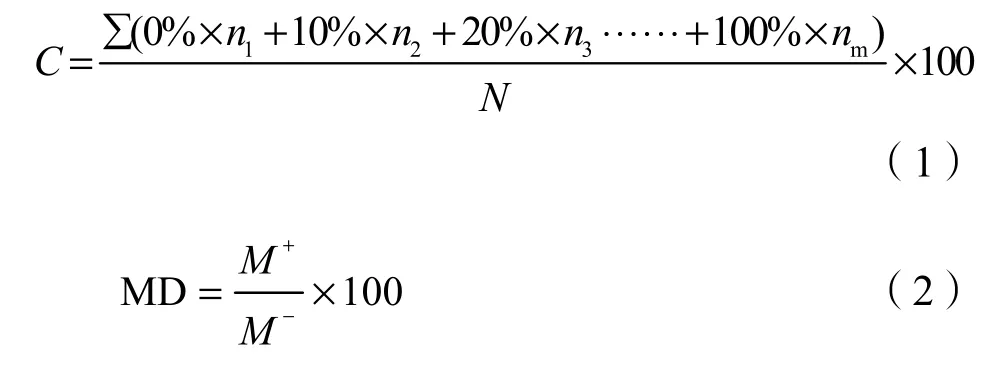
式中,C为菌根侵染率;n为侵染根段数;N为观察总根段数;MD为菌根依赖性;M+为接种后植物生物量;M-为未接种植物生物量。
1.4 数据处理
试验数据利用 Excel 2003软件进行计算及绘图,采用SPSS 19.0软件进行统计分析,用LSD多重比较法进行差异显著性检验(差异显著水平P<0.05)。菌根侵染率在方差分析之前利用Excel进行反正弦转换。
2 结果与分析
2.1 AMF侵染任豆根系菌根结构
根段压片后镜检可观察到任豆根皮层组织细胞间及细胞内存在大量丛枝、孢子、菌丝AM真菌结构。接种初期,Fm接种任豆幼苗根系侵染出大量丛枝结构,随接种时间延长,丛枝结构分化出菌丝,菌丝进入皮层后,在胞间延伸穿插并向菌根外部生长;Ri菌根可产生根内孢子,簇状孢子与菌丝相连接分布于皮层;Mi接种同时具备了Fm和Ri侵染特征,一方面具有丛枝、菌丝结构,同时具有大量簇状孢子与菌丝相连接(图1、图2)。
2.2 接种处理对任豆根系侵染率和菌根依赖性影响
2.2.1 不同接种时间AMF对任豆苗根系侵染
接种处理任豆根系均能与菌根真菌形成菌根共生体,未接种对照处理也不同程度受到侵染。贫瘠喀斯特土壤上,接种前期,单接种根内球囊霉具有最高侵染率79.63%,任豆生长过程中观察,定植初期 Ri接种表现出苗齐壮势头,而摩西球囊霉出苗速度较慢,单接种和混合接种之间侵染率没有显著性差异;接种中期,单接种和混合接种处理间侵染率差异均达到显著水平,摩西球囊霉侵染率上升至89.79%,此时幼苗生长速度加快,而根内球囊霉侵染率显著下降,幼苗生长速度变缓,混合接种侵染率介于单接种之间;生长后期,无论单接种还是混合接种侵染率均呈下降趋势,与生长初期均达到显著差异水平,后期根内球囊霉处理侵染率较中期略有提升,但未达到显著差异水平。随接种时间延长,未接种处理侵染率由2.05%升至16.90%,表明随接种时间延长,AMF真菌会不断繁殖并侵染任豆幼苗根系(图3)。
滇柏林下喀斯特土壤,接种前期侵染率均达到最高水平,混合接种侵染率达到 82.50%,与单接种达到显著差异水平,随接种时间延长,侵染率呈下降趋势,后期较前期下降均达到显著差异水平,单接种之间侵染率在不同时期差异均不显著,混合接种在生长前期、中期与单接种具有显著性差异(图4)。
2.2.2 不同喀斯特生境下AMF对任豆苗根系侵染

图1 贫瘠喀斯特土壤AMF接种任豆根系丛枝结构Fig. 1 Morphology of arbuscular mycorrhiza at Zenia insignis roots after AMF infection in low nutrient Karst soil
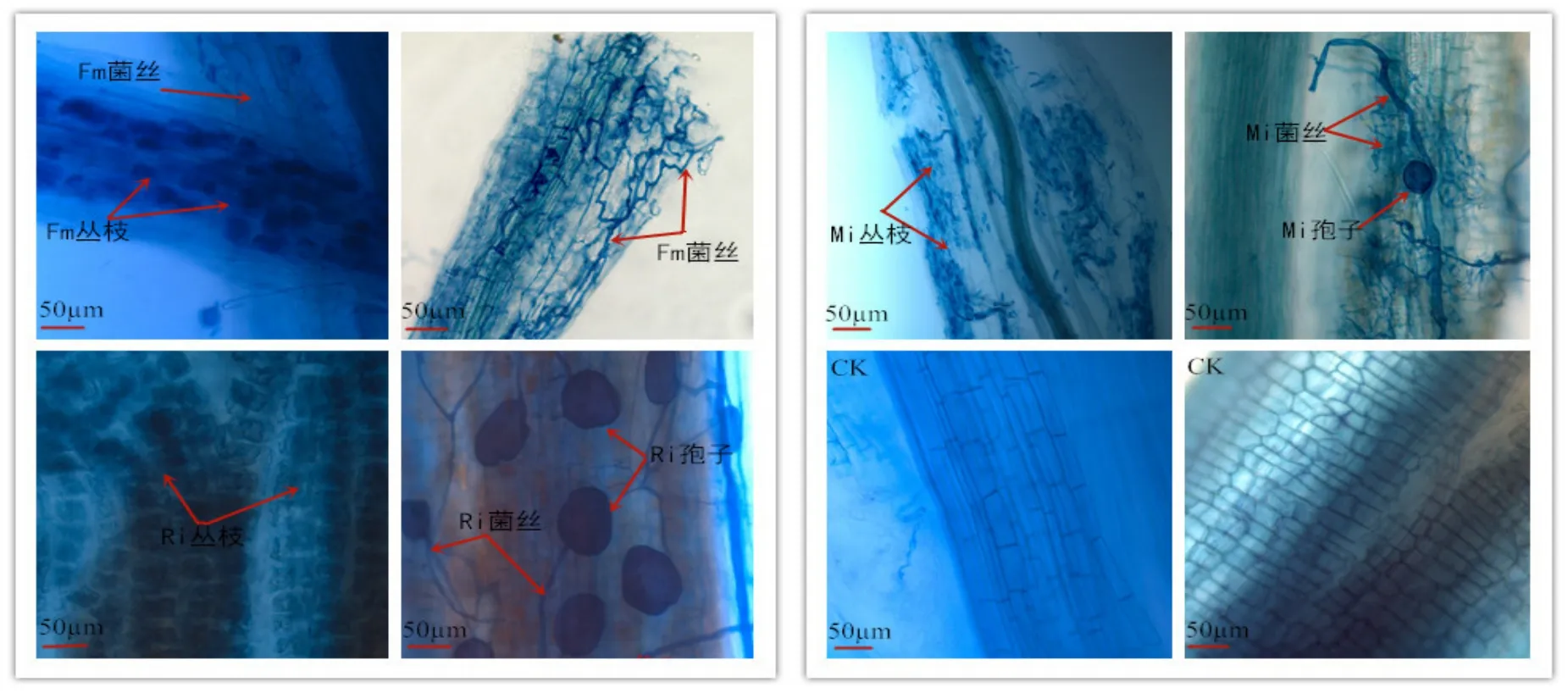
图2 滇柏林下土壤AMF接种任豆根系丛枝结构Fig. 2 Morphology of arbuscular mycorrhiza at Zenia insignis roots after AMF infection in Cupressus duclouxiana soil

图3 贫瘠喀斯特土壤不同接种时间AMF对任豆根系侵染影响Fig. 3 Effect of AMF on the infection of Zenia insignis roots at different inoculation time in low nutrient Karst soil

图4 滇柏林下土壤不同接种时间AMF对任豆根系侵染影响Fig. 4 Effect of AMF on the infection of Zenia insignis roots at different inoculation time in higher nutrient Karst soil
经双因素方差分析(表2),不同喀斯特土壤生境下,接种前期土壤之间侵染率没有显著交互作用,接种处理有显著交互作用,土壤与接种处理之间有交互作用;中期,养分较高的滇柏林下土壤接种条件下,Fm菌根侵染率下降9.92%,Ri菌根侵染率下降21.86%,Mi菌根侵染率下降54.90%。贫瘠土壤,Fm接种侵染率升高31.41%,Ri接种侵染率下降40.69%,Mi略有升高,接种土壤与侵染率有极显著交互作用,不同养分土壤和菌种组合及其互作对菌根侵染率有极显著影响;生长后期菌根侵染率都呈下降趋势,贫瘠喀斯特土壤生境下,Fm、Ri和Mi侵染率较前期分别下降35.74%、32.45%和25.28%,养分较高的滇柏林下土壤生境下,Fm、Ri和 Mi侵染率较前期分别下降 45.97%、62.75%和64.50%,接种土壤与侵染率有极显著交互作用,不同养分土壤和菌种组合及其互作对菌根侵染率有显著影响。

表2 不同喀斯特生境和接种方式对任豆根系侵染率影响的双因素方差分析结果Table 2 The results of two way ANOVA for effects in Karst habitats and mycorrhizal inovulation on the root colonization of Zenia insignis
方差分析表明,随接种时间延长,不同养分喀斯特土壤对菌根侵染率具有显著影响,土壤养分含量高,侵染率下降快,而贫瘠土壤具有较高侵染效率,侵染率随接种时间延长,下降幅度较养分高土壤缓慢。
2.2.3 不同接种处理任豆菌根依赖性
图5,贫瘠喀斯特土壤,生长期内Fm和Mi接种菌根依赖性呈现先升高再降低的变化,Ri接种菌根依赖性呈下降趋势,菌根依赖性最低。前期菌根依 赖 性 Fm>Mi>Ri>CK 、 中 期 菌 根 依 赖 性Fm>Mi>CK>Ri,Mi接种菌根依赖性略低于 Fm 接种,差异不显著;后期Fm>Mi>CK>Ri,3个处理接种菌根依赖性均呈下降趋势,达到显著差异水平;滇柏林下土壤,前期菌根依赖性 Fm>Ri>Mi>CK,中期 Mi>Ri>Fm>CK,后期 Fm>CK>Mi>Ri。随接种时间延长,任豆菌根依赖性由高强度依赖转变为弱依赖或无依赖,由Fm、Ri和Mi接种前期高强度依赖的504.08%、497.96%和231.29%降低为108.88%、38.97%和95.00%。
2.3 接种AMF对任豆株高和地径影响
由图6、图7贫瘠喀斯特土壤,Fm、Mi和Ri处理任豆株高和地径均高于对照,较对照增加68.92%、47.30%、2.16%和 56.18%、37.45%和16.85%,Fm接菌效应明显优于其它两种处理,Ri接菌效应最低,促生效应不显著;滇柏林下土壤,Fm和Mi促进株高提高,较对照分别增加48.05%和12.08%,两种处理差异显著,Ri处理株高较对照降低17.92%,差异不显著。接种处理地径均呈下降趋势,Fm、Mi和Ri地径均下降1.13%、3.76%和21.80%,各处理差异不显著。
株高、地径与菌根依赖性大小顺序基本一致。由图 5,收获期,两种土壤生境下菌根依赖性都较60、150 d下降,而Fm接种处理在两种基质上均具有最高菌根依赖性,可以使植物获得最高株高、地径,Mi接种处理菌根依赖性次于Fm,株高和地径也次于Fm处理。
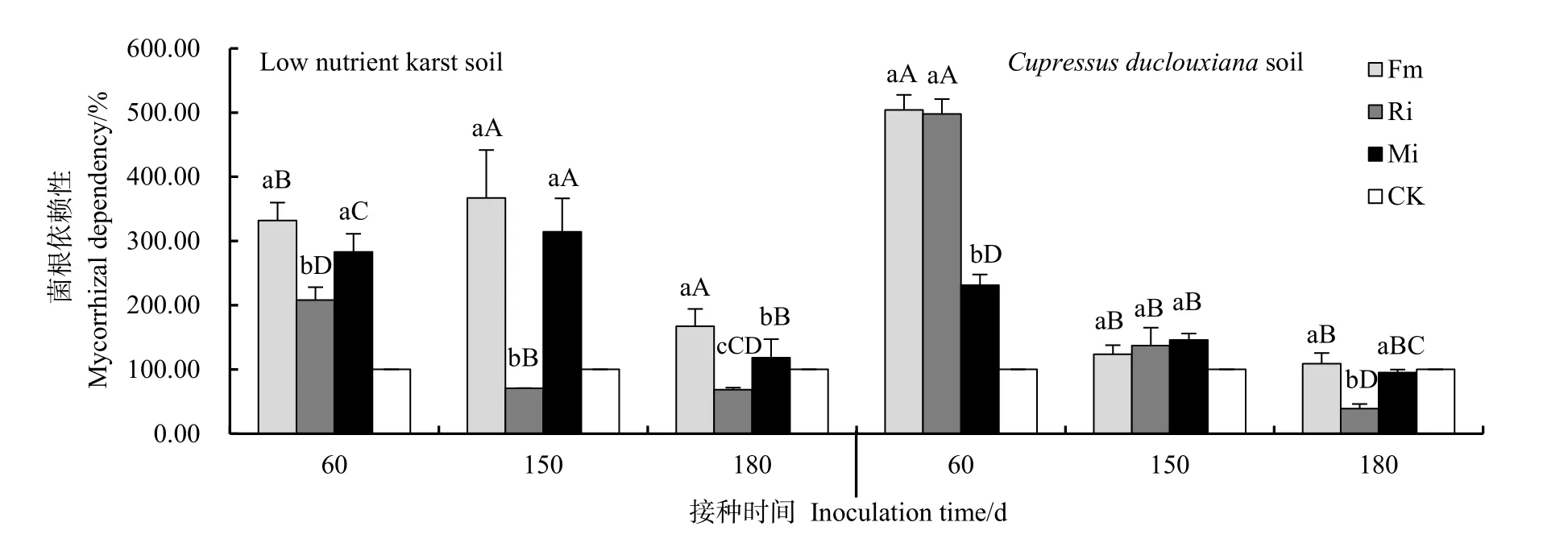
图5 不同时间不同接种处理任豆菌根依赖性Fig. 5 Mycorrhizal dependency of Zenia insignis with different inoculation time and different inoculation treatments

图6 收获期AMF接种对任豆株高生长影响Fig .6 Effect of AMF inoculation on height (H) of Zenia insignis at harvest
2.4 接种AMF对任豆生物量影响
收获期(表3),贫瘠喀斯特土壤生境下任豆生物量参数在Fm和Mi接种处理下均获得提高,地上生物量、地下生物量和总生物量分别提高83.90%和18.27%、42.20%和17.89%、67.34%和18.17%,Ri处理地上生物量、地下生物量和总生物量均低于对照,分别降低38.08%、21.10%和31.56%。Fm处理对任豆生物量影响最大,均高于其它两种处理;滇柏林下土壤,Fm接种处理具有最高生物量,地上生物量、地下生物量和总生物量分别提高6.77%、7.92%和8.89%,增加幅度均小于贫瘠喀斯特土壤生境Fm接种处理。Ri和Mi处理生物量呈降低趋势,Ri处理地上生物量、地下生物量和总生物量降低64.52%、52.89%和61.01%,Mi处理降低4.49%、13.70%和5.02%,Ri处理在两种喀斯特土壤上降低幅度一致,均与Fm处理达到显著差异水平。
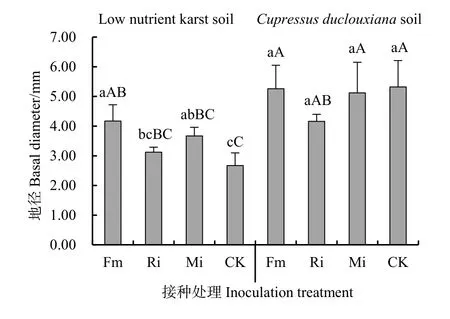
图7 收获期AMF接种对任豆地径生长影响Fig. 7 Effect of AMF inoculation on basal diameter (D) of Zenia insignis at harvest
2.5 接种AMF对任豆根冠比和根生物量比影响
贫瘠喀斯特土壤生境下(表 3),Ri处理根冠比、根生物量比高于CK,差异不显著;Mi和Fm处理根冠比、根生物量比均低于CK,Fm处理具最低根冠比和根生物量比,根冠比与其它处理差异显著,根生物量比与Ri差异显著;滇柏林下土壤,Ri处理具有最高根冠比和根生物量比,根冠比与其它处理差异显著,根生物量比与Fm和CK差异不显著,与Mi差异显著。
3 讨论
3.1 AMF对任豆根系侵染效果
任豆与AMF能形成菌根共生体,Fm效果优于Ri,Mi效果介于Fm和Ri之间。任豆侵染率随生长过程呈现先升高后降低的变化,这与马放等(2014)研究小麦接种摩西球囊霉和根内球囊霉的侵染效果一致。生长前期,任豆根系侵染效果较高,此时强化添加的AMF菌剂内孢子、菌丝、菌根根段等繁殖体丰富,形成强势侵染,可能加强了植物根系与菌根真菌之间的共生结合,因此侵染率较高(张淑娟等,2010)。贫瘠喀斯特土壤生境下,Fm、Mi接种处理侵染率在150 d出现最高点,后期单接种和混合接种都下降。随任豆生长,根系木质化程度加强,且菌丝、菌根根段、孢子消亡、老化,不利于AMF侵染,而且根系面积扩大,可能导致侵染率降低(马放等,2014);滇柏林下土壤生境下,Mi接种处理在任豆生长初期具有最高侵染率,随接种时间延长,单接种和混合接种侵染率都呈下降趋势,整个生长期单接种Fm和Ri侵染效果不显著,Mi侵染效果在任豆生长初期最高,随接种时间延长,Mi接种效果与单接种差异不显著。
通过任豆生长试验观察,生长初期 Ri接种出苗齐、快速,苗高,Fm接种出苗缓慢,苗矮;生长中后期,Ri接种植株生长放缓,Fm接种植株生长状况好转,植株株高、生物量最大。Mi接种表现出了单菌种兼容效应,初期出苗缓慢,随接种时间延长,植物长势好转。在喀斯特土壤生境下Ri接种处理具有苗木定植、出芽快速启动的特点,但后续促生效果下降,Fm接种生长初期促生效果启动慢,效果弱,生长后期促生效果加强,混合接种具有单接种的效应。AMF与植物建立共生体系需要启动时间,不同菌种启动时间快慢不同,混合接种可以弥补单接种不足。
3.2 不同喀斯特生境下AMF对任豆生长影响及菌根依赖性
不同接种时期,Fm在两种喀斯特土壤上均表现出最强菌根依赖性。无论是贫瘠喀斯特土壤还是养分较高的喀斯特土壤生境下,任豆幼苗对Fm菌根依赖性更高,促生效应更好。贫瘠土壤上任豆生长中后期,Fm菌根依赖性显著高于养分较高的滇柏林下土壤;生长中后期,混合接种在两种土壤生境上均表现出次于Fm的较强菌根依赖性。本研究与宋凤鸣等(2018)研究接种对任豆生长和抗旱性影响结论一致:Fm促生效应最大,显著提高任豆株高和生物量。说明Fm促生效果最佳,生态适应性最强,而混合接种也有利于单接种的优势互补。Ri接种在有机质和全氮质量比低且贫瘠的自然煤矸石中使玉米总干重增加31.04%(毕娜等,2016),而本研究中Ri处理无论在养分高或低的喀斯特土壤上对任豆生长促进作用均不显著或为负效应,这与Ri对玉米在风化和自然煤矸石基质上表现出的促生效果相反,有可能是同一菌种对不同培养基质或宿主植物的生态适应性不同所致,要有效使用AMF接种物,必须考虑土著微生物与引入的AMF、土壤性质和气候条件之间的兼容性(Li et al.,2019)。

表3 不同喀斯特生境下接种处理180 d对任豆生物量影响Table 3 Effects of inovulation treatment on the bomass of Zenia insignis in kars habitats
添加肥料土壤中磷水平与根系侵染率呈负相关,没有磷肥处理的土壤上栽种的植物与菌根真菌具有良好的共生效应(Miller et al.,1985)。本试验滇柏林下土壤pH值略低,全氮、全磷、有机质和水解性氮都显著高于贫瘠喀斯特土壤,有效磷、速效钾和交换性镁略高于贫瘠喀斯特土壤,由此表现出养分贫瘠喀斯特土壤上Fm菌根依赖性最高,促生效应最大;养分较高滇柏林下土壤Fm菌根依赖性降低,虽然促进任豆生物量积累,但增加幅度降低。Ri对任豆生物量积累的促进作用均表现出负效应,养分较高的滇柏林下降低幅度更大。Mi接种在低养分土壤上促进任豆生物量提高,但在养分较高土壤上任豆生物量低于对照处理。Mi处理是单接种Fm和Ri 1:1比例混合得到的处理,养分较高的滇柏林下土壤 Ri对植物生长表现出更大的负效应,导致混合接种也表现出生长负效应,说明 Ri在养分较高的喀斯特土壤上对植物生长的抑制效应更大。Ri与苹果砧木共生于高钙土壤上并没有获得最高的菌根效应,而在盐胁迫下却能显著提高桔子(Citrus aurantiumL.)、柠檬(Citrus volkamerianaTan. AndPasq.)砧木叶面积、叶和根干重等生长参数,增加植物叶片磷、钾、镁和锌浓度(Hoda et al.,2011),有可能根内球囊霉更适宜在盐胁迫生境中发挥作用。贫瘠喀斯特土壤养分含量低,pH值和总钙都高于滇柏林下土壤,Fm有可能在高钙低养分喀斯特土壤生境下更有利于发挥促生作用。
收获期,贫瘠喀斯特土壤生境下Fm处理显著促进任豆株高、地径及生物量提高,菌根依赖性大小与菌种对生物量的促进作用一致,Mi接种处理也具有促进作用,但Ri菌根依赖性为弱依赖或无依赖,导致对植物生长的负效应。养分较高滇柏林下土壤生境下Fm接种处理对任豆株高、生物量具有促进作用。Mi、Ri菌根依赖性为弱依赖或无依赖,任豆生物量、地径低于不接种处理,表现出负效应。摩西球囊霉在喀斯特土壤上与任豆共生,显著提高植物生长参数,具有促进喀斯特土壤上植物生长作用,该结果与 Wu et al.(2011)研究摩西球囊霉提高桃树(Prunus persicaL. Batsch)生长参数结论一致,而豆科牧草(Hedysarum coronariumL.)在石灰性土壤上接种摩西球囊霉却没有促进植物生长,摩西球囊霉与牧草共生不适合于钙质土壤(Azcón-Aguilar et al.,1982)。这也表明摩西球囊霉与宿主植物、土壤基质之间具有一定的偏好选择性,三者建立起有效的共生关系才能发挥最大菌根效应从而促进植物生长(屈明华等,2019)。菌根效应在低养分喀斯特生境下大于养分较高的喀斯特土壤,采用菌根真菌干扰途径,在贫瘠的喀斯特土壤上进行植被恢复更有潜力。
3.3 AMF对任豆根冠比和根生物量比影响
根冠比、根生物量比是反映植物协调积累状况的重要指标之一,植物能够调节根冠比来实现对逆境的适应(张绪成等,2008)。不同生境的喀斯特土壤,接种Ri的任豆菌根依赖性在收获期最低,根冠比、根生物量比最高,说明接种Ri对活化土壤养分效率低(屈明华等,2019),养分供应不足,使根冠比、根生物量增大,过大的根冠比、根生物量比导致过多的同化物在根部被消耗掉(张向前等,2017),限制了任豆生物量增加。贫瘠喀斯特土壤,Fm具有最低的根冠比和根生物量比,这说明Fm对养分胁迫生境具有良好的适应性,能够活化土壤养分,促进植物具有最大生物量,使植物易与定植成活,利于喀斯特生境下植被恢复。
4 结论
不同菌剂对任豆促生效果不同,摩西球囊霉在喀斯特土壤生境下均能有效提高任豆生物量累积,提高株高,促进植物生长;根内球囊霉促生效果不显著,喀斯特土壤生境下对任豆生物量累积为负效应,对株高、地径促进效应均低于摩西球囊霉和混合接种,混合接种促生效果介于单接种之间。
摩西球囊霉处理效果优于根内球囊霉处理,贫瘠喀斯特土壤上,摩西球囊霉接种促生效果优于养分较高喀斯特土壤,接种菌根真菌能够发挥更大作用。混合接种可弥补单接种不足,也可作为喀斯特侵蚀区植被恢复AMF干扰接种剂。以豆科植物任豆为宿主植物,摩西球囊霉为接种物,两者在喀斯特土壤生境下能形成良好共生关系,增加植株生物量,促进生长,易于定植,有利于喀斯特地区植被恢复。
致谢:感谢亚热带林业研究所袁志林研究员在菌根侵染结构试验和观察工作中给予的无私帮助!
