OmpR对伤寒沙门菌巨噬细胞内生存能力的影响
2020-04-11魏丹丹谢中艺杨帆帆林立萍黄新祥张盈
魏丹丹, 谢中艺, 杨帆帆, 林立萍, 黄新祥, 张盈
(江苏大学医学院, 江苏 镇江 212013)
伤寒沙门菌(Salmonellaentericaserovar Typhi,S. Typhi)属于肠杆菌科沙门菌属,人类是其唯一的感染宿主[1]。可经粪口途径传播感染人体引起消化系统感染,紧接着S. Typhi侵入肠壁淋巴组织并沿着淋巴管进入肠系膜淋巴组织,并被巨噬细胞吞噬,S. Typhi能够在巨噬细胞内存活和增殖,通过淋巴液及血液循环扩散到全身造成系统性感染[2]。
OmpR是双组分调节系统EnvZ/OmpR中的调节蛋白,磷酸化的OmpR参与许多信号传导[3]。研究表明,OmpR对酸应激、渗透压调节、上皮细胞侵袭能力等有重要意义[4],并且也是细菌氧化应激调控网络的一部分[5]。EnvZ/OmpR双组分系统也可通过沙门氏菌致病岛2(SalmonellaPathogenicity Island-2,SPI-2)调控Ⅲ型分泌系统(T3SS)的表达,从而影响细菌的毒力[6]。本研究利用ompR基因缺陷株(ΔompR)及回补株(C-ΔompR),探讨OmpR对S. Typhi巨噬细胞内生存能力的影响,并通过分析OmpR对细菌巨噬细胞内生存能力相关的SPI-2中3个操纵子首基因ssrA、ssrB和spiC的调控关系来研究其分子机制。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒S. Typhi野生株GIFU10007(WT)由日本岐阜大学医学院微生物学教研室馈赠;S. Typhi空载体对照株(WT-pBAD33),ompR缺陷带空质粒株(ΔompR-pBAD33),ompR回补株(C-ΔompR),ompR-pET28a-BL21重组蛋白表达菌由本实验室制备及保存;pBAD33质粒(氯霉素抗性)、pBAD33-ompR(ompR回补质粒);pHRP309-ssrA、pHRP309-ssrB和pHRP309-spiC分别为ssrA、ssrB和spiC基因启动子序列与pHRP309中的lacZ基因相连。
1.1.2 主要试剂 巨噬细胞THP-1购自上海生科院细胞库;Trizol试剂为Invitrogen公司产品; 逆转录试剂盒、SYBR荧光定量试剂盒、快速DNA消化试剂盒均为TaKaRa公司产品;凝胶阻滞实验(EMSA)上样缓冲液为碧云天生物技术有限公司产品;β-半乳糖苷酶活性检测试剂盒为Promega公司产品。
1.1.3 主要仪器 核酸紫外检测仪(德国Eppendorf公司);凝胶成像系统(英国SynGene公司);ABI2720型PCR仪,高速冷冻离心机以及CO2细胞培养箱均为美国Thermo公司产品;荧光定量PCR仪,电转化仪Gene Pulsero Ⅱ以及酶标仪均为美国Bio-Rad公司产品。
1.1.4 引物 基因特异性引物由苏州泓讯生物科技有限公司合成,序列见表1(下划线表示酶切位点)。

表1 特异性引物名称及相应序列
1.2 方法
1.2.1 细菌培养 将WT-pBAD33、ΔompR-pBAD33以及C-ΔompR接种于液体LB培养基中,37℃,250 r/min培养过夜作为种子液。按1 ∶100将种子液转接至新鲜的LB培养液中培养至对数早期[D(600 nm)约为0.4],加入0.2%(w/v)L-阿拉伯糖继续培养30 min以诱导ompR的表达。
1.2.2 THP-1胞内生存实验 THP-1细胞用含10%胎牛血清的RPMI 1640培养液,在37℃、5% CO2培养箱静置培养。细胞培养板中每孔接种5×105细胞,加入150 ng/mL佛波乙酯诱导THP-1细胞分化48 h,诱导率约为70%。实验前1 h给细胞换上新鲜的RPMI 1640培养液。将WT-pBAD33、ΔompR-pBAD33和C-ΔompR菌株按“1.2.1”所述培养诱导后,按MOI=10 ∶1加入THP-1细胞培养板中培养1 h。每孔加入100 μg/mL庆大霉素后继续培养1 h杀死胞外菌,弃上清液,PBS洗3次,将全部孔分为3等份。1/3孔内加入1 mL 0.5%(v/v)Triton X-100裂解细胞,适当稀释后涂在LB平板,37℃过夜培养后计数平板上的菌落并乘以稀释倍数记为T0;后2/3孔弃去1/2体积的培养液并加入等量新鲜培养液继续分别培养12 h和24 h,然后同样的方法计数菌落数记为T12和T24。计算并比较不同菌株的T12/T0和T24/T0(分别代表12 h和24 h细菌在巨噬细胞胞内存活能力)。实验进行3次生物学重复。
1.2.3 RNA提取和实时荧光定量PCR(qRT-PCR) 将WT-pBAD33和ΔompR-pBAD33分别接种至液体LB培养基,培养至对数早期,离心收集菌体。Tri-zol法提取细菌总RNA,取1 μg总RNA,DNA消化试剂盒消化基因组DNA后利用逆转录试剂盒将其逆转录为cDNA。使用ssrA、ssrB和spiC特异性引物进行qRT-PCR,以16 S rRNA为内参基因,采用相对定量法分析各基因mRNA表达水平。每组设有平行样,实验重复3次。
1.2.4 β-半乳糖苷酶活性检测 以S. Typhi基因组DNA为模板,利用特异性引物(序列见表1)PCR扩增目的片段,与pHRP309质粒进行双酶切后酶连,将产物热击至DH5α感受态细胞中,筛选阳性克隆提取质粒测序,序列比对完全正确后,将LacZ重组载体分别电转至WT和ΔompR感受态细胞中,PCR验证后,即菌株构建成功。将携带有LacZ重组质粒的WT和ΔompR培养至对数中期,离心弃上清, 预冷的 PBS洗涤2次后重悬。超声仪破菌,β-半乳糖苷酶活性检测酶联板孔中分别加入WT和ΔompR上清液,加入30 μL检测液后混匀,37℃静置至溶液完全变黄,记录反应时间,加入反应终止液混匀,利用酶标仪检测混合液的D(415 nm)值和D(595 nm)值。实验3次生物学重复。Miller Units的数值用来表示β-半乳糖苷酶活性,计算公式如下:Miller单位= 106×稀释倍数×[D(415 nm)-D(595 nm)]×1.75/[体积(μL)×作用时间(min)×D(600 nm)]。
1.2.5 OmpR蛋白的表达及纯化 接种ompR-pET28a-BL21重组蛋白表达菌至液体LB培养基中培养至对数期[D(600 nm)约为0.6],加入1 mmol/L IPTG,30℃,100 r/min诱导6 h。收集菌体后超声波破碎,离心(13 400 r/min,4℃,30 min),收集上清,用Ni柱纯化后转入透析袋中冰上透析,用PEG2000吸去透析袋中部分水分以浓缩蛋白,测浓度后使用SDS-PAGE分析其纯度,置于-80℃保存。
1.2.6 凝胶阻滞实验 以WT基因组DNA为模板,PCR特异性扩增ssrA、ssrB和spiC基因起始密码子上游约500 bp的启动子区域序列并纯化,16 S DNA作为阴性对照(引物见表1)。已纯化的His-OmpR蛋白溶液加入含20 mmol/L新鲜乙酰磷酸盐的结合缓冲液,室温孵育10 min使OmpR磷酸化,结合体系配制完成后,分别加入100 ng各基因启动子区DNA片段,30℃温育30 min后进行6%聚丙烯酰胺凝胶电泳,溴化乙啶染色后于凝胶成像仪显影且分析结果。
1.3 统计学分析
利用GraphPad Prism 6.0统计软件分析数据,多组间均数比较采用单因素方差分析,两组间均数比较采用t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 OmpR对伤寒沙门菌巨噬细胞内生存力的影响
为了研究OmpR对细菌巨噬细胞内生存力的影响,使用WT-pBAD33、ΔompR-pBAD33和C-ΔompR菌株进行THP-1胞内生存力实验。结果显示,ΔompR-pBAD33在巨噬细胞内的生存力相较于WT-pBAD33显著降低,而C-ΔompR生存能力较ΔompR-pBAD33部分恢复(P<0.01,图1),说明ompR的缺失可使S. Typhi在巨噬细胞内的生存能力下降。
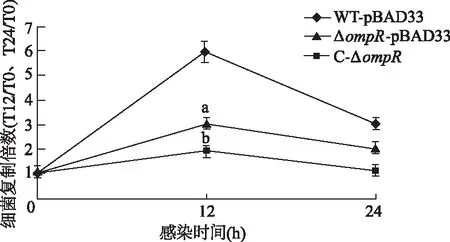
a: P<0.05,b: P<0.01,与同时间点WT-pBAD33比较
2.2 OmpR对巨噬细胞内生存力相关基因转录水平的影响
选择与巨噬细胞内生存能力密切相关的SPI-2中3个操纵子的首基因ssrA、ssrB和spiC进行qRT-PCR分析,结果显示,ΔompR-pBAD33中ssrA、ssrB和spiC的mRNA水平较WT-pBAD33明显降低(P<0.01)。进一步利用β-半乳糖苷酶活性检测实验研究OmpR对ssrA、ssrB和spiC转录活性的影响,结果显示,ΔompR中ssrA、ssrB和spiC的β-半乳糖苷酶活性比WT明显降低(P<0.01)。见图2。以上结果表明,OmpR正向调控ssrA、ssrB和spiC的转录。

a:P<0.05,b:P<0.01,与WT-pBAD33比较
图2 qRT-PCR和β-半乳糖苷酶活性实验检测ssrA、ssrB和spiC的mRNA水平
2.3 OmpR蛋白的表达及纯化
为了获得OmpR蛋白,使用BL21表达菌株表达His-OmpR蛋白。如图3所示,经1 mmol/L IPTG诱导后,His-OmpR蛋白的表达量较未诱导明显增加,并且在上清液中有His-OmpR蛋白的存在,说明表达了可溶性的蛋白;经Ni柱纯化后,只有单一的目的条带,说明去除了其他非目的蛋白;进一步经浓缩后,使用相同体积的蛋白样进行SDS-PAGE,条带明显加深,说明蛋白浓度明显增加,达到了浓缩的目的。

M:蛋白分子量标准参照物
2.4 OmpR蛋白与巨噬细胞内生存力相关基因的相互作用
利用凝胶阻滞实验检测His-OmpR蛋白与ssrA、ssrB和spiC基因启动子区域的相互作用。如图4所示:His-OmpR与ssrA、ssrB和spiC的启动子区域均有结合,且两者的结合均呈现剂量依赖性。以上结果表明,OmpR蛋白能直接与ssrA、ssrB和spiC的启动子区域结合来调节这些基因的表达。

16S DNA:阴性对照,1~8泳道分别加入浓度依次递增的蛋白
图4ssrA、ssrB和spiC的凝胶阻滞实验
3 讨论
S. Typhi是常见的肠道致病菌,可感染人体消化系统进而侵入淋巴系统引起全身症状[7]。S. Typhi感染人体后能够逃避免疫系统的杀伤,在被巨噬细胞吞噬后仍然能够存活且具有复制能力[8]。
S. Typhi在吞噬细胞内的复制是由SPI-2控制,SPI-2编码的T3SS-2在巨噬细胞内起作用。T3SS可将效应蛋白穿过吞噬体膜输送至宿主细胞的胞质中,对细菌在真核细胞内的存活有着重要作用[9]。目前认为,参与SPI-2基因表达调控的双组分系统共有3套:EnvZ/OmpR、SsrA/SsrB和PhoP/PhoQ。SsrA/SsrB中的反应调节因子SsrB可激活SPI-2结构基因的表达[10]。SpiC蛋白(也称为SsaB蛋白)是由SPI-2编码的含127个氨基酸的蛋白质。SpiC蛋白作为T3SS2的效应蛋白,既可介导其他效应器的分泌,也能通过干扰宿主Hook3和(或)Tassc蛋白的活性,抑制含沙门氏菌的噬菌体与溶酶体和吞噬体的融合。spiC突变体无法在巨噬细胞内复制,并且对小鼠的毒力减弱[11]。OmpR调节蛋白在ssrA和ssaB的基因区域富集,说明OmpR与SPI-2之间有着复杂的联系[12]。本文选择SPI-2中3个操纵子的首基因ssrA、ssrB和spiC,通过qRT-PCR和β-半乳糖苷酶活性实验发现 OmpR可促进这些基因的转录。进一步的EMSA实验显示,磷酸化的OmpR可直接与ssrA、ssrB和spiC基因启动子区域结合。综上所述,OmpR能够直接调节巨噬细胞内生存力相关基因ssrA、ssrB和spiC的表达,从而增强S. Typhi在巨噬细胞内的生存能力。此研究为进一步探讨OmpR的功能及相关分子调控机制奠定了基础。
