Fe2O3在锂离子电池负极材料中的研究进展
2020-04-11刘旭燕曾佳欢
刘旭燕, 薛 莲, 曾佳欢
(上海理工大学 机械工程学院,上海 200093)
随着21世纪对绿色能源需求的增长,一些可再生能源被不断开发,诸如太阳能、风能、核能和水力发电等[1-3]。为了将这些能源有效地利用起来,一般要通过电力储存装置来实现。由于锂离子电池具有高能量密度和低自放电特性,因此成功地成为便携式电子设备的主要储能系统[4-7]。由于石墨的库伦效率和安全性较高,通常被用作锂离子电池负极材料[8]。然而,较低的比容量(372 mA·h·g-1)和倍率性能限制了其发展,因此新型电极材料的研究变得尤为重要[9]。如今,研究者开发了许多潜在的锂离子电池负极材料,例如金属氧化物[10]、氮化物[11]、硫族化合物[12]、锂合金材料[13]、非石墨化碳[14]及其复合材料[15]。由于过渡金属氧化物具有高的理论比容量、丰富的资源和低成本,被认为是最有潜力的下一代负极材料之一。尤其是α-Fe2O3,理论比容量高达 1 007 mA·h·g-1,近年来受到了广泛关注[16-17]。
1 锂离子电池
锂离子电池由正极、负极、隔离膜和电解液等四个基本的部分组成,其工作原理如图1所示[18]。其中,负极材料是最关键的部件之一,其性能的优劣直接影响着锂离子电池整体的储能性能。随着工业化进程的不断加快,锂离子电池的发展也显得尤为重要。
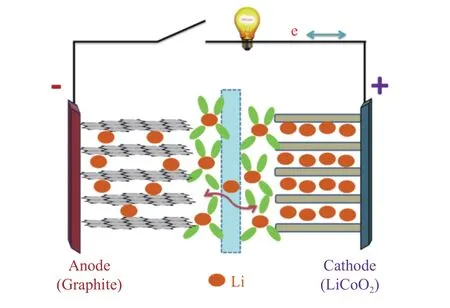
图 1 锂离子电池充放电过程原理图[18]Fig. 1 Schematic illustration of a lithium-ion battery during the charge/discharge process[18]
1.1 锂离子电池的工作原理
锂离子电池的充放电是通过嵌锂和脱锂这两个电化学过程来达到的,在这个过程中,锂离子以电解液作为介质在阳极和阴极之间作往复运动。在脱锂(放电)过程中,与负极材料结合的锂分解,产生锂离子和电子,锂离子通过电解质从负极传输到正极,而电子流过外部电路,为外部的电子器件提供电能;如果向电池施加外部电压(充电),则可以启动反向充电过程,将两个电极设置回充电状态,以便进行下一次放电[19-21]。
1.2 锂离子电池负极材料
当前,已经在实际生产应用中的负极材料大部分都是碳基材料,例如石墨、软碳和硬碳等。正在开发的负极材料有硅基材料、锡基材料、氮化物负极材料、过渡金属氧化物以及一些金属合金化合物。相比于其他材料,碳基材料具有比较高的容量、低的嵌锂电位、导电性好、安全性好、成本低以及优异的循环性能等优点,是最常用的商业化负极材料。随着各种各样的电子设备以及电动汽车对高容量电池的要求越来越高,研究者对新型的非碳质高性能负极材料展开了大量的研究。近年来,MnO,Fe2O3和TiO2等过渡金属氧化物也引起了研究者广泛的关注[22-23]。
一般来说,作为一种好的负极材料必须满足以下几点:(1)比容量高;(2)较低的嵌锂电位;(3)好的循环性能;(4)安全性高;(5)在脱嵌锂过程中结构稳定;(6)在自然界中资源丰富,成本低;(7)不与电解液发生反应。
2 Fe2O3的储锂机制以及合成方法
1982年,Thackeray等[24-25]首次研究了α-Fe2O3在锂嵌入时的结构变化,并预测了其在锂离子电池负极材料中的潜在应用。2000年,在过渡金属氧化物中证明了锂的可逆电化学转化反应,为其替代传统的石墨电极进一步提供了潜在的可能性[26]。Fe2O3是一种过渡金属氧化物,它有两种形态,包括赤铁矿(α-Fe2O3)和磁赤铁矿(β-Fe2O3),但是在自然界中,α-Fe2O3是最稳定的存在形态。α-Fe2O3是六方晶系结构,1个铁原子周围包围着6个氧原子,其结构如图2所示[27]。由于其具有高的理论比容量、安全性能好、无毒、环境友好、在自然界中储量丰富和成本低等优点,被广泛的应用于颜料[28]、气体传感器[29]、催化[30]、信息存储和储能[31-32]等领域。
2.1 Fe2O3的储锂机制
Fe2O3负极材料在充电过程中,锂离子会穿过电解液和隔膜嵌入Fe2O3的,生成LixFe2O3,随着反应的进一步进行,最后会生成Fe和Li2O。锂离子的嵌入过程可以用如下表达式来表示[33]:
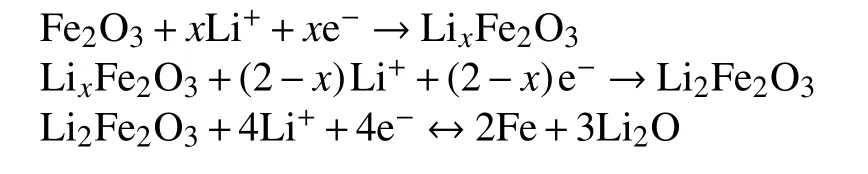
在放电过程中所对应的是锂离子的脱出,与此同时,铁也被逐步地由0价铁氧化成3价的铁离子,最终形成Fe2O3。Fe2O3的储锂机制简单来说就是,嵌锂时,锂离子和Fe2O3中的氧结合生成Li2O,脱锂时,Li2O又被还原成锂离子,Fe2O3也重新形成。在这个过程中,电极材料会发生较大的体积变化,甚至会导致电极的严重破坏,从而导致容量的快速衰减,影响电池的循环性能。因此,研究者通过设计不同类型的纳米结构Fe2O3或者将Fe2O3颗粒与不同类型的碳添加剂复合,用于改善电化学性能[34-36]。

图 2 赤铁矿(α-Fe2O3)[27]Fig. 2 Hematite (α-Fe2O3)[27]
2.2 Fe2O3负极材料的合成方法
Fe2O3具有很高的理论比容量,而且在自然界中资源丰富、价格低廉,因此是最有潜力的锂离子电池负极材料之一。经研究表明,过渡金属氧化物的储锂性能与其材料的尺寸有很大的关联,当将材料纳米化后,性能得到了很大的提升。现阶段,纳米结构Fe2O3的制备方法有很多,如水热法[37-38]、溶胶-凝胶法[39-40]、共沉积法[41-42]和熔盐法[43]等。
2.2.1 水热法
水热法是在密封的反应釜中,以水为溶剂,在高温高压条件下,反应物发生化学反应形成纳米颗粒的过程。水热法由于操作简单,形成的纳米粒子的粒径小,形态的可控性好,以及成本较低等优点,是当下最普遍的制备纳米材料的方法之一。但是,该方法对试验的要求较高,需要在高温高压下进行,一般用于实验室和小规模制备纳米材料,不适合工业上的批量生产。Nuli等[37]以FeCl3为前驱体,分子量为600的聚乙二醇(PEG-600)作为软模板,在160 ℃下水热反应,通过控制PEG-600的浓度和水热反应时间,合成了纳米球、纳米片、纳米棒和纳米线结构的Fe2O3。合成的纳米球具有高比表面积,表现出了优异的电化学性能,初始放电容量1 248 mA·h·g-1,在室温下循环30次之后的容量保持率为61.1%。Zheng等[38]利用水热法以Fe(NO3)3和NaF为原料在 170 ℃ 下反应 4 h,合成了介孔 α-Fe2O3颗粒。在0.2 C的电流密度下,首次放电容量和充电容量分别为 1 012 和 833 mA·h·g-1,在经过 100 次循环之后容量保持率为94%。优异的循环性能归因于两点:(1)高密度的介孔纳米粒子能够增加α-Fe2O3和电解液之间的接触,缩短锂离子的传输距离;(2)介孔结构能够极大地改善α-Fe2O3在脱嵌锂过程中的体积膨胀。
2.2.2 溶胶-凝胶法
溶胶-凝胶法的化学过程首先是将金属盐类溶解在溶剂中,经过水解反应形成溶胶,然后形成具有一定空间结构的凝胶,最终固化,通过加热处理制备出纳米颗粒或者其他所需要的材料。相比于其他方法,这种方法具有以下几个优点:(1)对试验环境要求不高,需要的合成温度较低;(2)所制备的纳米材料具有比较高的纯度,不易混入其他杂质;(3)试验设备简单。Wu等[39]利用柠檬酸和相对分子质量为6 000的聚乙二醇(PEG-6000)作为表面活性剂,通过溶胶-凝胶法合成了单相α-Fe2O3纳米粒子。当聚合物单体在600 ℃下煅烧时,所合成的单相α-Fe2O3纳米粉末具有最小的粒径,其大小为30 nm。Kopanja等[40]通过溶胶-凝胶燃烧法在无定形的SiO2中获得高分散的α-Fe2O3纳米颗粒。通过这种方法制备的α-Fe2O3纳米颗粒相比于传统的溶胶-凝胶法具有较高的磁化强度,这是由于表面原子间大量交换键断裂引起的表面自旋数量增加。
2.2.3 共沉淀法
共沉淀法是一种合成工艺简单,最早制备氧化物的方法。该方法是将沉淀剂加入含有一种或多种阳离子的盐溶液中,使盐溶液中的阳离子进行完全沉淀,然后去除溶液中多余的阴离子,最后通过进一步的热处理获得所需要的材料。这种方法的优点在于:可以直接通过溶液中一系列的化学反应得到均匀的纳米颗粒,并且得到的纳米颗粒尺寸较小。Supattarasakda等[41]在氮气氛围保护下,用少量的Fe(II)作为催化剂,通过简单的化学沉淀法合成了α-Fe2O3纳米颗粒。合成的α-Fe2O3纳米颗粒的粒径控制在50-150 nm,通过调整合成的条件,可以得到三种不同的形态:球形、立方体和椭圆形。其中,最小的粒子的电导率是最高的,其值为5.2×10-3s·cm-1。通过这种方法制备的α-Fe2O3纳米颗粒容易发生团聚,可以加入表面活性剂来抑制纳米颗粒的团聚,增加粒子的分散性。Lima等[42]以Fe(NO3)3·9H2O为铁源,蔗糖和甘油作为表面活性剂,通过共沉积法制备了纳米结构的α-Fe2O3。通过试验结果我们可以发现,加入不同浓度的表面活性剂,会影响其尺寸、形状以及粒径分布。
2.2.4 熔盐法
熔盐合成法通常采用一种或多种低熔点的盐类作为反应介质,利用反应物在熔盐中具有一定的溶解度,使得反应物在熔盐中很快的扩散,与熔盐进行充分的接触。待其充分反应后,加入对应的溶剂将盐类溶解,经过滤洗涤后可获得所需要的产物。熔盐法的优点有以下几点:(1)在反应过程中所需要的合成温度有明显的降低;(2)反应时间明显缩短。Hassan等[43]以 LiOH·H2O,LiNO3,H2O2和FeCl3·6H2O为原料,通过简单的熔盐法合成了纳米尺寸的α-Fe2O3。所制备的α-Fe2O3是菱面体相,晶体尺寸为20~40 nm,展示了良好的电化学性能。α-Fe2O3优异的循环性能和倍率性能由于多孔菱方结构的存在缩短了锂离子的传输距离,同时减小了在充放电过程中的体积膨胀。
α-Fe2O3的制备方法有很多种,除了以上介绍的四种之外,还有静电喷雾沉积法[44]、热分解法[45]、静电喷涂技术[46]、喷雾热解法[47]、电纺法[48]和电沉积法[49]等合成方法。
3 Fe2O3在锂离子电池负极材料中的研究进展
由于α-Fe2O3在充放电过程中会产生巨大的体积膨胀引起电极的损坏,从而导致α-Fe2O3在作为电极材料时,锂离子电池容量的快速衰减和循环性能变差[50-51]。为了提高α-Fe2O3电极材料在锂离子电池应用中的循环性能和倍率性能,研究者一般通过以下几种途径:(1)合成各种纳米结构的α-Fe2O3材料;(2)将α-Fe2O3颗粒与碳质材料结合以形成α-Fe2O3/C复合材料;(3)将α-Fe2O3颗粒与金属氧化物结合形成复合材料[52]。
3.1 纳米结构的Fe2O3负极材料
为了克服Fe2O3负极材料在充放电过程中容量快速衰减的问题,研究者就关于控制电极材料的结构、尺寸和形态等做了大量的研究。纳米结构材料在能源储存领域发挥了重要的作用,纳米结构不仅可以缩短锂离子的传输距离,而且可以让电极材料和电解液之间的接触更加充分,加快电化学反应进程。同时,Fe2O3纳米结构材料也能有效的缓解锂离子嵌入时的结构变化[53]。目前,已经合 成了各种形态的Fe2O3纳米结构,例如纳米颗粒[54],纳米纤维[56],纳米管[57],纳米棒[58],纳米微球[55]以及花状结构[59]等。
相比于其他的材料合成方法,微波辅助法是一种合成纳米晶体材料的新兴方法,具有加热时间短、加热速率快和热传导均匀等优点。Mondal等[54]用这种方法合成了两种不同尺寸的α-Fe2O3纳米颗粒,经过电化学性能测试,尺寸在200~300 nm的纳米颗粒比20~30 nm的颗粒显示出了更好的电化学性能,可逆容量达到了 1 012 mA·h·g-1。小尺寸的纳米颗粒在脱嵌锂过程中发生了团聚,减小了材料的比表面积,这导致电化学反应缺乏足够的电活性位点,最终影响了材料的电化学性能。
Cho等[55]通过三步法合成了中空结构的Fe2O3纳米微球,首先利用喷雾热解法合成了Fe2O3/C复合粉末,然后在还原和氧化气氛下进行后续热解处理,最后形成中空结构的Fe2O3纳米微球,其形成机理如图3所示。经过电化学性能测试,在3A·g-1的电流密度下,中空Fe2O3纳米微球的初始放电容量为 1 267 mA·h·g-1,经过 100 次循环后,放电容量为854 mA·h·g-1。中空Fe2O3纳米微球具有很高的结构稳定性,对充放电过程中材料的体积膨胀有极大的改善。
Chaudhari等[56]以三乙酰丙酮酸铁和聚乙烯吡咯烷酮(PVP)为原料,通过电纺法合成了具有中空结构的α-Fe2O3纳米纤维,这种结构具有高比表面积,对电化学性能有明显的提升。在0.06 C的电流密度下,首次放电和充电容量分别为1 795和1 213 mA·h·g-1,经过 40 次循环后,容量依旧保持在 1 293 mA·h·g-1,库伦效率在 95% 以上,表现出了优异的电化学性能。良好的容量保持率与α-Fe2O3纳米纤维的中空结构密不可分,这种结构可以适应充放电过程中脱嵌锂所引起的体积变化,由于纤维的互连性,还可以有效地防止活性材料从集流体上脱落。
Wang等[57]通过一步模板法和退火处理合成了具有薄壁的多晶α-Fe2O3纳米管,当作为锂离子电池负极材料时,与其他纳米结构相比,α-Fe2O3纳米管表现出优异的电化学性能。在0.01~3.00 V的电压范围内,α-Fe2O3纳米管的初始放电容量和充电容量分别为 1 377 和 1 018 mA·h·g-1,不可逆容量损失为23%,这可能主要归因于不可逆转的过程,比如固体电解质层(SEI膜)的形成和电解质的分解,这也是大多数负极材料都存在的问题。α-Fe2O3纳米管的合成工艺如图4所示。

图 3 中空结构的 Fe2O3 纳米微球的形成机理[55]Fig.3 Formation mechanism of the hollow Fe2O3 nanosphere[55]
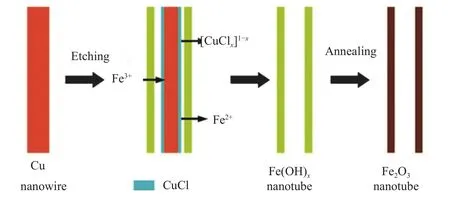
图 4 多晶 α-Fe2O3 纳米管的合成工艺[57]Fig.4 Synthesis process of polycrystalline α-Fe2O3 nanotubes[57]
3.2 Fe2O3/碳基材料复合材料
碳基材料有很多优点,如高比表面积,良好的导电性,高孔隙率和可控的粒度等[60-62]。在Fe2O3和碳基材料的复合材料中,碳材料起到限制缓冲作用,以确保结构的稳定性,并提高循环过程中的电导率。常用的和Fe2O3复合的碳基材料有碳纳米管[63]、碳纤维[64]、石墨烯[65]和碳气凝胶(carbon aerogel,CA)[62]等。
Liu等[62]首先通过溶胶-凝胶法合成了CA,然后通过进一步的热处理合成了Fe2O3/CA复合材料,其形成机理如图5所示。经过电化学性能测试,在100 mA·g-1的电流密度下,显示Fe2O3/CA-60(Fe2O3的质量分数是60%)的初始放电和充电容量分别为 1 521 和 916 mA·h·g-1,经过 100 次循环后,容量保持率为617 mA·h·g-1,而单一的Fe2O3和CA的容量仅为259和213 mA·h·g-1。较好的容量保持率主要归因于CA结构产生的更高的孔隙率,可以使电极材料能够适应充放电过程中的体积变化。

图 5 Fe2O3/CA 复合材料的形成原理[62]Fig.5 Forming mechanism of Fe2O3/CA composite[62]
Wu等[63]通过两步法合成了Fe2O3纳米带/碳纳米管(carbon nanotub,CNT)复合材料,首先他们以Fe(NO3)3·9H2O和H2C2O4为原料,通过热分解法制备FeC2O4沉淀,然后用均相沉淀法将FeC2O4沉淀在CNT上,最后通过热处理获得Fe2O3/CNT复合材料。经过电化学性能测试,电流密度100 mA·g-1下,Fe2O3纳米带/CNT 复合材料的初始可逆容量为848 mA·h·g-1,在经过50次循环后容量为866 mA·h·g-1,表现出了优异的循环性能,这主要归因于复合材料的网状结构,Fe2O3纳米带均匀的分散在CNT上,CNT提供有效的电子通道以增强储锂性能。
Wu等[64]以聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)为分散剂,通过一步水热法合成了Fe2O3纳米棒,在Fe2O3纳米棒形成的过程中加入卷曲的碳纳米纤维(carbon nanofiber,CNF),最终形成Fe2O3纳米棒/CNF复合材料,其制备方法如图6所示。经试验表明,在0.2C的电流密度下,单一的Fe2O3纳米棒首次和30次循环之后的容量分别为 1 069 和 560 mA·h·g-1,而 Fe2O3纳米棒/CNF复合材料表现出的容量为 1 278和 960 mA·h·g-1,电化学性能得到了显著的提升。当进行12C的大电流放电时,首次放电容量为 798 mA·h·g-1,优异的循环性能和倍率性能得益于碳纳米纤维的结合,提高了Fe2O3纳米棒的电子导电性和结构稳定性。
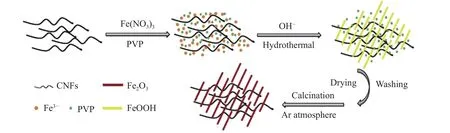
图 6 α-Fe2O3 纳米棒/CNF 复合材料的制备方法[64]Fig.6 Preparation method of α-Fe2O3 nanorods/CNFs composite[64]
3.3 Fe2O3/金属氧化物复合材料
由于纳米结构材料具有大的比表面积,电极材料和电解液之间容易发生分解反应,导致在电极表面形成SEI膜,增加不可逆容量和降低库伦效率。Fe2O3通过与金属氧化物复合能够有效的缓解这个问题,显著提高电极材料的导电性和锂离子电池的比容量。
Santhoshkumar等[66]首先通过水热法合成椭球状的α-Fe2O3纳米颗粒,然后通过进一步的反应合成MnO2@α-Fe2O3复合材料,反应原理如图7所示。电化学测试表明,在100 mA·h·g-1的电流密度下,MnO2@α-Fe2O3的首次放电容量为1 623 mA·h·g-1,而第二次的放电容量为 1 192 mA·h·g-1,这是由于SEI膜的形成和电解液的分解所造成的不可逆容量损失。相比之下,α-Fe2O3的首次和第二次的放电容量分别为 1 193和 781 mA·h·g-1,这是由于单一的α-Fe2O3在首次充放电之后发生了严重的体积变化,纳米结构材料发生了聚合,继续生成不稳定的SEI膜,导致了比较差的容量保持率。椭圆形的MnO2@α-Fe2O3优异的电化学性能可以归因于均匀和连续的MnO2涂层,通过纳米颗粒的持续完整性产生巨大的优势,使材料的导电性得到了显著的提高,致使在电极表面形成薄而稳定的SEI膜。
Chen等[67]通过一种简单的方法合成了Fe2O3/NiO微花结构复合材料,首先他们以K2[Ni(CN)4]和聚乙二醇(PEG)为原料合成了Fe(H2O)2[Ni(CN)4]前驱体,然后通过进一步的退火处理得到Fe2O3/NiO复合材料。经过电化学性能测试,电流密度在100 mA·g-1下,Fe2O3/NiO微花结构表现出了优异的电化学性能,首次放电容量为 1 653 mA·h·g-1,经过 50 次循环后容量保持率为 1 210 mA·h·g-1。优异的电化学性能归因于Fe2O3/NiO的分层多孔结构,可以增加锂离子储存的活性位点,以适应充放电循环期间的体积膨胀/收缩。

图 7 MnO2@α-Fe2O3 的反应原理[66]Fig.7 Reaction mechanism of MnO@α-2
4 结 语
综上所述,Fe2O3电极材料具有高理论比容量、储量丰富、可靠性好、无毒、环境友好和价格低廉等一系列优点,同时,也具有电导率较低、循环过程中的体积变化和循环性能差等缺点。
现阶段,改善Fe2O3电极材料电化学性能一般通过以下几种方法:
(1)合成各种纳米结构的Fe2O3材料;
(2)将Fe2O3颗粒与碳质材料结合以形成Fe2O3/C复合材料;
(3)将Fe2O3颗粒与金属氧化物结合形成复合材料。
通过上述3种方法可以改善电极材料的电子导电性,使电极材料能够适应充放电过程的体积效应,显著地提高锂离子电池的循环性能和倍率性能。为了加快Fe2O3电极材料在锂离子电池中的商业化应用,在研究如何改善电化学性能的基础上,还要进一步考虑现实生产中的工艺路线以及生产成本等因素。
