岩藻黄质对人红白血病HEL细胞的凋亡作用及其机制
2020-04-10徐丽华丁浩淼金旭东黄冠杰夏彭奎汪财生王忠华
徐丽华 丁浩淼 金旭东 黄冠杰 夏彭奎 汪财生 王忠华
(浙江万里学院生物与环境学院,浙江 宁波 315100)
白血病是造血系统的一种恶性肿瘤疾病。21世纪以来,14岁以下儿童罹患白血病比例最高,白血病在儿童及36岁以下年轻人的死亡率中居首位[1]。白血病主要包括四种类型:急性淋巴细胞白血病、急性髓系白血病、慢性淋巴细胞白血病和慢性髓系败血病,其发生与细胞的增殖失调、分化障碍、凋亡受阻密切相关,目前主要治疗手段有放疗、化疗、介入等,但治疗效果十分有限,且会对人体产生巨大的副作用[2-3]。因此,近年来从海洋资源中寻找安全、高效的天然抗肿瘤物质受到许多国家和学者的重视。研究表明,天然提取物具有抗氧化、抗肿瘤和免疫调节作用,且副作用小,具备作为药物用于预防癌症的潜力[4],其可以为白血病患者提供潜在的替代治疗。
岩藻黄质(fucoxanthin)又称岩藻黄素,属于类胡萝卜素中的叶黄素,广泛存在于各种藻类、海洋浮游植物、水生贝壳类等动植物中。岩藻黄质具有共轭双键,且含有丙二烯和环氧烷结构,具有抗肥胖活性、抗肿瘤活性、调节血糖等多种生理功效[5-7],近年来受到人们的广泛关注。多项研究表明,岩藻黄质能明显抑制白血病细胞的增值并诱导其凋亡,如Konishi 等[8]从海鞘中提取出岩藻黄质,发现其呈剂量和时间依赖性抑制人白血病HL-60 细胞生长,进一步研究发现岩藻黄质还能诱导人乳腺癌MCF-7 细胞和人结肠癌Caco-2 细胞凋亡;Kim 等[9]研究发现来源于铁钉菜中岩藻黄质通过ROS 介导的Bcl-xL 途径诱导人白血病HL-60 细胞的凋亡。人红白血病属于白血病的一种,前期一般转变是红白血病转急性白血病,有关岩藻黄质诱导人红白血病细胞凋亡的研究鲜见报道。因此,本研究以人红白血病细胞株HEL细胞为研究对象,初步探讨岩藻黄质对HEL细胞增殖抑制及诱导凋亡作用的分子机制,旨在为岩藻黄质应用于白血病的治疗提供试验依据。
1 材料与方法
1.1 细胞株及试剂
细胞株:HEL细胞,由中国科学院上海细胞库提供。岩藻黄质(货号:F6932,HPLC ≥95%),美国Sigma 公司;RPMI1640 培养基、胎牛血清,美国Gibco公司;青链霉素混合液(100×)、二甲基亚砜、MTT,北京索莱宝公司;25 cm2培养瓶、96 孔板、12 孔板、6 孔板,美国Corning 公司;Annexin Ⅴ-FITC/PI 细胞凋亡试剂盒、细胞周期试剂盒、线粒体膜电位检测试剂盒(JC-1),美国BD 公司;TRIzol、RT-PCR 相关试剂,日本TaKaRa 公司;兔anti-Bax 单克隆抗体、兔anti-Bcl-2单克隆抗体、兔anti-Bcl-xL 单克隆抗体、兔anti-Caspase-3 单克隆抗体、兔anti-GAPDH 单克隆抗体、HRP 标记羊抗兔抗体,美国Cell Signaling Technology公司;全蛋白提取试剂盒、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶配置试剂盒、聚氰基丙烯醇正丁酯(polybutylcyanoacrylate,BCA)蛋白定量试剂盒,杭州联科生物公司;Western blot 化学发光液,北京全式金公司;PVDF 膜,美国Millipore 公司。其余均为国产分析纯。
1.2 主要仪器与设备
Series ⅡWater Jacket 恒温CO2培养箱、Nano Drop 2000 分光光度计、Heraguard ECO 超净工作台、5417R 高速冷冻离心机,美国Thermo 公司;TI-DH 荧光倒置显微镜,日本Nikon 公司;CFX96Touch 荧光定量PCR 系统,美国Bio-Rad 公司;FACSVerse 流式细胞仪,美国BD 公司;SpectraMax190 连续波长多功能酶标仪,美国MD 公司;Clinx 凝胶成像仪,上海勤翔科学仪器有限公司;Mini 4K 涡旋振荡仪,上海生工生物工程有限公司。
1.3 细胞培养
HEL细胞株复苏后在37℃、5% CO2条件下,用含有10%胎牛血清、1%青霉素-链霉素的RPMI1640 培养基对HEL细胞进行常规培养。
1.4 MTT 法检测肿瘤细胞增殖抑制作用
取对数生长期的细胞,以5×104个·mL-1接种于96 孔板中,每孔加入100 μL细胞悬液,于细胞培养箱中继续培养24 h 后给药处理,每孔加药10 μL,每个浓度平行5个复孔。其中,空白组加入等量RPMI1640培养基及MTT溶液,对照组加入含细胞的培养基及MTT溶液,试验组分别加入岩藻黄质,使其终浓度为10、20、30 μg·mL-1,药物作用24 h 后,每孔中加入10 μL 5 mg·mL-1MTT溶液,继续在培养箱中孵育4 h,然后500×g离心15 min,吸取上清液加入100 μL 二甲基亚砜,置于摇床上低速避光震荡15 min,使晶体充分溶解,用酶标仪测定540 nm 处OD值[10-11],按照公式计算细胞存活率:
细胞存活率=[(As-Ab)/(Ac-Ab)]×100%
式中,As为试验孔(含有细胞的培养基、MTT、岩藻黄质)OD值;Ac为对照孔(含有细胞的培养基、MTT、没有岩藻黄质)OD值;Ab为空白孔(不含有细胞和岩藻黄质、含有MTT)OD值。
1.5 Hoechst 法检测HEL细胞凋亡形态
取生长状态良好的细胞以5×104个·mL-1接种于12 孔板中,每孔加入1 mL细胞悬液,于细胞培养箱中继续培养24 h 后给药处理,每孔加入100 μL 岩藻黄质,使其终浓度分别为10、20、30 μg·mL-1,对照组加入100 μL 1640 培养基,药物作用24 h 后,500×g离心10 min,用4℃磷酸盐缓冲液(phosphate buffered solution,PBS)清洗2次,小心吸出上清液,加入0.5 mL 固定液固定10 min,然后加入0.5 mL Hoechst 33258 染色液孵育5 min,500×g离心5 min,去除染色液后再用PBS 清洗2次,置于荧光倒置显微镜下观察细胞凋亡形态并拍照。
1.6 流式细胞仪检测HEL细胞的早期、晚期凋亡率
取生长状态良好的细胞以5×104个·mL-1接种于12 孔板中,每孔加入1 mL细胞悬液,于细胞培养箱中继续培养24 h 后给药处理,每孔加入100 μL 岩藻黄质,使其终浓度分别为10、20、30 μg·mL-1,对照组加入100 μL 1640 培养基,药物作用24 h 后,500×g离心10 min,用预冷的PBS 清洗2次,小心吸出上清液,用100 μL 双染孵育液将细胞重悬,然后向重悬液中先加入5 μL Annexin Ⅴ-FITC 染液,再加入5 μL PI 染液,置于摇床上室温低速避光染色15 min[12-13]。检测前加入400 μL 双染孵育液混匀后检测细胞的凋亡情况,统计早期凋亡、晚期凋亡的细胞比例。
1.7 流式细胞仪检测HEL细胞的周期分布
取生长状态良好的细胞以5×104个·mL-1接种于6 孔板中,每孔加入细胞悬液2 mL,于细胞培养箱中继续培养24 h 后给药处理,每孔加入200 μL 岩藻黄质,使其终浓度分别为10、20、30 μg·mL-1,对照组加入100 μL 1640 培养基,药物作用24 h 后,500×g离心10 min,PBS 洗涤2次,然后加入5 mL 70%乙醇于-20℃固定18 h 以上,再于500×g离心10 min 得到固定后的细胞沉淀,用预冷的PBS 洗涤细胞2次,最后加入0.5 mL RNaseA/PI 染料,在室温放置20 min,用流式细胞仪检测个组细胞周期分布情况[14-15]。
1.8 流式细胞仪检测HEL细胞线粒体膜电位
取生长状态良好的细胞以5×104个·mL-1接种于12 孔板中,每孔加入1 mL细胞悬液,于细胞培养箱中继续培养24 h 后给药处理,每孔加入100 μL 岩藻黄质,使其终浓度分别为10、20、30 μg·mL-1,对照组加入100 μL 1640 培养基药物作用24 h 后,于500×g离心10 min,然后向每管分别加入0.5 mL 新鲜制备的JC-1 工作液,重悬后放入37℃CO2培养箱中静置15 min,再于500×g离心10 min,吸取上清液后加入2 mL缓冲液重悬再次离心,重复1次,最后加入0.5 mL 缓冲液于细胞沉淀,用流式细胞仪检测各组细胞线粒体膜电位变化情况[16-18]。
1.9 RT-qPCR检测凋亡相关基因mRNA的表达
取生长状态良好的细胞以5×104个·mL-1接种于6 孔板中,每孔加入2 mL细胞悬液,于细胞培养箱中继续培养24 h 后给药处理,每孔加入200 μL 岩藻黄质,使其终浓度分别为10、20、30 μg·mL-1,对照组加入200 μL 1640 培养基,药物作用24 h 后,500×g离心10 min 得到细胞沉淀[19]。利用TRIzol 法提取细胞总RNA,根据提取的RNA 量,用25 μL DEPC 水溶解,用NanoDrop 测定RNA 浓度。参照反转录试剂盒说明书(日本TaKaRa 公司)进行cDNA合成。反转录体系:PrimeScript RT Enzyme Mix Ⅰ1.0 μL、RT Primer Mix 1.0 μL、5×PrimeScript Buffer 2 (for Real Time) 4.0 μL、Rnase Free dH2O 4.0 μL,于37℃反应15 min,85℃反应5 s[20]。PCR 反应程序:95℃预变性30 s;95℃5 s,60℃ 30 s,72℃ 15 s,共40个循环。RTqPCR 所用扩增引物序列如表1所示。

表1 用于RT-qPCR 分析的引物序列Table1 The primer sequences of RT-qPCR
1.10 Western blot 检测凋亡相关蛋白的表达
取生长状态良好的细胞以5×104个·mL-1接种于6 孔板中,每孔加入2 mL细胞悬液,于细胞培养箱中继续培养24 h 后给药处理,每孔加入岩藻黄质200 μL,使其终浓度分别为10、20、30 μg·mL-1,对照组加入200 μL 1640 培养基,药物作用24 h 后,500×g离心10 min 得到细胞沉淀。每管细胞加入150 μL RIPA 裂解液,冰上裂解30 min,随后12 000 r·min-1离心30 min,保留上清液,并采用Bradford 法测定蛋白浓度。在12%聚丙烯酰胺凝胶上分离后,将蛋白质转移至聚偏二氟乙烯(poly vinylidene fluoride,PVDF)膜上,随后用5%脱脂牛奶室温封闭2 h,用1∶1 000 比例稀释的一抗于4℃条件孵育12 h,次日用TBST 洗涤PVDF膜,用抗兔的二抗于室温孵育PVDF 膜2 h,接着用TBST 洗净抗体,加入发光液1 min 后用成像仪曝光显影并观察[21-23]。
1.11 数据处理
采用SPSS 14.0 软件中的ANOVA 模块对试验数据进行方差分析,各组试验至少重复3次。
2 结果与分析
2.1 岩藻黄质对HEL细胞存活率的影响
由图1可知,不同浓度的岩藻黄质对HEL细胞生长均有抑制作用,当岩藻黄质浓度为10 μg·mL-1时,HEL细胞的存活率为78.12%,当岩藻黄质浓度为20 μg·mL-1时,细胞存活率下降至60.18%;随着岩藻黄质浓度的增加,HEL细胞的存活率不断下降,呈剂量依赖性,当岩藻黄质浓度为30 μg·mL-1时,HEL细胞的存活率急剧下降为20.82%,各处理之间差异极显著。经计算岩藻黄质处理HEL细胞24 h 所对应的半抑制浓度(50% inhibiting concentration,IC50)为22.78 μg·mL-1。
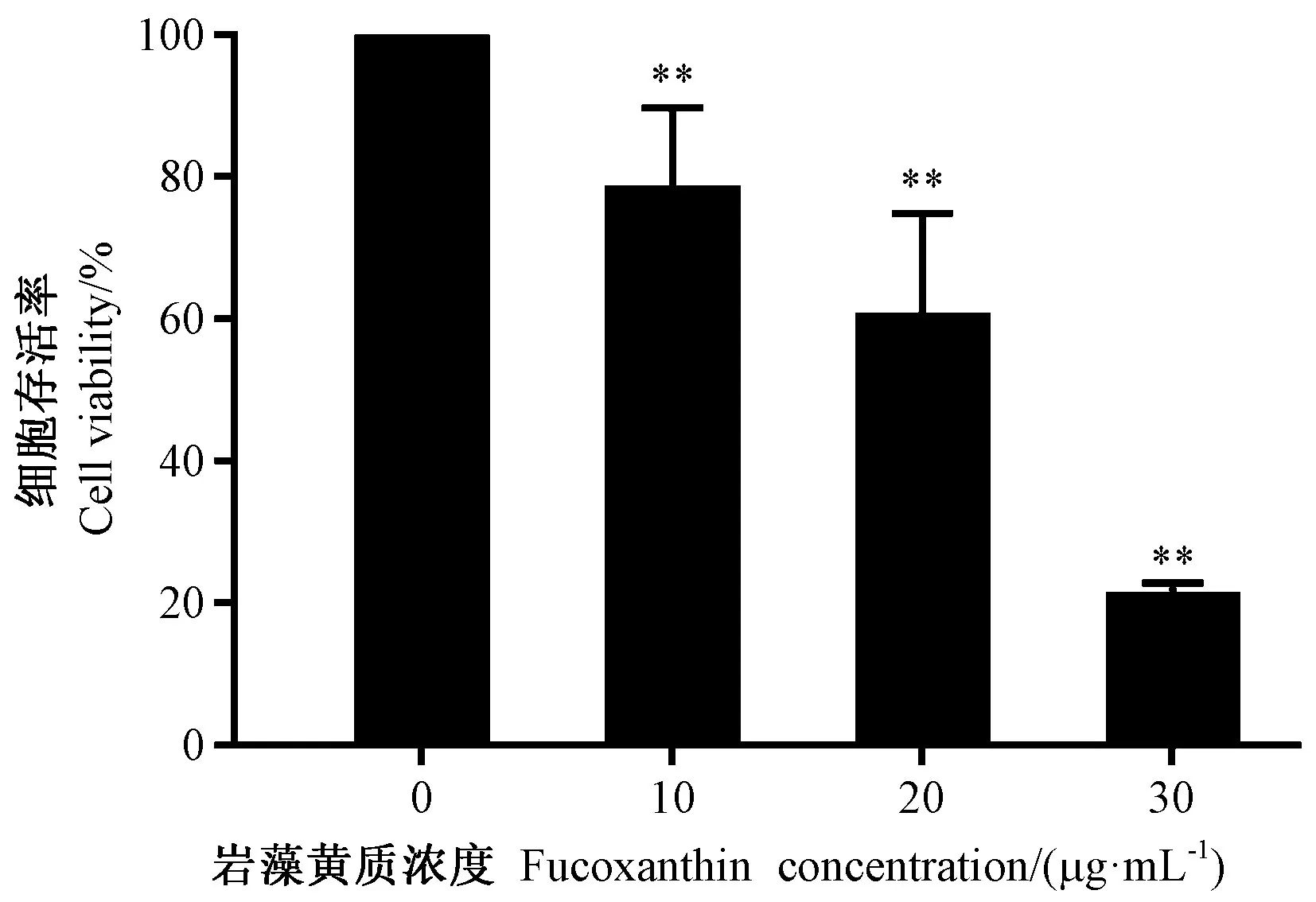
图1 岩藻黄质对HEL细胞存活率的影响Fig.1 Effect of fucoxanthin on the proliferation of HEL cells
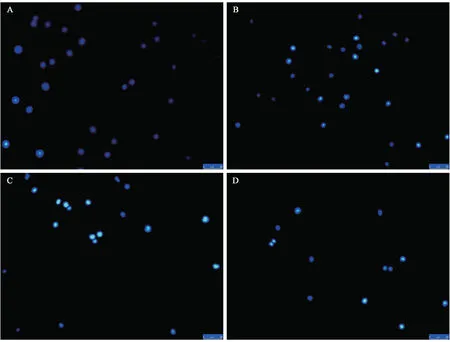
图2 岩藻黄质对HEL细胞凋亡形态的影响Fig.2 Effect of fucoxanthin on apoptosis morphology of HEL cells
2.2 岩藻黄质对HEL细胞形态的影响
Hoechst 染色观察岩藻黄质诱导的HEL细胞形态变化,结果显示,对照组的细胞核界限清晰,呈圆形或椭圆形,有均匀荧光,染色质分布均匀,细胞膜完整(图2-A);随着岩藻黄质浓度升高,HEL细胞染色质分布不均匀,部分细胞的细胞核缩小,染色质凝集,呈颗粒团状分布,有的细胞中形成多个球形颗粒,同时可见已破碎的核等凋亡特征,且凋亡细胞比例随着岩藻黄质浓度的增加而增多,当岩藻黄质浓度为30 μg·mL-1时,HEL细胞数量明显减少(图2-B、C、D)。
2.3 岩藻黄质对HEL细胞早期和晚期凋亡的影响
由图3可知,对照组HEL细胞凋亡率为7.39%,当岩藻黄质浓度为10 μg·mL-1时,HEL细胞的凋亡率为12.28%(早期凋亡为2.96%,晚期凋亡为6.04%);当岩藻黄质浓度为20 μg·mL-1时,HEL细胞的凋亡率为48.67% (早期凋亡为24.79%,晚期凋亡为23.88%);随着岩藻黄质浓度的增加,HEL细胞的凋亡率不断增大,当岩藻黄质浓度为30 μg·mL-1时,HEL细胞的凋亡率急剧增加至84.58% (早期凋亡为16.74%,晚期凋亡为67.84%)。岩藻黄质能明显增加细胞的早期和晚期凋亡比例,表明岩藻黄质促进了HEL细胞的凋亡,进一步证实了MTT 法测定细胞增殖的抑制结果。
2.4 岩藻黄质对HEL细胞周期分布的影响
为探究岩藻黄质如何影响细胞的生长,利用流式细胞技术测定不同处理条件下细胞内周期分布情况,结果如图4所示。与对照组相比,随着岩藻黄质浓度的增加,G0/G1期的HEL细胞比例显著增加,S期和G2/M期的HEL细胞比例显著减少,当岩藻黄质浓度为30 μg·mL-1时,G2/M期的HEL细胞比例为0,S期的HEL细胞比例为38.26%,说明岩藻黄质使细胞阻滞在G0/G1期,这可能是其抑制细胞增长和细胞分裂的重要原因。
2.5 岩藻黄质对HEL细胞的线粒体膜电位的影响
由图5-A可知,在对照组的细胞群中的FITC和PE 通道均能观察到JC-1 荧光,95.30% HEL细胞呈现红色荧光,3.54% HEL细胞呈现绿色荧光。由图5-B~D可知,随着岩藻黄质浓度的增加,呈红色荧光的细胞数量逐渐降低,呈绿色荧光的细胞数量逐渐增多,表明岩藻黄质可诱导HEL细胞线粒体膜电位降低。
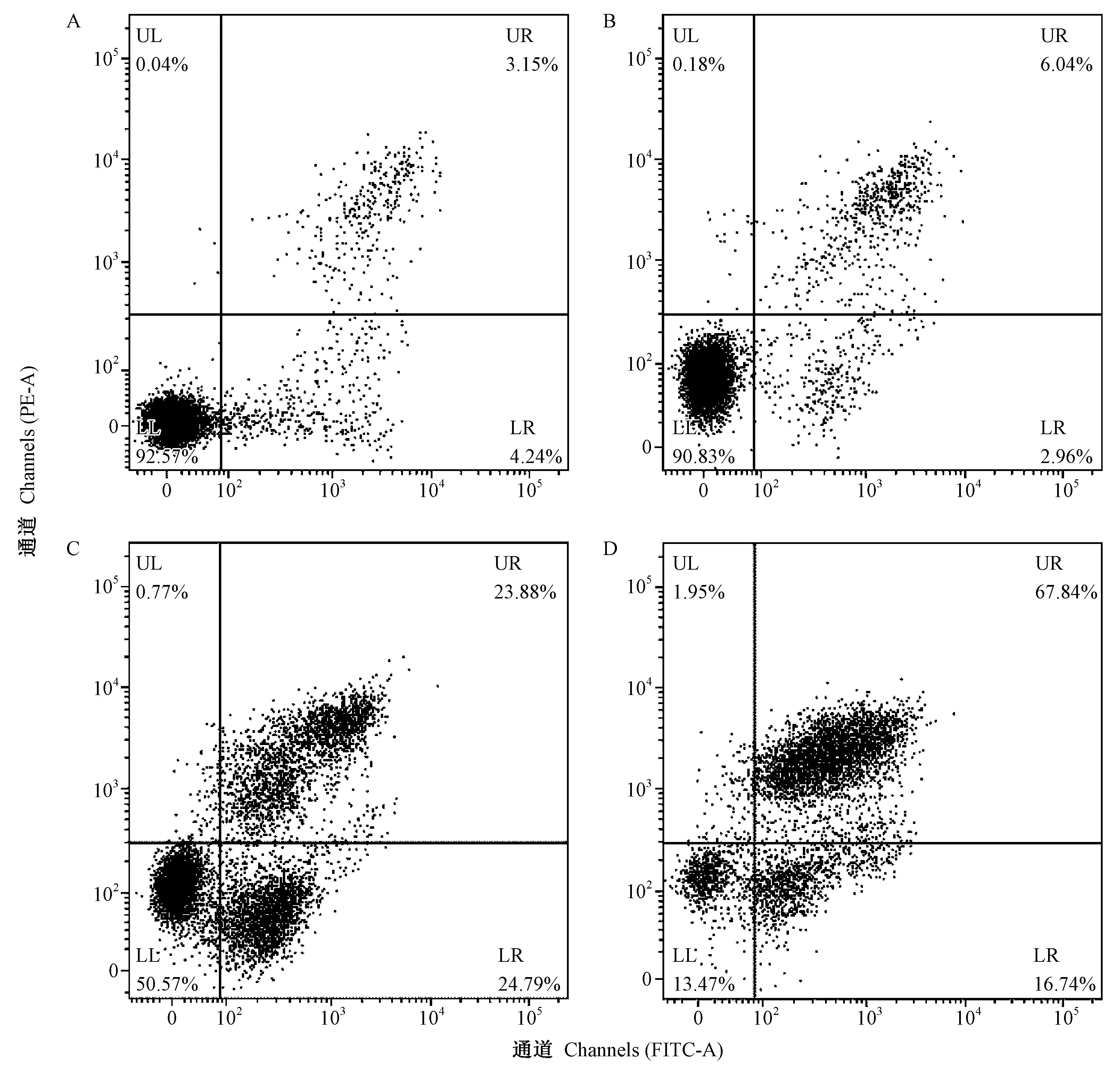
图3 岩藻黄质对HEL细胞凋亡的影响Fig.3 Effect of fucoxanthin on apoptosis of HEL cells
2.6 岩藻黄质对HEL细胞凋亡相关基因的影响
由图6可知,岩藻黄质处理引起促凋亡基因Bax和Caspase-3的相对表达量显著或极显著升高,抑凋亡基因Bcl-2和Bcl-xL的相对表达量则出现明显下调。由图7可知,Bcl-2/Bax的比值也随着岩藻黄质浓度的增加不断减小,细胞不断发生凋亡,这与流式细胞仪的检测结果一致。
2.7 岩藻黄质对HEL细胞凋亡相关蛋白的影响
利用Western blot 法同时检测细胞内凋亡蛋白的表达。由图8、图9可知,岩藻黄质处理HEL细胞后,细胞内Bax、Caspase-3 蛋白水平极显著上调(P<0.01),Bcl-xL、Bcl-2 蛋白水平下调,但Bcl-xL 蛋白的表达未发生明显变化(P>0.05)。以上结果表明,岩藻黄质通过上调促凋亡基因和蛋白的表达,下调抑凋亡基因和蛋白的表达,最终引起了HEL细胞的凋亡。
3 讨论
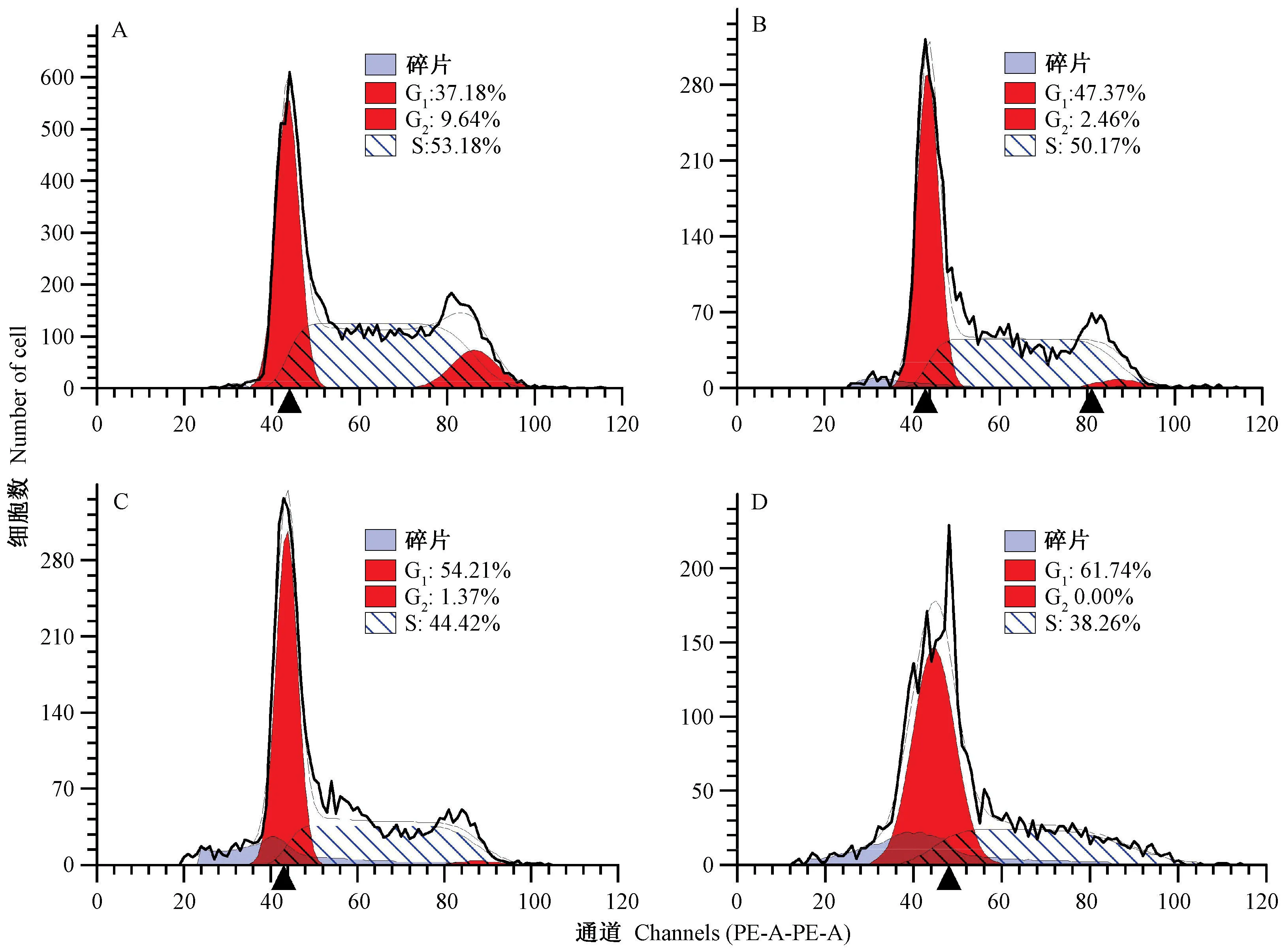
图4 岩藻黄质对HEL细胞周期的影响Fig.4 Effect of fucoxanthin on HEL cell cycle
天然产物长期以来被广泛用于治疗癌症,是抗癌药物的重要来源,在预防和治疗肿瘤中的重要性日益明显。岩藻黄质已成为潜在的抗癌药物,在各种细胞系中表现出良好的抗癌活性,研究报道岩藻黄质能诱导HL-60、MCF-7和Caco-2 细胞凋亡[4]。本试验以体外培养的人红白血病HEL细胞为对象,发现岩藻黄质能诱导人红白血病HEL细胞凋亡。不同浓度的岩藻黄质对HEL细胞的生长均有抑制作用,随着岩藻黄质浓度的增加,HEL细胞的存活率不断下降,且染色质固缩细胞数目明显增多,呈剂量依赖性,高浓度岩藻黄质作用下HEL细胞数目也明显减少。细胞凋亡是一种程序性细胞死亡过程,而细胞发生凋亡时会有一系列的形态学特征改变,其中质膜的改变是早期凋亡的特征之一。细胞发生凋亡时,胞膜磷脂酰丝氨酸从胞膜内侧翻转到外侧,暴露于细胞外表面。AnnexinⅤ是一个Ca2+依赖性的磷脂结合蛋白,它与磷脂酰丝氨酸有高度亲和力,可以结合细胞外暴露的磷脂酰丝氨酸[24]。PI 不能渗透具有完整细胞膜的活细胞,但可以渗透凋亡细胞和受损细胞的细胞膜。因此,PI 可以渗透细胞膜,将处于细胞凋亡中期或晚期的细胞染色。为了进一步确定岩藻黄质对HEL活力影响是否与凋亡诱导相关,本研究使用Annexin Ⅴ/PI 标记细胞,并用流式细胞仪测定凋亡细胞的百分比,结果表明,随着岩藻黄质浓度的增加,HEL细胞的凋亡率不断增加,当岩藻黄质浓度为30 μg·mL-1时,HEL细胞的凋亡率急剧增高,表明岩藻黄质能增加细胞的早期和晚期凋亡比例。Tumura 等[25]研究表明,岩藻黄质可以诱导结肠癌细胞凋亡,25 μmol·L-1岩藻黄质处理结肠癌细胞48 h,早凋细胞和晚凋细胞比例分别为13%和52%,与本研究结果相似。本研究发现,随着岩藻黄质浓度的增加,G0/G1期细胞呈剂量依赖性增加,S期和G2/M期的细胞呈剂量依赖性减少,说明岩藻黄质导致HEL细胞不能复制受损的DNA,诱导细胞G0/G1期周期阻滞。Foo 等[27]研究发现,从角毛藻中提取的岩藻黄质能诱导肝癌细胞凋亡,作用72 h 后,G0/G1期细胞比例为47.04%,低于本试验G0/G1期的细胞比例,这可能与提取的岩藻黄质纯度有关。线粒体膜电位的下降是细胞凋亡早期的一个标志性事件,JC-1是一种检测线粒体膜电位的理想荧光探针[28]。本研究中,随着岩藻黄质浓度的增加,线粒体膜电位不断下降,与对照组相比,当岩藻黄质浓度为30 μg·mL-1时,线粒体膜电位下降了50.3个百分点。Liu 等[29]也发现岩藻黄质可以诱导人恶性胶质瘤的凋亡,当岩藻黄质浓度为50 μmol·L-1时,线粒体膜电位显著下降。Garg 等[30]研究发现岩藻黄质具有很强的抗癌活性,对照组和处理组的细胞表型驱动的分子对接表明,1 μmol·L-1岩藻黄质可导致与细胞增殖、存活和癌细胞转移相关的标志性蛋白减少,岩藻黄质处理HEL细胞24 h 所对应的IC50为0.03 μmol·L-1,表明其对HEL细胞抑制效果高于对MCF-7、A549和SKOV3肿瘤细胞的抑制效果。
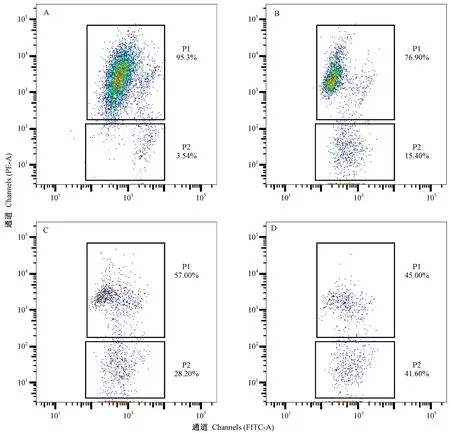
图5 岩藻黄质对HEL细胞线粒体膜电位的影响Fig.5 Effect of fucoxanthin on mitochondrial membrane potential of HEL cells
细胞凋亡是一种严格受控的细胞死亡模式,以核固缩、细胞皱缩、细胞膜起泡和DNA片段化为特征。凋亡的核心调控分子是Caspase,这是一个半胱氨酸蛋白酶家族,分为两类:与上游促凋亡信号紧密联系的“启动型”和通过剪切、活化激活下的“执行型”,从而引起最终负责程序性细胞死亡的蛋白质发生变化。内源性和外源性途径可以激活Caspase,内源性途径主要受到Bcl-2 蛋白家族调控因子的影响[31]。抗凋亡蛋白Bcl-2和Bcl-xL 驻留在线粒体外膜中,促凋亡蛋白Bax 可驻留在细胞质中,在接受死亡信号后易位到线粒体中。本研究中,岩藻黄质作用HEL细胞24 h 后,抗凋亡Bcl-2 基因及蛋白表达量降低,促凋亡Bax基因及蛋白表达量上升,与Bcl-xL 形成促凋亡复合体,释放细胞色素C,导致促凋亡Caspase-3 基因和蛋白的激活,促凋亡Caspase-3 总蛋白表达量增高,从而诱导细胞凋亡。
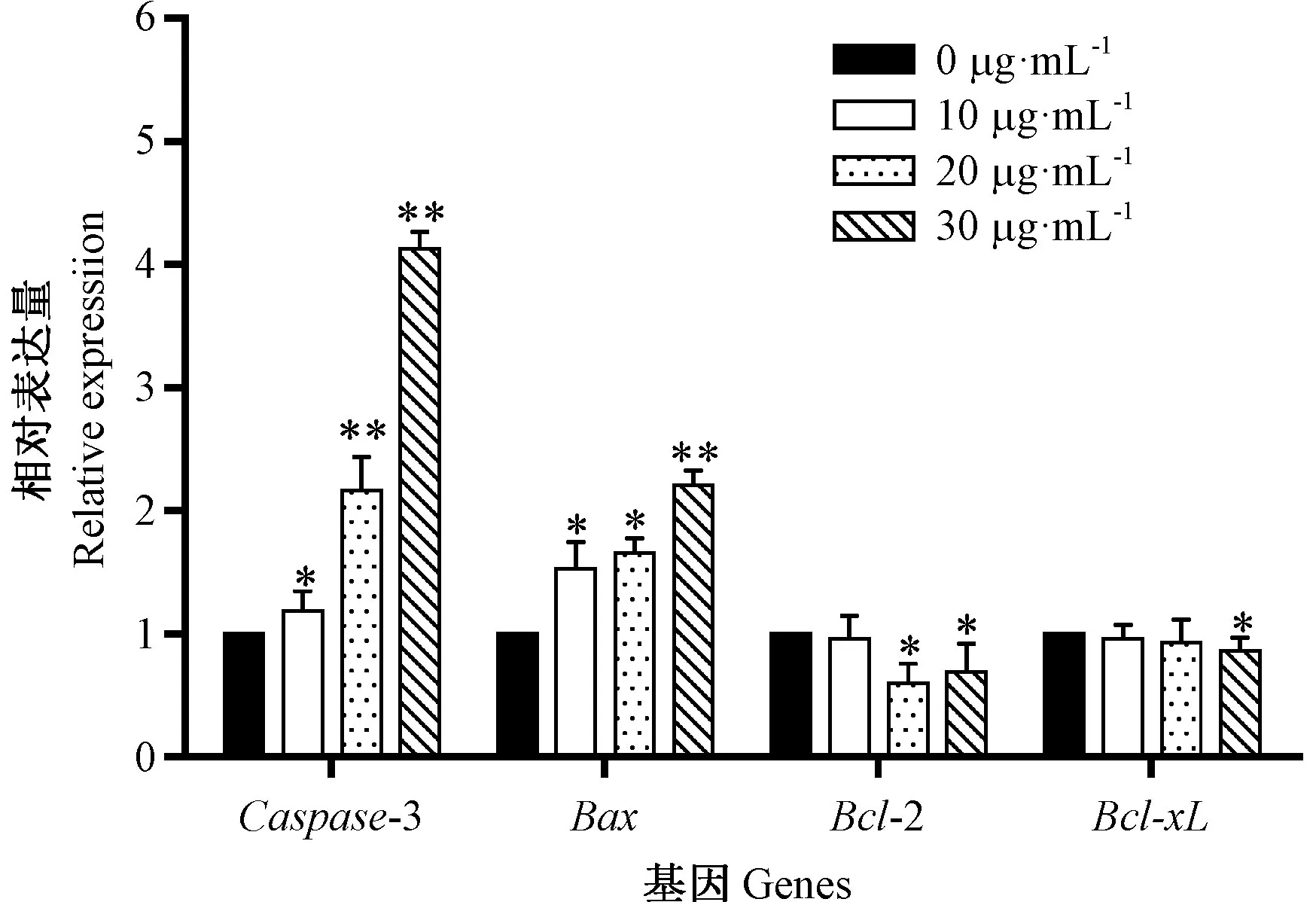
图6 岩藻黄质对HEL细胞凋亡相关基因的影响Fig.6 Effect of fucoxanthin on the expression of apoptosis-related genes in HEL cells
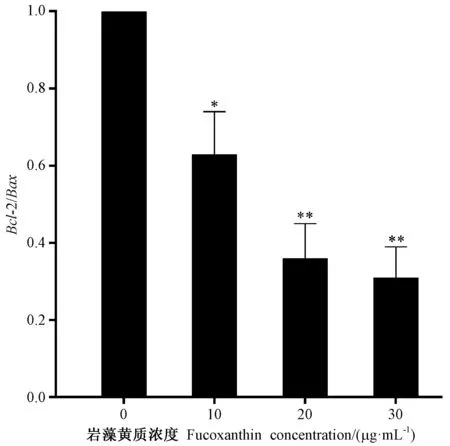
图7 岩藻黄质对HEL细胞凋亡基因Bcl-2/Bax的影响Fig.7 Effect of fucoxanthin on Bcl-2/Bax of apoptosis genes in HEL cells
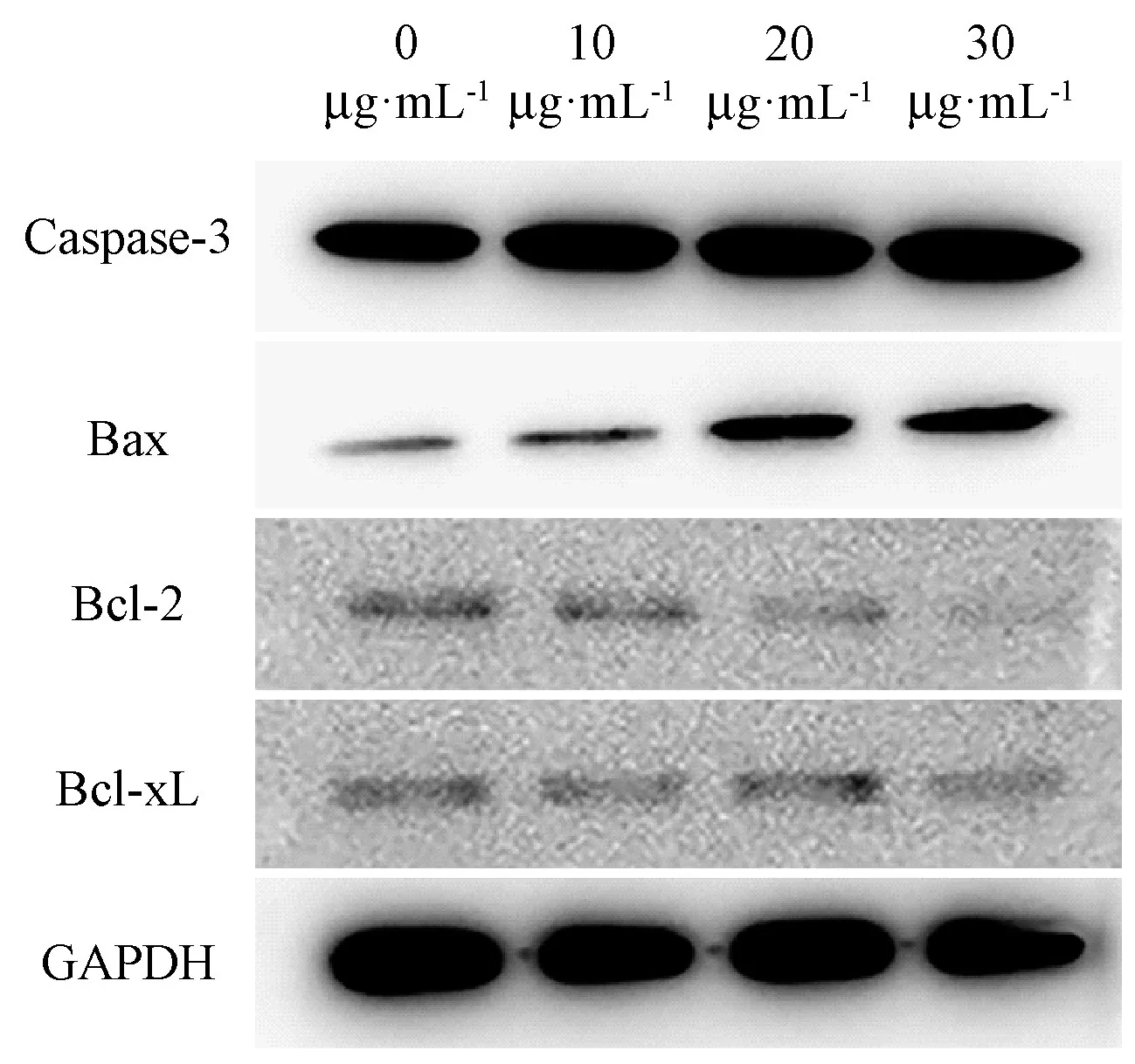
图8 岩藻黄质对HEL细胞凋亡相关蛋白的表达Fig.8 Effect of fucoxanthin on the expression of apoptosis-related proteins of HEL cells
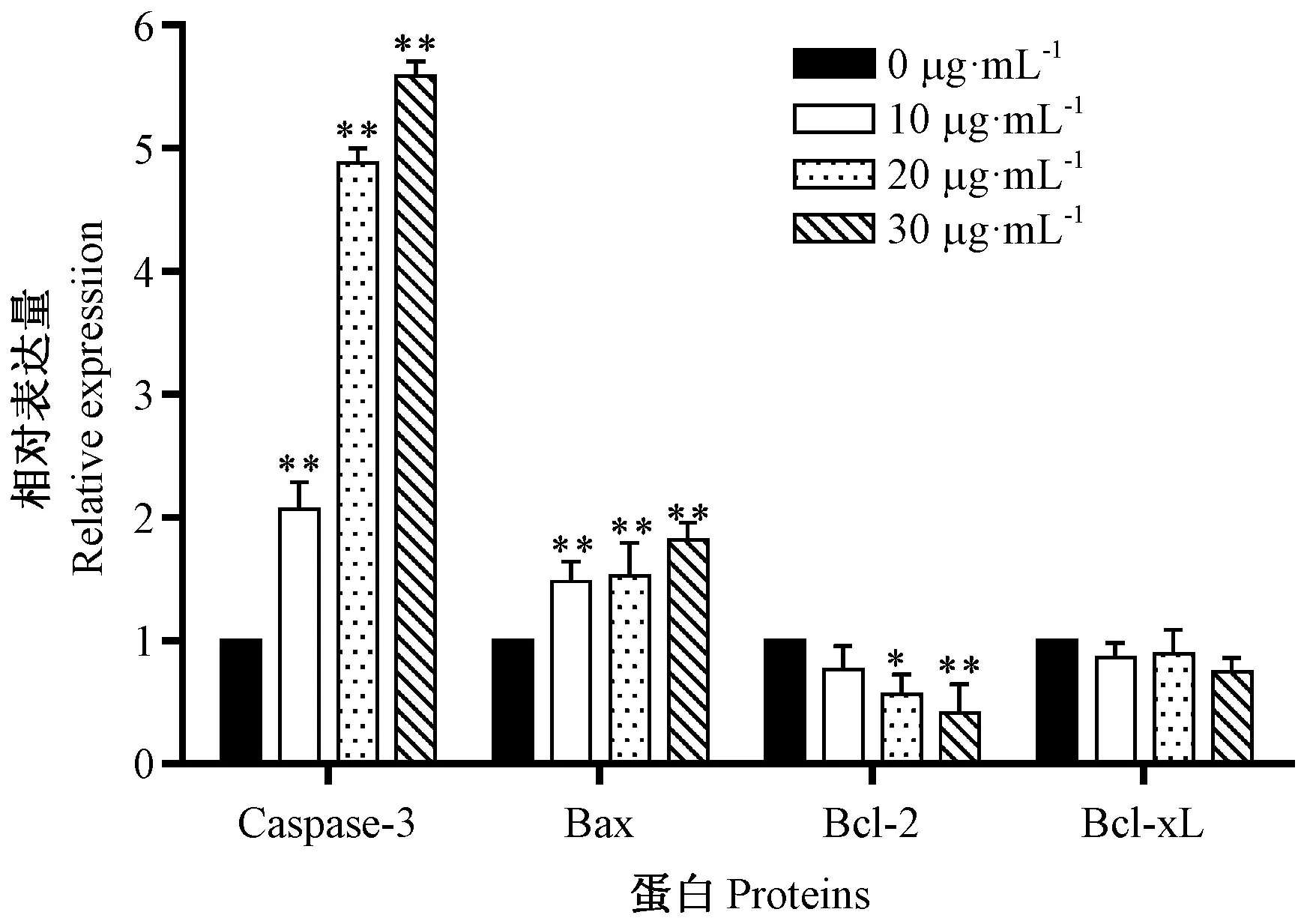
图9 Caspase-3,Bax,Bcl-2和Bcl-xL蛋白的表达统计分析Fig.9 Statistical analysis of Caspase-3,Bax,Bcl-2 and Bcl-xL proteins
4 结论
岩藻黄质作用于人红白血病HEL细胞后,降低了细胞活力,增加了细胞凋亡率,将细胞阻滞于G0/G1期,开放线粒体膜渗透性转换通道,降低了线粒体膜电位,通过上调促凋亡基因、蛋白的表达,下调抗凋亡基因、蛋白的表达促进了细胞的凋亡。本研究结果证实天然生物活性物质岩藻黄质对HEL细胞的体外生长具有抑制作用,为将岩藻黄质开发为保健食品及特殊医学用途配方食品提供了理论依据。
