茶树CsSNAT基因的克隆与表达分析
2020-04-10颜小梅韦朝领
师 聪 颜小梅 韦朝领
(1徐州工程学院,食品(生物)工程学院,江苏 徐州 221018;2安徽农业大学茶树生物学与资源利用国家重点实验室,安徽 合肥 230036)
褪黑素(melatonin,MT)是大脑里“松果体腺”分泌的一种荷尔蒙,是生命必需的吲哚胺类物质[1-2]。褪黑素存在于各种植物中,具有很强的抗氧化性,可以大量清除活性氧和活性氮,同时它还起着信号分子的作用[3-5],诱导或抑制与信号传导[6]、细胞生长[7]、衰老[8]和叶绿素降解[9]相关的基因表达,进而影响植物生理功能。此外,褪黑素可通过提高防御相关酶的活性来提高植物的抗病性[10]。由于褪黑素的生理功能,植物已经形成了与褪黑素合成相关的复杂系统来响应各种环境刺激,如温度[11-12]、水胁迫[11-13]、光照强度[2,14]以及内源性信号分子乙烯和脱落酸[15]。
在高等植物中,色氨酸经过4种酶碳化形成褪黑素。随着研究的深入,催化合成褪黑素途径相关编码酶的基因相继被克隆[15-17]。其中,5-羟色胺-N-乙酰转移酶(N-acetylserotonin methyltransferase,SNAT)是褪黑素的合成途径的关键限速酶,其可以催化5-羟色胺生成N-乙酰基-5-羟色胺(N-acetylserotonin);N-乙酰基-5-羟色胺是褪黑素合成的前体物质,当其转化成褪黑素急剧减少时,SNAT 催化反应是最关键的调控步骤[18-19]。
在植物生长过程中,高温、低温、干旱和盐渍等会限制植物生长发育和影响产量品质[20-22]。茶树(Camellia sinensis)作为我国重要的经济作物,其在生长发育的过程中往往会遭受虫害等生物胁迫,以及低温、干旱等非生物胁迫,严重影响茶叶产量和品质。SNAT基因在植物抗逆等生理活动中具有重要的作用,其抗逆的分子机制将为茶树抗逆分子育种提供理论依据。本研究以茶树为材料,克隆了CsSNAT全长序列,并进行序列特征、组织表达特异性分析及蛋白诱导表达,以期为深入解析该基因功能奠定一定的理论基础。
1 材料与方法
1.1 材料及前处理
以安徽舒城德昌2年生扦插苗盆栽为材料,品种为国家无性系良种舒茶早。茶尺蠖幼虫采自安徽潜山茶场。选取长势相对一致、健康、无病虫害的舒茶早茶苗,分 别用100 μmol·L-1褪黑素(melatonin)、1 mmol·L-1水杨酸(salicylic acid,SA)、100 μmol·L-1脱落酸(abscisic acid,ABA)、1 mmol·L-1茉莉酸甲酯(含0.05% Tween-20,methyl jasmonate,MeJA)对叶片进行相同程度的均匀喷施,以清水处理的叶片为对照。取2~3 龄茶尺蠖幼虫放于茶苗叶片上,每株放10 头,待约1/3 叶片被取食后,将幼虫移走,以未取食的叶片为对照。每个处理做3个生物学重复。处理3、6、9、12、24 h 后采集相同叶位的幼嫩叶片,并立即置于液氮中,放入-80℃超低温冰箱内储存备用。
1.2 茶树总RNA 提取及cDNA合成
按照RNAprep pure Plant Kit 提取试剂盒说明书[天根生化科技(北京)有限公司],以叶片为材料提取总RNA,用ND-2000 核酸蛋白测定仪(美国Thermo Fisher 公司)检测总RNA 样品的浓度,DYC-31DN 电泳仪(北京六一生物科技有限公司)检测总RNA的完整性。按照PrimeScriptTMReverse Transcriptase Kit 试剂盒(大连TaKaRa 公司)说明书以总RNA为模板反转录成cDNA。
1.3 茶树CsSNAT基因的全长克隆
利用Primer Premier 5 软件分别设计3′-RACE和5′-RACE 引物(表1),以反转录的cDNA为模板,参照SMARTTMRACE (美国Clontech 公司)试剂盒说明书进行操作。PCR 产物用1.5%琼脂糖凝胶电泳检测,胶回收目的条带并克隆,交由通用生物系统(安徽)有限公司测序。测序结果利用Editseq 软件进行拼接,根据拼接序列设计全长验证引物(表1)。PCR 反应程序:94℃预变性3 min,94℃变性30 s,58℃退火30 s,72℃反应60 s,72℃延伸10 min,30个循环。胶回收目的条带、克隆、测序。
1.4 茶树CsSNAT基因生物信息学分析
蛋白的分子量和等电点利用ProtParam tool 网站计算。利用TMHMM2.0 预测蛋白的跨膜结构,SignalP4.1 预测蛋白的信号肽,Scratch protein Predictor 预测蛋白质的二硫键及二级结构。使用SWISS-MODEL 同源建模CsSNAT 蛋白的三级结构,用NCBI 网站中的BLASTP 在线分析软件和DNAMAN 软件进行序列比对分析。采用MEGA6.0 软件构建系统蛋白进化树。
1.5 原核表达载体的构建
根据CsSNAT完整开放阅读框和pMal-c2X 载体,利用Primer Premier 5 设计带有BamHI和SalⅠ酶切位点的上下游引物(表1),参照TransStart FastPfuDNA Polymerase 试剂盒说明书扩增完整开放阅读框(open reading frame,ORF),扩增产物纯化回收。用BamHI和SalⅠ分别酶切纯化产物和pMal-c2X 载体,将双酶切后的产物纯化回收后,用T4 DNA 连接酶16℃连接过夜,连接产物转化至BL21(DE3)感受态细胞。通过菌落PCR 鉴定阳性菌落,用质粒小提试剂盒提取质粒,用BamHI和SalⅠ双酶切验证,然后挑取阳性菌落进行测序验证。
1.6 原核表达和诱导条件优化
参考文献[23]的方法。挑取测序验证正确的单克隆菌落接种于LB 培养基,37℃培养过夜,然后扩大培养至OD600为0.6 左右。取1 mL 菌液至1.5 mL 离心管中,10 000 r·min-1离心收集菌株。向剩余的菌液中加入50 μL 1 mol·L-1异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogala-ctoside,IPTG),25℃诱导表达3 h,然后取出1 mL 菌液备用,并将最后剩余的诱导菌液于10 000 r·min-1条件下离心15 min,弃上清液。向沉淀中加入4 mL 1×PBS,用移液器充分吹打混匀,在超声功率200 W条件下破碎处理15 min。用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)检测蛋白表达情况,对照组为空载体pMal-c2X。
诱导温度的优化:培养重组子,按照上述操作,诱导条件为0.5 mmol·L-1IPTG,分别在16、28、37℃下诱导6 h 后取样,用蛋白胶检测蛋白的表达情况。
IPTG 浓度的优化:培养重组子,按照上述操作,诱导条件分别为0.25、0.50、1.00、2.00 mmol·L-1IPTG,在28℃下诱导6 h 后取样,用蛋白胶检测蛋白的表达情况。
诱导时间的优化:培养重组子,按照上述操作,诱导条件为0.5 mmol·L-1IPTG,28℃条件下分别诱导4、6、8 h 后取样,并用蛋白胶检测蛋白的表达情况。
1.7 原核表达蛋白的纯化
选用麦芽糖结合蛋白(maltose-binding protein,MBP)标签融合蛋白进行目的蛋白纯化,填料用直链淀粉树脂(Amylose Resin)。吸取2 mL 填料放入柱子中,菌液经破碎离心后,过滤上清液,然后把上清液加入填有填料的柱中,利用液体的重力使上清液缓慢流过树脂,带有MBP 标签的融合蛋白会结合在树脂上,用柱缓冲液(Column Buffer)洗脱未结合蛋白,用麦芽糖Column Buffer 把目的蛋白洗出,经过超滤浓缩后,用蛋白胶检测蛋白纯化的效果。
1.8 CsSNAT基因的表达分析
实时荧光定量PCR 分析不同处理后CsSNAT的表达特征。提取不同时间点处理样品的总RNA,参照大连TaKaRa 公司SYBR® PrimeScriptTMRT-PCRKit 说明书,反转录成RT-qPCR 模板。用Primer Premier 5 软件设计基因RT-qPCR的引物(表1)。经引物特异性和扩增效率验证后,以茶树GAPDH为内参基因,参照SYBR® Premix Ex TaqTMⅡ试剂盒(大连TaKaRa 公司)说明书操作,基因相对表达水平采用2-ΔΔCt法[24]计算。

表1 引物序列Table1 Primer sequences
2 结果与分析
2.1 CsSNAT基因的全长克隆
根据筛选的CsSNAT的EST 序列,以茶树叶片cDNA为模板,采用RACE 技术进行非嵌套和嵌套扩增,最终获得3′末端序列长度为542 bp(图1-A),5′末端序列长度为650 bp(图1-B)。对分别获得的CsSNAT3′端和5′端进行全长拼接,用设计的全长引物进行cDNA 全长的特异性扩增,通过克隆测序获得CsSNAT全长为1 014 bp(图1-C)。
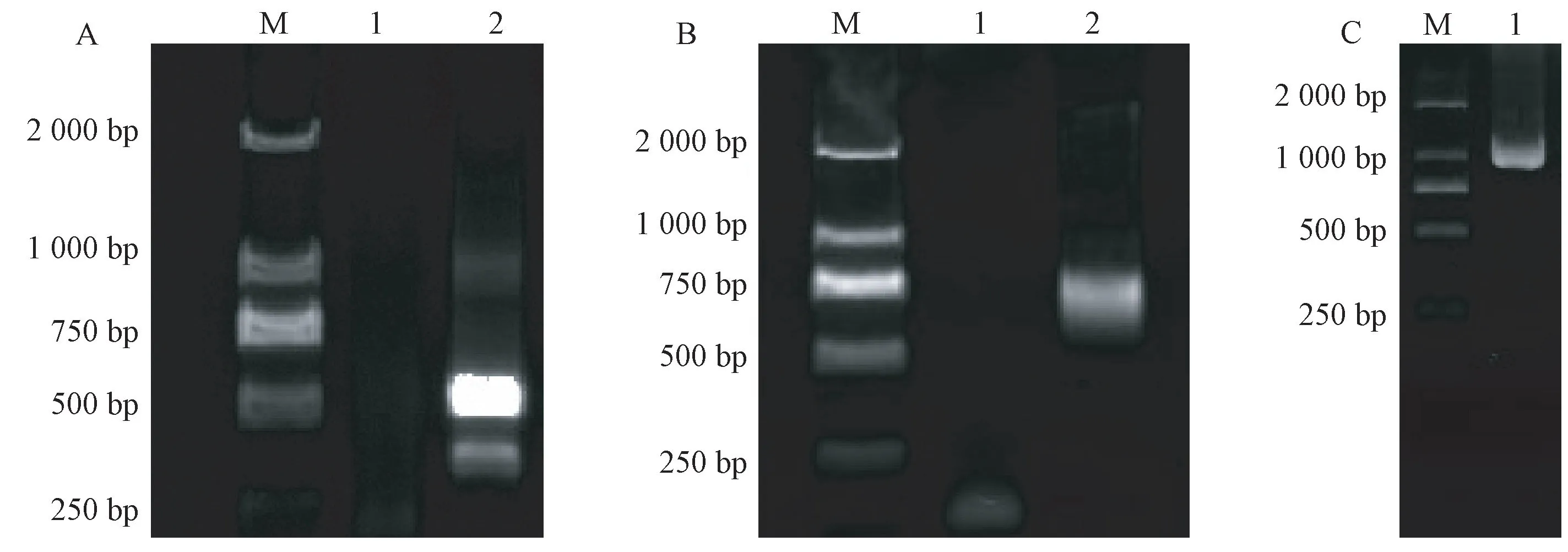
图1 CsSNAT 全长克隆的扩增产物琼脂糖电泳Fig.1 Agarose gel electrophoresis of the CsSNAT full-length products
2.2 CsSNAT基因的生物信息学与系统进化树分析
根据测序正确的CsSNAT基因全长序列进行生物信息学分析,CsSNAT基因全长序列包含742 bp ORF,编码247个氨基酸,分子量为27.36 kDa,等电点为7.64。CsSNAT的蛋白序列N 端未发现信号肽结构,且未发现跨膜结构,不属于跨膜蛋白。Scratch protein Predictor 预测显示,CsSNAT 存在3个二硫键,预测蛋白的二级结构表明,CsSNAT 中α-螺旋(H)、β-折叠(E)和无规卷曲(L)的比例为23.89∶22.67∶53.44。CsSNAT 蛋白三级结构预测表明,无规则卷曲是该蛋白结构的主要结构组成部分(图2)。
利用软件MEGA6.0 中的N-J 方法构建系统进化树。由图3可知,SNAT 大致可以分为两大类,其中,CsSNAT与VvSNAT(CBI31163)同源性最高,达到了66.19%,与经过功能验证的AtSNAT(At1g32070)、OsSNAT(Os05g0481000)和PtSNAT(XM_002323058)相似度分别为5 4.3 2%、5 5.0 4%和6 4.0 3%。对CsSNAT 氨基酸序列进行多重序列比对分析(图4),发现这些不同种类的CsSNAT 蛋白都具有乙酰辅酶A的保守结构域。
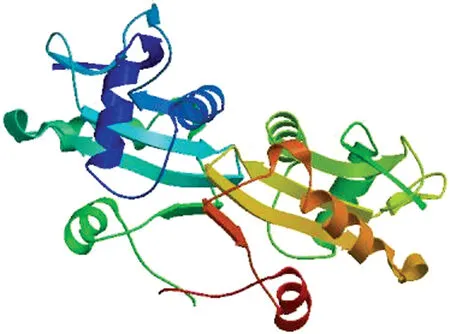
图2 CsSNAT 蛋白三级结构预测Fig.2 Tertiary structure prediction of CsSNAT protein
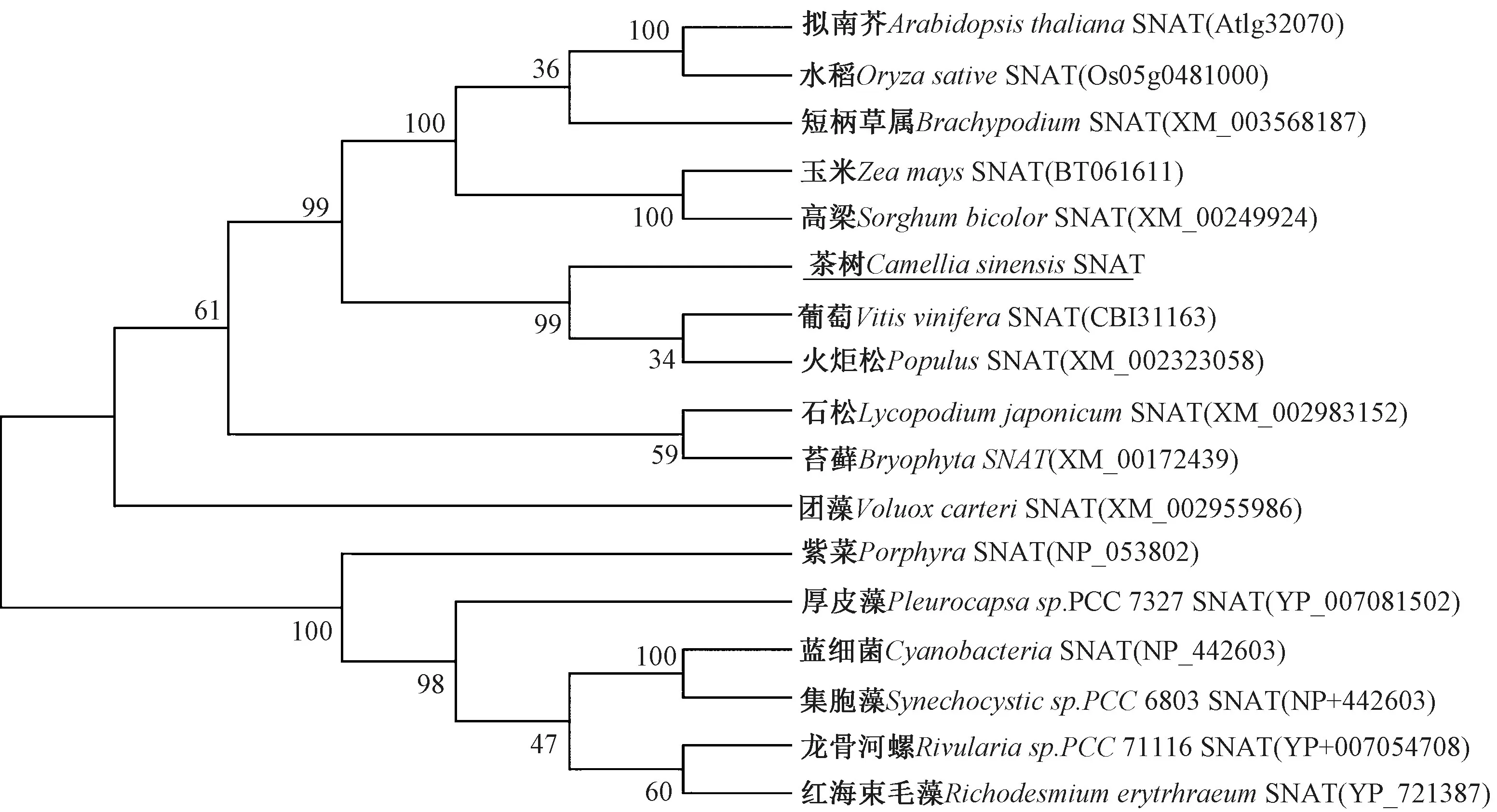
图3 CsSNAT 蛋白与不同种类的SNAT 蛋白的系统发育树Fig.3 Phylogenetic trees of CsSNAT proteins and different kinds of SNAT proteins
2.3 CsSNAT基因原核表达条件优化和蛋白纯化
用带有BamHI和SalⅠ酶切位点的上下游引物对CsSNAT的ORF 进行扩增,得到一条约为740 bp的条带,将胶回收产物和pMal-c2X 分别用BamHI和SalⅠ进行双酶切,用T4 DNA 连接酶16℃连接过夜,构建原核表达pMal-c2X/CsSNAT质粒,然后转化到BL21(DE3)感受态细胞,对单克隆菌落进行PCR,筛选获得阳性菌,提取质粒后用BamHI和SalⅠ双酶切鉴定。由图5可知,重组质粒经酶切后得到了2条带,其中一条在740 bp 左右,经测序验证与CsSNAT完全一致,表明表达质粒构建成功。
将质粒 pMal-c2X/CsSNAT转化至大肠杆菌Rosetta(DE3) pLysS 后,对CsSNAT进行蛋白表达条件优化,试验结果表明,CsSNAT 蛋白以可溶蛋白和包涵体蛋白2种形式同时存在,最佳诱导条件为温度28℃,IPTG 浓度0.5 mmol·L-1,诱导时间6 h(图6)。在此条件下诱导表达时,可溶性蛋白达到最大量(图7-A)。由SDS-PAGE 结果可知,在分子质量约为66 kDa 处有明显的新增蛋白带,而空载体对照在此处无表达条带。此外,因为表达载体中含有重组麦芽糖结合蛋白,所以表达的分子量较预测大。

图4 CsSNAT 与其他植物的SNAT 序列比对分析Fig.4 Alignment of amino acid sequences of CsSNAT and other plant SNAT
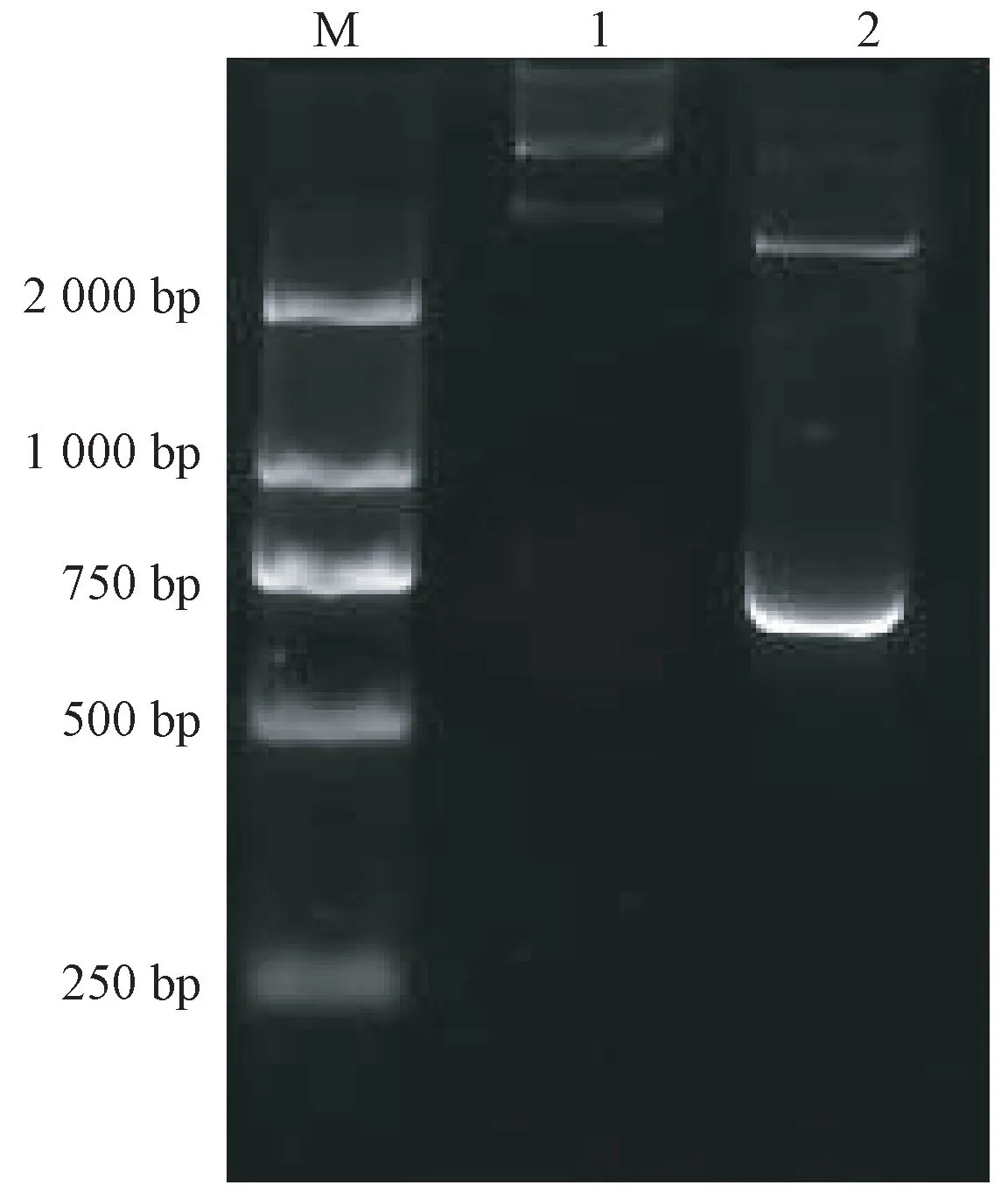
图5 重组质粒双酶切验证的琼脂糖凝胶电泳检测Fig.5 Agarose gel electrophoresis of analysis of recombinant plasmid digested with double enzymes
基于诱导表达的CsSNAT 重组蛋白为带有麦芽糖标签的融合蛋白,利用亲和柱中的直链淀粉树脂可以与上样液中的目的蛋白特异性结合,通过亲和层析纯化和浓缩样品。由图7-B可知,纯化的目的蛋白条带清晰且无杂带。
2.4 不同激素处理后CsSNAT基因的表达特征分析
采用RT-qPCR 对CsSNAT基因在茶尺蠖取食、褪黑素、SA、ABA和MeJA 处理后的表达进行检测。由图8可知,茶树经100 μmol·L-1ABA 处理后,CsSNAT在6、9和12 h 均为上调表达,其中12 h 显著上调,约为CK的1.4倍(图8-A);茶树经1 mmol·L-1MeJA 处理后,CsSNAT基因在处理9 h时显著上调表达,约是CK的2倍,在其他时间点均为下调表达(图8-B);茶树经1 mmol·L-1SA 处理后,CsSNAT在各个时间点均为下调表达(图8-C)。在茶尺蠖取食后,CsSNAT经诱导6和9 h时显著上调,分别约为CK的1.5和1.3倍(图8-D);在100 μmol·L-1褪黑素处理后,CsSNAT在处理3 h 内下调,6、9和12 h时显著上调表达,6 h时表达量最高,约是CK的3倍(图8-E)。不同处理下CsSNAT基因表达量均有不同程度变化,说明CsSNAT基因可能参与生物胁迫和非生物胁迫应答反应。
3 讨论
褪黑素作为植物中有效的内源性自由基清除剂,通过参与多胺等物质的合成,或调节抗氧化系统酶的基因转录水平,扮演着植物中第一道防线的角色[25],来防止生物胁迫和非生物胁迫对植物的伤害。本研究克隆了褪黑素合成途径的关键限速酶基因CsSNAT,该基因全长1 014 bp,编码247个氨基酸,无信号肽和跨膜结构,但具有乙酰辅酶A的保守结构域。
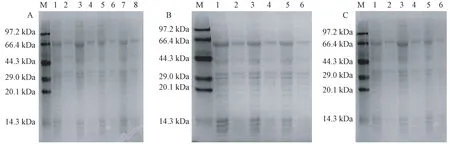
图6 不同IPTG 浓度、温度和时间诱导下CsSNAT的SDS-PAGE 分析Fig.6 SDS-PAGE analysis of the CsSNAT with different induction concentration of IPTG、temperature and treatment time
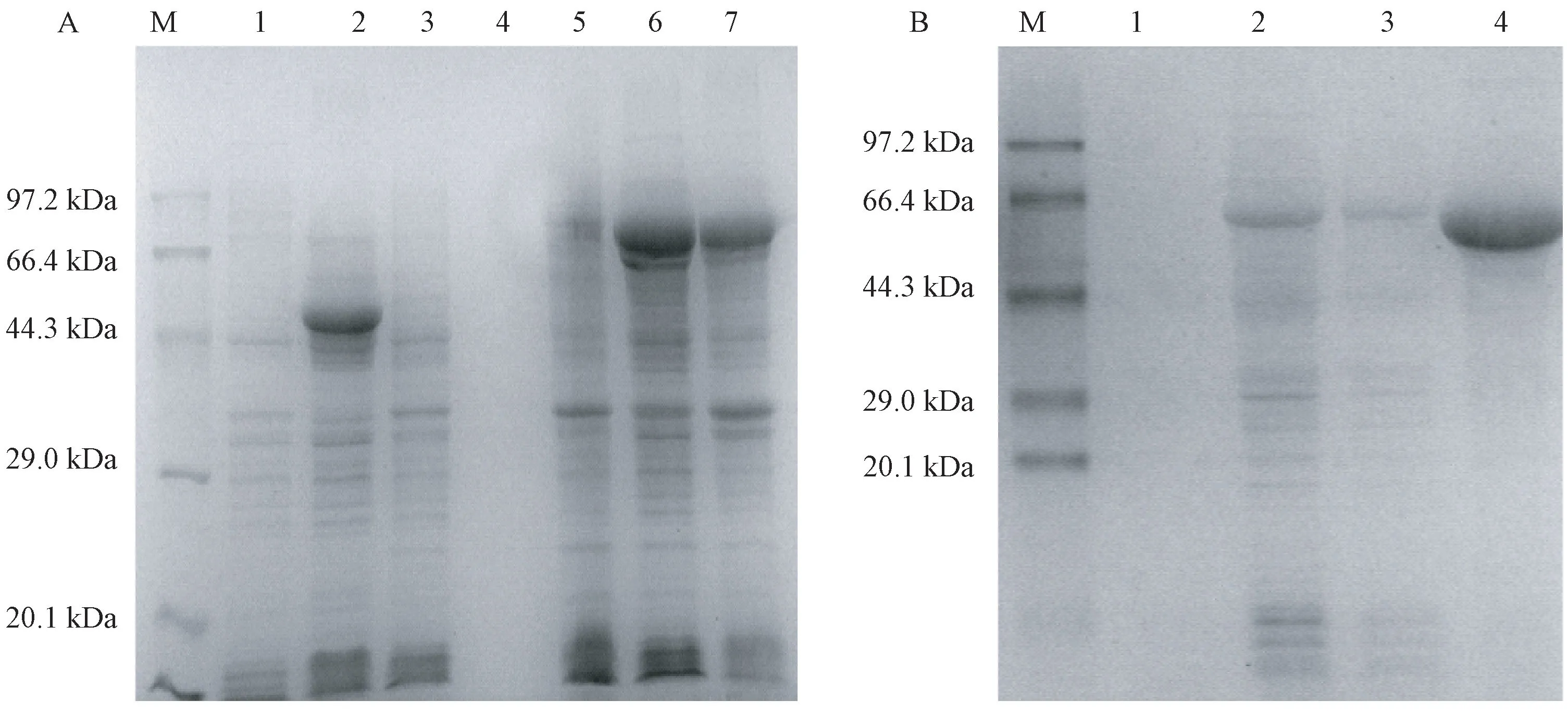
图7 CsSNAT 诱导表达和纯化的SDS-PAGE 分析Fig.7 SDS-PAGE analysis of the CsSNAT expressed and purified
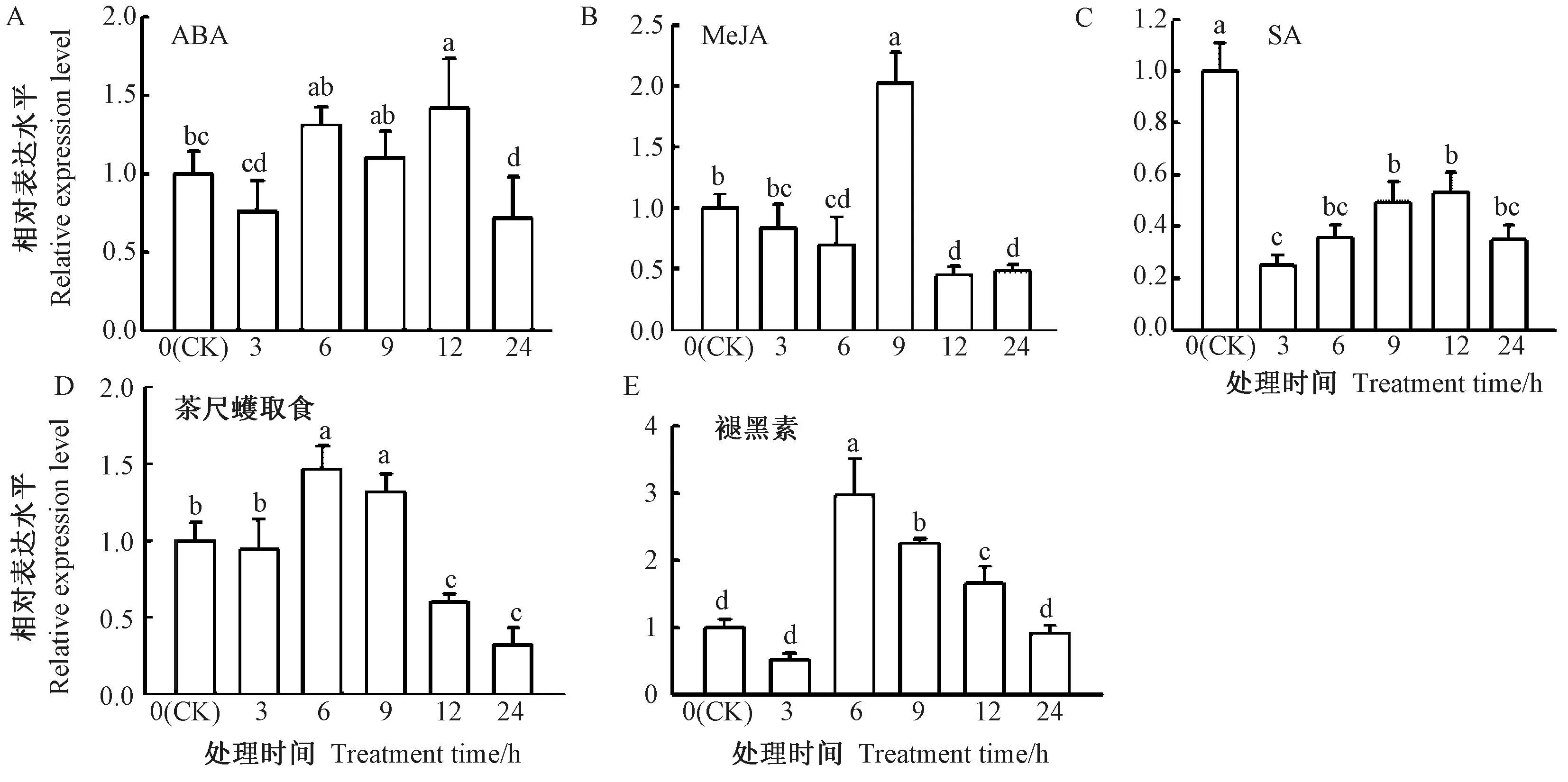
图8 不同激素处理后CsSNAT基因相对表达量的RT-qPCR 分析Fig.8 RT-qPCR analysis of CsSNAT genes relative expression levels in Camillia sinesis treated with different hormones
大肠杆菌表达系统是技术最成熟、开发最早的外源蛋白原核表达系统[26]。质粒载体pMal-c2X是一种高效原核表达载体,其含有麦芽糖结合蛋白(MBP)的大肠杆菌MalE基因。MBP 融合标签在可溶性蛋白表达上具有明显的优势,它能够引导重组蛋白的正确折叠,在一定程度上增加所表达蛋白的可溶性。此外,利用麦芽糖与MBP的特异性结合的特点,可采用亲合层析的方法分离和纯化融合蛋白。本研究构建了pMalc2X/CsSNAT质粒,并转化到大肠杆菌BL21(DE3)表达菌株中,经IPTG 诱导发现,CsSNAT 蛋白以可溶蛋白和包涵体蛋白2种形式同时存在。为了获取大量可溶性蛋白,本研究探索了不同诱导时间、不同IPTG 浓度和不同诱导温度对融合蛋白的表达的影响,结果显示,在28℃、0.5 mmol·L-1IPTG、6 h条件下诱导表达时,CsSNAT的可溶性蛋白达到最大量。因表达的融合蛋白携带MBP的融合标签,本研究利用直链淀粉树脂与目的蛋白特异性结合,通过亲和层析提纯目的蛋白。由SDS-PAGE 结果可知,纯化的目的蛋白条带清晰且无杂带,为CsSNAT 蛋白的功能研究奠定了一定的基础。
本研究检测了CsSNAT基因在茶尺蠖取食、褪黑素、SA、ABA和MeJA 处理后的表达模式,证实该基因与茶树的逆境响应密切相关。外源激素的喷施对植物生长也具有重要的调控作用,SA、ABA和MeJA 刺激能够快速诱导植物响应。本研究结果表明,ABA和MeJA 分别在处理12 h和9 h 后,CsSNAT均显著上调表达。但CsSNAT基因的表达在SA 处理过程中呈下调模式,表明该基因在SA 响应中可能起负调控作用。结合SA、ABA和MeJA 三者都在植物的抗逆过程中发挥重要作用,推测CsSNAT可能与茶树抗逆有关。本研究中,茶尺蠖取食6 h 后,CsSNAT基因发生了显著变化,推测CsSNAT基因可能具有抗虫作用。褪黑素是一种植物内源激素[27],而外源激素与内源激素具有协同与拮抗作用,喷施外源激素后内源激素也发生了相应的变化[28]。Arnao 等[29]发现外源褪黑素经大麦根吸收后,也会诱导内源褪黑素含量增加;Sun 等[30]用500 μmol·L-1褪黑素处理番茄后,番茄内褪黑素含量约是对照的31倍。外源褪黑素处理后CsSNAT能够快速诱导表达,从而加快褪黑素前体物质的合成。CsSNAT基因在植物抗逆、抗虫过程中是否发挥作用,尚需要通过遗传转化等手段进行验证。
4 结论
本研究从茶树中克隆了一条CsSNAT基因的cDNA 全长序列,该基因编码247个氨基酸,分子量为27.36 kDa。多序列比对分析表明,茶树CsSNAT 在结构和同源性方面与其他植物存在着一定的差异,但不同种类的CsSNAT 蛋白都具有乙酰辅酶A的保守结构域;进化树分析表明,茶树CsSNAT 氨基酸序列在进化上与同为木本的葡萄和杨树在同一分支上,说明它们在同源关系上最为接近。通过构建pMal-c2X/CsSNAT质粒,优化蛋白表达条件,发现在温度28℃、诱导剂0.5 mmol·L-1IPTG、诱导时间6 h条件下,可溶性蛋白达到最大量。RT-qPCR 分析表明,CsSNAT基因可能参与生物胁迫和非生物胁迫应答反应。本研究结果为进一步探究CsSNAT基因的生物学功能奠定了基础。
