橡胶种植对林下节肢动物群落结构的影响
2020-04-09马占霞甘建民张玲
马占霞, 甘建民, 张玲,*
橡胶种植对林下节肢动物群落结构的影响
马占霞1,2, 甘建民1, 张玲1,*
1. 中国科学院西双版纳热带植物园, 热带森林生态学重点实验室, 云南勐仑 666303 2. 中国科学院大学, 北京 100049
西双版纳地区大部分热带雨林逐渐被橡胶林所取代, 而关于这种转化对节肢动物群落结构的影响研究鲜见报道。为探讨橡胶林种植对节肢动物的影响, 我们采用马氏网的方法调查了西双版纳纳板河流域国家自然保护区内9个森林片段和橡胶林中的林下节肢动物群落结构、分布格局以及主要的影响因素。结果显示: (1)在两种林型森林和橡胶林中, 共采集得到节肢动物个体16682个, 隶属于18个类群, 其中优势类群为双翅目、膜翅目、鳞翅目和弹尾目; (2)季节对节肢动物群落组成有显著影响, 总体表现为节肢动物多度在旱季显著大于雨季; 森林中的节肢动物多度、类群数显著高于橡胶林; (3)典范对应分析结果显示, 海拔、坡度和坡向是影响森林节肢动物群落的主要因素; 而影响橡胶林节肢动物群落的主要因素是海拔和橡胶树年龄等。总之, 本研究揭示了热带地区大面积单一橡胶林种植可对节肢动物群落结构产生较大的负面影响, 并为自然保护区管理和生物多样性保护提供了数据资料和科学管理依据。
森林; 橡胶林; 节肢动物; 季节
0 前言
热带雨林是生物多样性极为丰富的地区, 能够为动植物和微生物提供良好的栖息生境。如果栖息生境发生重大变化, 可能导致物种多样性减少, 甚至被全新的其他生物类群所取代[1]。位于印度-缅甸生物多样性热点区域的西双版纳, 是我国生物多样性最为丰富的地区之一, 保存有许多珍稀和特有的类群, 是具有全球意义的生物多样性关键地区之一[2]。
2005年至2010年间, 由于对橡胶需求量的不断扩大, 西双版纳橡胶林扩展显著, 种植面积由30.36万hm2增加到47.33万hm2, 2015年, 橡胶种植面积已增至为50.04万hm2[3]。且该地区的橡胶林, 多数以纯林的方式存在, 在群落结构、生物多样性、景观格局等方面与热带雨林差别很大[4]。橡胶林不断扩大的同时, 当地的原生环境和自然保护区受到不同程度的破坏, 如大勐龙自然保护区, 由于保护区内的猎捕和砍伐活动猖獗, 乔木和灌木基本被清除, 大部分草本和藤本植物消失, 导致依赖森林生存的许多动物丧失了庇护场所和食源, 其资源和环境破坏严重, 完全丧失保护价值[5]。
大量研究表明橡胶林的大面积种植不仅改变了西双版纳传统的土地利用生产方式, 也给该区域生物多样性带来严重的威胁[6–10], 在西双版纳橡胶林中, 陆生软体动物总物种数不足雨林环境的51%, 而且种类也被彻底地改变了[1]。类似地, 雨林大面积砍伐后, 广布种成分增加, 特有物种面临减少乃至灭绝, 如西双版纳蝗虫种群数量就在逐渐下降[11]。鸟的种类随森林结构和植物群落的简化而递减, 橡胶纯林内鸟的种类远比原有热带森林少, 甚至有些鸟的种类在部分林地已见不到[12]。
节肢动物是森林生态系统的重要组成之一, 在生态系统结构和功能中扮演着重要角色, 如传粉、调节分解和种子传播、促进植物生长、作为外来生物的天敌和脊椎动物的食物等[13–15]。因传代快、运动能力强, 节肢动物对生境变化反应迅速, 能够快速反映生态系统受到的干扰程度[16–28], 因此节肢动物通常作为生态系统健康评价、生物多样性保护和生态系统管理等研究中十分重要的研究对象和重要的指示生物[19–20]。
随着西双版纳地区土地利用过程中干扰强度的加大及橡胶林的扩张, 甲虫、蚂蚁、土壤动物等都受到影响, 包括对物种多样性、功能群组成和物种丰富度等方面[21–24]。然而以往的研究主要基于节肢动物的某一类群, 对整个林下节肢动物群落的研究鲜见报道。我们以西双版纳纳板河流域片段森林和橡胶林为研究生境, 通过对其林下节肢动物群落的调查, 回答以下科学问题: 片段森林和橡胶林中节肢动物群落组成时空分布格局是否存在差异?影响片段森林和橡胶林中节肢动物群落组成和分布格局的主导因素是什么?
1 材料与方法
1.1 研究地点
研究地点位于云南省西双版纳傣族自治州的景洪市与勐海县接壤处的纳板河流域国家级自然保护区(100°32′E—100°44E′, 22°04′N—22°17′N)及其周边森林和橡胶林, 总面积270.10 km2, 海拔800—2304 m, 全区地势西北高东南低; 气候类型属北热带湿润气侯, 年降水量11001600 mm, 年平均气温18—22 °C; 保护区按小流域生物圈保护区理念建设, 划分核心区、缓冲区、试验区三大功能区[25]。在缓冲区和试验区遍布数个村寨及大面积的橡胶林, 其中零星散布着被橡胶林隔断的残余森林片段。
1.2 取样方法
通过实地调查情况并结合使用IKONOS卫星地图(2007年11月16日和12月2日获得)分析确定不同面积的森林样地(在Google earth pro中对选取样地的森林片段面积进行估算)[26]; 在选取的森林样地周围选择与其对应的橡胶林, 共选取了9个森林和9个橡胶林样地作为研究生境(表1)。节肢动物调查是采用马氏网(3.5 m×2.0 m×1.5 m, 长×宽×高)的方法[27]。在所选的每个样地内分别随机设置4个马氏网, 且两网间距大于100 m, 距离林地边缘大于100 m, 以避免边缘效应对实验结果的影响。之后定期进行样品收集, 包括旱季(2014年3月至5月), 雨季末(2014年9月至11月), 每15天清空一次收集瓶, 共收集10次(旱雨季各5次), 所收集的节肢动物均保存在95%的酒精中用作物种鉴定及个体计数。节肢动物的鉴定和计数在解剖显微镜下进行, 分类鉴定依据《中国珍稀昆虫图鉴》进行, 统一鉴定至目。用手持GPS仪(GARMIN 62S)记录相关样点经纬度、海拔、坡度、坡向等样点信息。
植被调查是在每个马氏网周围设置3个20 m× 20 m的样方。对每个样方内所有胸径(DBH)> 5 cm的乔木树种进行每木调查, 挂牌, 记录编号, 测量其胸径、树高等生长情况[28]。统计样方内DBH>5 cm的乔木树种数量及其个体数和树木总数, 采用香农多样性指数(Shannon's diversity index)计算树种多样性。

表1 纳板河研究样地基本信息表(面积从小到大排列)
通过和胶农交谈, 我们明确同一橡胶林的种植时间是相同的, 然后通过数最接近采样点的四棵橡胶树上的刻痕来估计橡胶树龄, 橡胶树割胶的刻痕是有规律的, 一般是从上而下。然后根据刻痕数量来计算橡胶树的树龄(120个刻痕每年)[29]。
1.3 统计方法
各类群数量优势度的划分是按个体数占总捕获量的10%以上者为优势类群, 1%—10%为常见类群, 1%以下为稀有类群[30]。使用One-Sample Kolmogorov-Smirnov Test检验数据分布的正态性, 对不满足正态分布的数据进行正态转换。采用多因素方差分析方法, 分析地点、林型和季节对节肢动物群落类群数和个体数分布的影响; 采用独立样本T检验比较相同地点的橡胶林和森林之间节肢动物分布的差异, 同时比较不同季节节肢动物分布的差异; 对节肢动物群落组成(多度和物种丰富度)和环境因子的关系做典范对应分析(Canonical Correspondence analysis, CCA)。以上数据分析使用统计软件R3.3.1完成。
2 结果与分析
2.1 森林和橡胶林节肢动物数量及群落组成
森林样地中共采集得到节肢动物个体10003个, 隶属于18个类群, 其中优势类群为双翅目(Diptera)、膜翅目(Hymenoptera)、鳞翅目(Lepidoptera)和弹尾目(Collembola), 共占81.06%; 常见类群为鞘翅目(Coleoptera)、同翅目(Homoptera)、等翅目(Isoptera)、蜘蛛目(Araneae)、直翅目(Orthoptera)、衣鱼目(Zygentoma)和蜚蠊目(Blattaria), 共占17.54%; 稀有类群有7个, 分别为螳螂目(Mantodea)、革翅目(Dermaptera)、半翅目(Hemiptera)、脉翅目(Neuroptera)、毛翅目(Trichoptera)、多足纲(Myriopoda)和食毛目(Mallophaga), 在森林节肢动物中共占比例为1.40%(表2)。其中, 旱季共采集得到节肢动物个体数为5816个, 隶属于16个类群, 优势类群分别为鳞翅目、双翅目、膜翅目、鞘翅目和弹尾目, 共占86.46%; 常见类群为等翅目、直翅目、蜘蛛目、同翅目、衣鱼目、蜚蠊目, 共占12.15%; 稀有类群共有5个, 所占比例为1.36%。雨季共采集到节肢动物个体数为4187个, 隶属于16个类群, 优势类群分别为弹尾目、鳞翅目和双翅目, 共占84.25%; 其中弹尾目占的比例为54.41%, 远高于旱季的数量, 常见类群为膜翅目、鞘翅目、蜘蛛目和同翅目, 共占13.27%; 稀有类群有9个, 所占比例为2.48%(表2)。
橡胶林样地中共采集得到节肢动物个体6679个, 隶属于16个类群, 其中优势类群为弹尾目、双翅目、膜翅目、鳞翅目和鞘翅目, 所占比例为88.13%; 常见类群为蜘蛛目、直翅目和蜚蠊目, 所占比例为7.95%;稀有类群有8个, 分别为同翅目、等翅目、螳螂目、革翅目、半翅目、脉翅目、毛翅目和衣鱼目所占比例为3.92%(表2)。其中, 旱季共采集得到节肢动物个体数为4209个, 隶属于16个类群, 优势类群分别为鳞翅目、双翅目、膜翅目和鞘翅目, 共占78.17%; 常见类群为弹尾目、直翅目、蜘蛛目、蜚蠊目、等翅目和衣鱼目, 共占19.47%; 稀有类群共有6个, 所占比例为2.37%。雨季共得到节肢动物个体数为2470个, 隶属于14个类群, 优势类群分别为鳞翅目、弹尾目、双翅目和膜翅目, 共占87.46%; 常见类群为鞘翅目、蜘蛛目、直翅目和脉翅目, 共占10.08%; 稀有类群共有6个, 所占比例为2.46%(表2)。

表2 森林和橡胶林中不同季节节肢动物群落组成
2.2 地点、林型和季节对节肢动物群落的影响
地点对节肢动物多度、类群数和主要优势类群(弹尾目、双翅目、鞘翅目、膜翅目)的个体数量有显著影响; 季节变化对节肢动物多度、类群数和优势类群均有显著影响, 总体上表现为旱季显著高于雨季, 而其中弹尾目的个体数却是旱季(Mean±SD, 13.63 ± 16.37)显著低于雨季(38.67 ± 41.09)(<0.001)。林型对节肢动物多度、类群数和主要优势类群(弹尾目、鞘翅目、膜翅目)的个体数量有显著影响, 其中森林中节肢动物类群数和多度(9.21 ± 2.18; 139.39 ± 68.73)显著高于橡胶林(8.44 ± 2.16; 93.14 ± 56.31)。此外, 地点、季节和林型3个因素对弹尾目有显著的交互作用(=0.049)(表3)。
通过T检验比较分析, 结果发现森林和橡胶林的节肢动物群落分布格局不同。在旱季森林中节肢动物的多度(=2.740,=0.008)(图1)、类群数(= 2.163,=0.034)、弹尾目多度(=2.323,=0.025)和鳞翅目多度(=2.437,=0.017)与橡胶林的差异显著; 而优势类群中的双翅目多度(=0.603,=0.548)、膜翅目多度(=1.342,=0.185)和鞘翅目多度(=1.640,= 0.106)两种林型间无显著差异(图2)。在雨季森林中节肢动物仅多度(=4.514,<0.001)和弹尾目多度(= 6.3258,<0.001)显著高于橡胶林(图2)。
在森林中, 旱季的节肢动物多度(=2.991,=0.004)、类群数(=6.425,<0.001)和优势类群数与雨季的差异显著, 除弹尾目(=-5.399,<0.001)的多度低于雨季外, 其他类群数量都显著高于雨季。在橡胶林中, 旱季节肢动物多度(=3.993,<0.001)和类群数(= 4.563,<0.001)均大于雨季; 除膜翅目(=1.414,= 0.162)外, 其他优势类群多度均存在明显季节差异(图2)。

表3 地点、季节和林型对节肢动物类群数、多度和及主要优势类群影响的多因素方差分析
注: NS表示不显著。
2.3 环境因子对节肢动物群落的影响
对森林坡度、坡向、片段面积、树种多样性和胶林中海拔、坡度、坡向、橡胶树年龄与节肢动物群落进行典范对应分析。结果显示影响森林中节肢动物群落的因子主要是坡向、坡度和海拔; 在橡胶林中, 影响节肢动物群落的因子主要是海拔和橡胶树年龄(图3和表4)。
3 讨论
在纳板河自然保护区, 因橡胶种植已导致低海拔地区的部分森林被橡胶林所取代, 橡胶林内植物群落结构较为单一, 人为干扰强度加大, 物种多样性减少[31–32]。本研究发现森林片段化和橡胶种植对节肢动物群落组成有显著影响, 橡胶种植总体上减少了节肢动物的数量。这一结果与Attignon等[33]在西非研究白蚁的结果相似, 他们发现柚木种植园中的白蚁群落由单一优势种主导, 白蚁群落物种丰富度随土地利用程度和人为干扰强度增加而急剧减少[34–35]。孟令曾对纳板河流域甲虫的研究也显示橡胶林中甲虫物种丰富度显著低于自然林[22], 在橡胶种植园步行虫物种数量比森林的低[36], 导致这一变化的主要原因可能是活动能力较强的甲虫类昆虫会选择适宜的生境[37], 相对于环境单一、异质性低的橡胶林, 片段森林拥有更丰富的食物资源和更适宜环境[38], 更利于对环境要求高的生物类群生存。
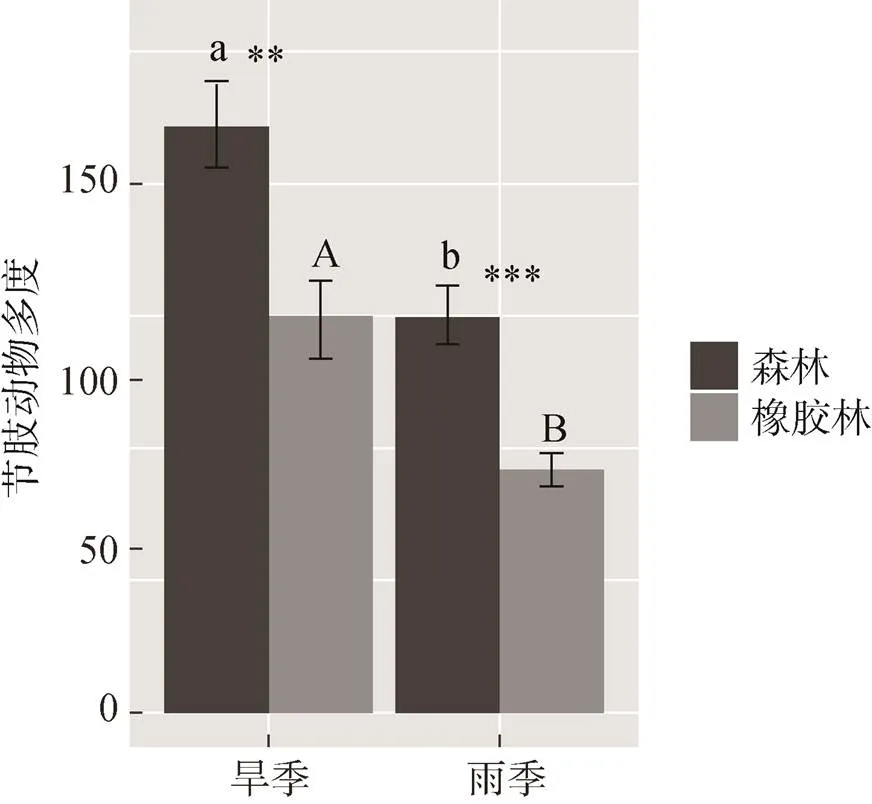
图1 不同季节森林和橡胶林中节肢动物的多度。不同字母表示旱季和雨季之间的差异显著性,*表示森林和橡胶林之间的显著差异性
Figure 1 Abundance of arthropod between natural forests and rubber plantations in different seasons. Different letters indicate significantly differences between Dry and Rain,**and*** indicate significantly differences between forests and rubber plantations at< 0.05 and< 0.001, respectively.
在森林中, 旱季的节肢动物多度和类群数均显著高于雨季, 但是弹尾目的多度却与之相反。王瑾等对纳板河流域片段森林的研究也得到类似结果, 这可能是因为弹尾目类喜欢相对潮湿的环境, 雨季较高的温湿条件形成了利于其生长的条件[39]。
林龄小于20年的橡胶林(低龄林)具有开放式的林冠, 郁闭度较低, 而林龄在2040年(高龄林)的橡胶林具有较密闭的林冠层, 郁闭度相对较高[22]。纳板河流域大多数的橡胶林都是低龄林, 随着橡胶林龄的增长, 栖息地的生存环境质量会下降, 这对某些昆虫物种极为不利, 尤其对专性昆虫和稀有种的影响更大。例如, 对该地区的研究发现, 低龄橡胶林导致食蚜蝇的物种丰富度提高, 然而却会导致野蜂的物种多样性下降; 步甲在低龄林中的个体数量虽与森林中相似, 但在高龄林中的数量下降[22], 这些都说明随着橡胶树龄的不同, 节肢动物的群落组成也会有差别, 本研究中的某些林下节肢动物类群也呈现类似的格局, 如优势类群弹尾目。

图2 不同季节森林和橡胶林中节肢动物的类群数和优势类群个体数。不同字母表示旱季和雨季之间的差异显著性,*和ns表示森林和橡胶林之间的显著差异性
Figure 2 Group number and abundance of dominant species between natural forests and rubber plantations in different seasons. Different letters indicate significantly differences between Dry and Rain seasons, *and ns indicate significantly differences between forests and rubber plantations.
Williams研究认为影响物种丰富度的主要因子是诸如环境异质性等因素[40]。坡度、坡向和海拔等地形因子影响了光照、土壤水分和养分等非生物因子, 也对生物因子如植被的生长、分布和多样性等产生影响[41–43]。Gut认为群落生境的发展是决定节肢动物群落组成及结构的季节变化的主要因素[44], 如有研究表明, 节肢动物的个体数和丰富度都随着海拔的升高有下降的趋势, 一方面是温度的改变在起作用, 另一方面海拔高度对节肢动物栖息生境的影响所致[45]; 西双版纳地区连续大面积的橡胶林种植主要替代了处于低海拔、坡度较低缓及南坡向的天然林, 而在高海拔、坡度大、土壤贫瘠和难以种植的地区发展起来的零星小面积橡胶林, 进一步加剧了较多相互隔离的残余森林片段的形成, 这一非随机过程将会严重影响生物群落的构建和分布格局[46]。本研究所调查的森林均有一定的海拔和坡度、坡向的差异, 可能会存在取样偏差, 对分析节肢动物群落的分布格局带来一定的影响; 另一局限性在于对节肢动物分类只达到目级单元。未来的研究应结合分子技术对节肢动物进行更详细的分类, 从不同景观尺度探讨节肢动物的组成以及alpha多样性和beta多样性分析。

图3 森林和橡胶林中节肢动物群落与环境因子的排序分析 (图中: 弹表示弹尾目; 膜表示膜翅目; 鳞表示鳞翅目; 鞘表示鞘翅目; 蜘表示蜘蛛目; 同表示同翅目; 蜚表示蜚蠊目; 双表示双翅目; 脉表示脉翅目; 革表示革翅目)
Figure 3 Canonical Correspondence analysis (CCA) of arthropod and environment factors in natural forests and rubber plantations

表4 森林和橡胶林中节肢动物群落和环境变量相互关系的显著度
注:*0.01<<0.05,**=0.01,***=0.001。
致谢:感谢西双版纳纳板河流域国家级自然保护区对本次野外实验提供的大力支持,陈志玲、李桥顺在野外取样和室内样品处理上提供的帮助,以及林小兵在论文写作上的帮助!
[1] 陈德牛, 杨龙龙. 西双版纳热带森林地区不同生境陆生软体动物多样性研究[J]. 生物多样性, 1997, 5(1): 5–13.
[2] Myers N, Mittermeier R A, Mittermeier C G, et al. Biodiversity hotspots for conservation priorities[J]. Nature, 2000, 403(6772): 853–8.
[3] 刘陈立, 张军, 李阳阳, 等. 西双版纳橡胶林信息提取和时空格局扩张监测[J]. 福建林业科技, 2017, 44(2): 43–50.
[4] 张佳琦, 薛达元. 西双版纳橡胶林种植的生态环境影响研究[J]. 中国人口·资源与环境, 2013, 159(S2): 304–307.
[5] 王跃华, 徐涛. 西双版纳地区橡胶种植业的分析评价[J]. 云南大学学报: 自然科学版, 1998, 20(S4): 605–608.
[6] Thomas C D, Cameron A, Green R E, et al. Extinction risk from climate change[J]. Nature, 2004, 427(6970): 145–148.
[7] Ewers R M, Didham R K. Confounding factors in the detection of species responses to habitat fragmentation[J]. Biological Reviews of the Cambridge Philosophical Society, 2006, 81(1): 117–142.
[8] Pimm S L. Biodiversity: Climate Change or Habitat Loss - Which Will Kill More Species?[J]. Current Biology Cb, 2008, 18(3): R117–R119.
[9] Sax D F, Gaines S D. Species invasions and extinction: the future of native biodiversity on islands[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(32): 11490–11497.
[10] Mann C C. Addicted to rubber[J]. Science, 2009, 325(5940): 564–566.
[11] 黄春梅, 杨龙龙. 西双版纳热带雨林环境变化对蝗虫区系成分和物种多样性的影响[J]. 生物多样性, 1998, 6( 2): 122–131.
[12] 王直军, Chris Carpenter.云南西双版纳不同林型的鸟类变化分析[J]. 东北林业大学学报, 1998, 26(3): 71–75.
[13] Stork N E, Eggleton P. Invertebrates as determinants and indicators of soil quality[J]. American Journal of Alternative Agriculture, 2009, 7(1-2): 38–47.
[14] Magura T, Tóthmérész B, Molnár T. Forest edge and diversity: carabids along forest-grassland transects[J]. Biodiversity & Conservation, 2001, 10(2): 287–300.
[15] Bieringer G, Zulka K P. Shading out species richness: edge effect of a pine plantation on the Orthoptera (Tettigoniidae and Acrididae) assemblage of an adjacent dry grassland[J]. Biodiversity & Conservation, 2003, 12(7): 1481–1495.
[16] Copley J. Ecology goes underground[J]. Nature, 2000, 406(6795): 452–454.
[17] Buddle C M, Langor D W, Pohl G R, et al. Arthropod responses to harvesting and wildfire: Implications for emulation of natural disturbance in forest management[J]. Biological Conservation, 2006, 128(3): 346–357.
[18] Schaffers A P, Raemakers I P, Sýkora K V, et al. Arthropod assemblages are best predicted by plant species composition[J]. Ecology, 2008, 89(3): 782–794.
[19] Billeter R, Liira J, Bailey D, et al. Indicators for biodiversity in agricultural landscapes: a pan-European study[J]. Journal of Applied Ecology, 2008, 45(1): 141–150.
[20] Romeis J, Hellmich R L, Candolfi M P, et al. Recommendations for the design of laboratory studies on non-target arthropods for risk assessment of genetically engineered plants[J]. Transgenic Research, 2011, 20(1): 1–22.
[21] 杨效东, 张建候. 西双版纳人工群落林土壤动物的旱季群落结构[J]. 动物学研究, 1997, 18(4): 403–409.
[22] Meng L Z, Martin K, Liu J X, et al. Contrasting responses of hoverflies and wild bees to habitat structure and land use change in a tropical landscape (southern Yunnan,SW China)[J]. Insect Science, 2012, 19(6): 666–676.
[23] 王瑾, 李志鹏, 胡鸿雁, 等. 热带森林片段化对土壤节肢动物群落结构影响的初步研究[J]. 云南大学学报: 自然科学版, 2015, 37(S1): 104–114.
[24] Liu C, Guénard B, Blanchard B, et al. Reorganization of taxonomic, functional, and phylogenetic ant biodiversity after conversion to rubber plantation[J]. Ecological Monographs, 2016, 86(2): 215–227.
[25] 云南省环境保护局.西双版纳纳板河流域国家级自然保护区[M]. 昆明: 云南科技出版社, 2006.
[26] Berkhoff K. Using remote sensing data as basic information for applied land use change modelling[C]//Proceedings of the ERSEC international conference 2008, sustainable land use and water management. Beijing, China, 2008: 36–45.
[27] Townes H. Design for a malaise trap[J]. Proc Entomol Soc Washington, 1962.
[28] Botzat A, Fischer L, Farwig N. Forest fragment quality rather than matrix habitat shapes herbivory on tree recruits in South Africa[J]. Journal of Tropical Ecology, 2013, 29(2): 111–122.
[29] Yi Z F, Cannon C H, Chen J, et al. Developing indicators of economic value and biodiversity loss for rubber plantations in Xishuangbanna, southwest China: A case study from Menglun township[J]. Ecological Indicators, 2014, 36(1): 788–797
[30] 殷秀琴, 王海霞, 周道玮. 松嫩草原区不同农业生态系统土壤动物群落特征[J]. 生态学报, 2003, 23(6): 1071–1078.
[31] Min C, Zhang J. Tree species diversity of tropical forest vegetation in Xishuangbanna,SW China[J]. Biodiversity & Conservation, 1997, 6(7): 995–1006.
[32] Zhu H, Xu Z F, Wang H, et al. Tropical rain forest fragmentation and its ecological and species diversity changes in southern Yunnan[J]. Biodiversity & Conservation, 2004, 13(7): 1355–1372.
[33] Attignon S E, Lachat T, Sinsin B, et al. Termite assemblages in a West-African semi-deciduous forest and teak plantations[J].Agriculture Ecosystems & Environment, 2005, 110(3): 318–326.
[34] Ackerman I L, Fernandes E C M. Termite (Insecta: Isoptera) species composition in a primary rain forest and agroforests in central Amazonia[M]. Biotropica. 2009: 226–233.
[35] Dosso K, Yéo K, Konaté S, et al. Importance of protected areas for biodiversity conservation in central Côte D'ivoire: Comparison of termite assemblages between two neighboring areas under differing levels of disturbance[J]. Journal of Insect Science, 2012, 12(131): 1–18.
[36] Major R E, Christie F J, Gowing G, et al. The effect of habitat configuration on arboreal insects in fragmented woodlands of south-eastern Australia[J]. Biological Conservation, 2003, 113(1): 35–48.
[37]Davis A J, Huijbregts H K J, Sl K S A S, et al. Dung beetles as indicators of change in the forests of northern Borneo[J]. Journal of Applied Ecology, 2001, 38(3): 593–616.
[38] Houston W A, Wormington K R, Black R L. Termite (Isoptera) diversity of riparian forests,adjacent woodlands and cleared pastures in tropical eastern Australia[J]. Austral Entomology, 2015, 54(2): 221–230.
[39] 张孝羲. 昆虫生态及预测预报[M]. 北京: 农业出版社, 1985: 45–83.
[40] Williams W M. Diversity, complexity, stability and pest control[J]. Applied Ecology, 1975, 12: 795–807.
[41] Williamf L. Theory meets reality: How habitat fragmentation research has transcended island biogeographic theory[J]. Biological Conservation, 2008, 141(7): 1731–1 744.
[42] Bhattarai K R, Vetaas O R. Variation in plant species richness of different life forms along a subtropical elevation gradient in the Himalayas,east Nepal[J]. Global Ecology & Biogeography, 2003, 12(4): 327–340.
[43] Comita L S, Engelbrecht B M J. Seasonal and spatial variation in water availability drive habitat associations in a tropical forest[J]. Ecology, 2009, 90(10): 2755–2765.
[44] Gut L J. Arthropod community organic organization and development in pear[D]. Oregon State University, 1984.
[45] 高宝嘉. 雾灵山森林植物与节肢动物群落结构及多样性研究[D]. 北京: 北京林业大学, 2005.
[46] García-López A, Micó E, Galante E. From lowlands to highlands: searching for elevational patterns of species richness and distribution of scarab beetles in Costa Rica[J]. Diversity & Distributions, 2012, 18(6).
A preliminary study on the effects of rubber plantation on understory arthropod community
Ma Zhanxia1,2, Gan Jianmin1, Zhang Ling1,*
1. Key Laboratory of Tropical Forest Ecology, Xishuangbanna Tropical Botanical Garden, Chinese Academy of Sciences, Mengla 666303,China 2. University of Chinese Academy of Sciences, Beijing 100049, China
A large proportion of tropical rainforests in Xishuangbanna has been converted into rubber plantations, but the information about the impact of forest conversion on arthropod diversity is very scant. In this study we compared the distribution patterns of arthropods in natural forests and rubber plantations, and analyzed the key factors that influenced arthropods community structure. The main results are as follows. (1) A total of 16682 arthropod individuals were collected from natural forests and rubber plantations, belonging to 18 communities, with dominant groups Diptera, Hymenoptera, Lepidoptera and Collembola. (2) Seasonality and forest types had significant effect on arthropod. To specific, we found that the total amount of taxonomic groups of arthropod were significant larger in dry season than in rainy season. Accordingly, in contrast to rubber plantations, the abundance of arthropod in natural forests was much higher. (3) Altitude, slope and aspect affected arthropod community mostly in natural forests, while in rubber plantation, altitude and rubber tree age were the main factors. Our findings suggest monoculture of rubber plantations have a huge negative impact on arthropods community structure. In addition, this study provides some basic information for nature reserve management and the biodiversity conservation in tropical regions.
forest; rubber plantation; arthropod community; season
10.14108/j.cnki.1008-8873.2020.02.009
Q14
A
1008-8873(2020)02-067-08
2018-12-02;
2019-09-24
云南省应用基础研究项目(2016FA017); 中国科学院“一三五”专项(XTBG-T03);中国科学院科技服务网络计划(STS计划)项目(KFJ-EW-STS-084).
马占霞( 1984—), 女, 河南人, 硕士研究生, 主要从事森林生态学方面的研究, E-mail: mazhanxia@xtbg.ac.cn
张玲( 1970—), 女, 云南人, 博士, 研究员, 主要从事进化生态学和动植物关系研究, E-mail: zhangl@xtbg.org.cn
马占霞, 甘建民, 张玲. 橡胶种植对林下节肢动物群落结构的影响[J]. 生态科学, 2020, 39(2): 67-74.
Ma Zhanxia, Gan Jianmin, Zhang Ling. A preliminary study on the effects of rubber plantation on understory arthropod community[J]. Ecological Science, 2020, 39(2): 67-74.
