胰腺内异位副脾CT及MRI表现
2020-04-09韩铮舒锦尔吕光宏胡亮陈晓荣
韩铮,舒锦尔,吕光宏,胡亮,陈晓荣
金华市中心医院医学影像科,浙江金华 321000; *通讯作者 舒锦尔 shujiner@163.com
胰腺内异位副脾(intrapancreatic accessory spleen,IPAS)指脾脏正常组织在胰腺内的异常发育,是一种解剖位置发育异常,发病率为10%~15%[1]。IPAS一般位于胰腺尾部,临床上一般仅需随诊,无需手术治疗。IPAS既往报道较少,国内大部分为CT报道。MRI以其多参数、多序列成像以及较高的组织分辨率等优势,对诊断IPAS具有较高的价值[2-5]。本研究回顾性分析IPAS患者的临床及影像学资料,以提高对IPAS的认知。
1 资料与方法
1.1 研究对象 回顾性分析金华市中心医院经病理及随诊证实的9例IPAS患者的临床及影像学资料,其中男5例,女4例;年龄23~63岁,平均(46.9±10.9)岁。临床表现:1例腹膜后肿块,1例胆囊结石,3例肝硬化门静脉高压脾切除术后常规随诊,4例超声检查发现胰尾占位。所有患者肿瘤标志物甲胎蛋白(alpha fetoprotein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)均未见异常。本组9例患者中,2例误诊为神经内分泌肿瘤手术,术后病理提示IPAS;3例因肝硬化脾切除术后随诊发现胰尾新发结节,影像及临床考虑为IPAS,分别经过18个月、16个月、20个月随诊未见变化;1例年轻患者腹膜后、胰尾均出现肿块,影像及临床考虑为IPAS,随诊12个月未见变化;另3例胰腺尾部结节考虑IPAS,随诊3~5个月后超声引导下穿刺活检证实为IPAS。
1.2 影像学检查 所有患者行上腹部增强CT及MRI扫描前均空腹4~6 h。
1.2.1 CT检查 采用Philips Brillancei CT 256层螺旋CT,管电流200 mAs,管电压120 kV,SFOV 50 cm,螺距1,层厚5 mm,层间距5 mm,行平扫及2期或3期增强扫描,使用高压注射器注射非离子型对比剂,经肘静脉团注给药,流速3.0 ml/s,注药后分别于20~25 s、50~55 s后进行动脉期、门静脉期扫描,部分患者于300 s进行延迟扫描。
1.2.2 MRI检查 采用Siemens MagnetomAvanto 1.5T MR扫描仪,行常规抑脂T1WI、抑脂T2WI、同反相位、扩散加权成像(DWI,b=0、800 s/mm2),高压注射流速2.0 ml/s,Gd-DTPA剂量为0.1 mmol/kg,注射Gd-DTPA后18~23 s行第1次动脉期扫描,间隔5~6 s后行门静脉期轴位及冠状位扫描,延迟扫描根据前2次增强扫描表现而定。
1.3 图像分析 由1名具有5年工作经验的初级职称影像医师完成CT及MRI图像评价,选择轴位最大层面进行测量。测量最长径,并对CT、MRI图像密度、信号及强化特征进行评估,1周后重新进行评价及测量。2次评价结果不一致者由1名具有20年工作经验的高级职称影像医师最终确定。
2 结果
2.1 一般情况 9例IPAS均位于胰尾部;其中6例呈类圆形,3例呈椭圆形;直径0.7~3.9 cm,平均(2.0±1.1)cm。
2.2 CT表现 9例IPAS患者中,1例仅行CT平扫,8例行CT增强扫描,其中行2期和3期增强扫描各4例。与正常胰腺相比,7例IPAS平扫呈等密度,2例呈稍高密度。8例IPAS增强扫描各期强化均匀,动脉期1例(肝硬化门静脉高压脾脏切除)强化程度低于正常胰腺,4例(包括2例肝硬化门静脉高压脾脏切除)强化程度与胰腺相似,3例强化程度高于正常胰腺。门静脉期8例IPAS强化程度均高于正常胰腺;延迟期1例强化程度与胰腺相似,3例强化程度稍高于正常胰腺。9例IPAS患者中,3例肝硬化脾脏切除术后,其余6例与正常脾脏相比,平扫均呈等密度。5例IPAS患者行增强扫描,各期均与脾脏强化程度相似,动脉期未见与脾脏相似“花斑样”强化。所有病例均未见坏死及钙化。见图1。
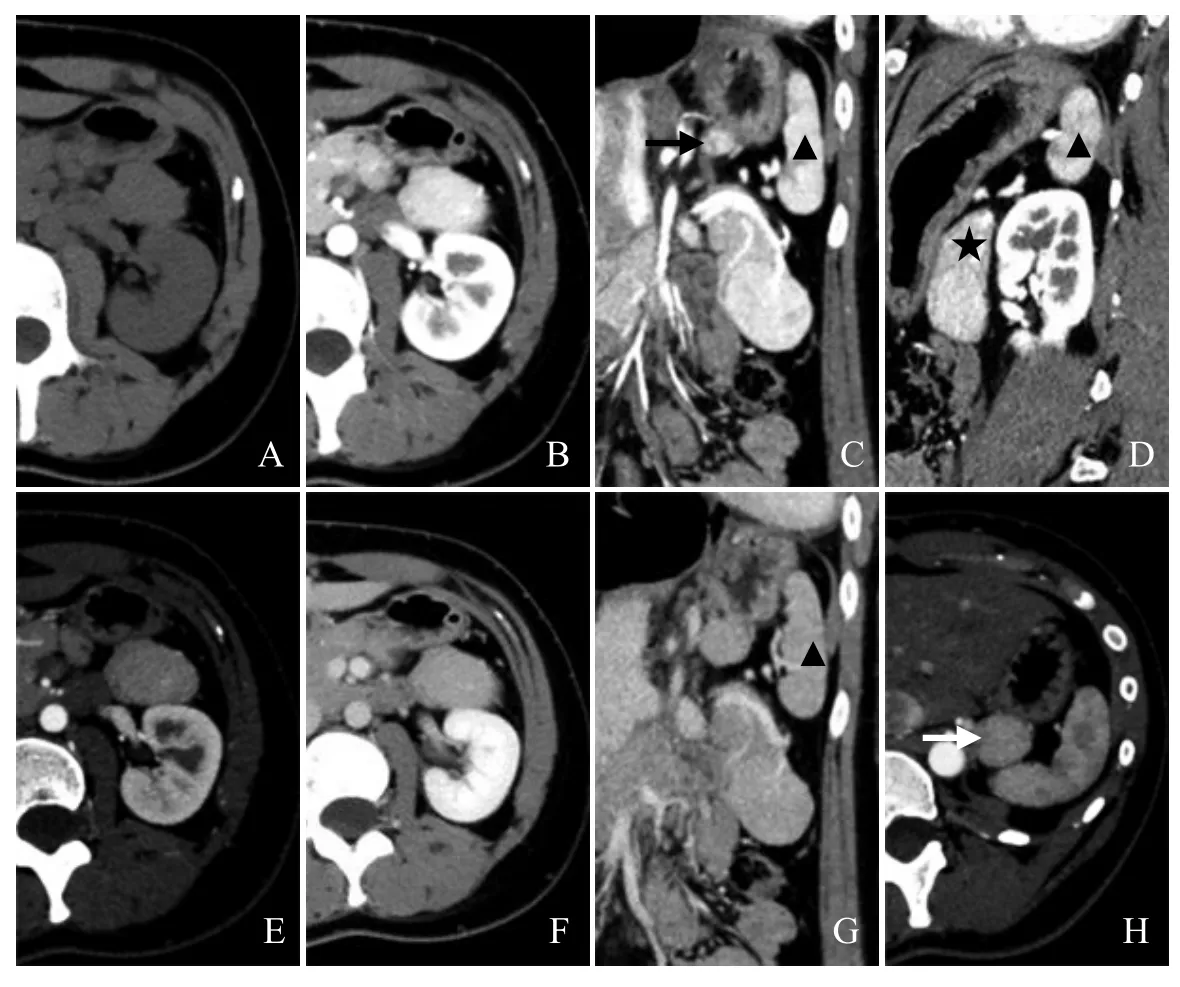
图1 女,23岁,胰腺尾部结节影像考虑IPAS,随诊12个月未见变化,最终诊断为IPAS。CT平扫示胰腺尾部稍高密度结节(A);动脉期呈明显强化(B);动脉期冠状位示结节明显强化,强化程度与脾脏相似,并可见脾动脉供血,同时上方腹膜后可见副脾(箭,C);动脉期矢状位示胰腺尾部(星号)呈鸟嘴样扩大(D);门静脉期结节强化均匀(E);延迟期结节强化均匀(F);延迟期冠状位结节强化与脾脏相似(G);胃后方腹膜后另见副脾(箭,H)
2.3 MRI表现 7例IPAS(其中2例肝硬化门静脉高压行脾脏切除术)患者行上腹部MRI增强扫描。与正常胰腺相比,7例抑脂T1WI均呈低信号;2例抑脂T2WI呈等信号,5例呈高信号;7例DWI信号均高于正常胰腺,其中4例呈稍高信号,3例呈高信号;2例表观扩散系数(ADC)图呈等信号,5例呈低信号;增强扫描动脉期2例IPAS(均为肝硬化门静脉高压脾脏切除术后)强化低于正常胰腺,1例强化与胰腺一致,4例强化程度高于正常胰腺;门静脉期1例IPAS(肝硬化门静脉高压脾脏切除)强化低于正常胰腺,4例强化与胰腺一致,2例强化稍高于正常胰腺;延迟期1例IPAS(肝硬化门静脉高压脾脏切除)强化低于正常胰腺,4例强化与胰腺一致,2例强化稍高于正常胰腺。与正常脾脏相比,除2例肝硬化门静脉高压脾脏切除患者外,其余5例抑脂T1WI、抑脂T2WI、DWI、ADC图及强化方式与脾脏各序列信号及强化方式基本相似,增强扫描动脉期未见与脾脏相似“花斑样”强化。见图2。
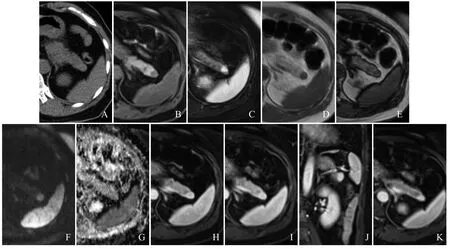
图2 女,50岁,术后送检组织可见被包裹的脾脏组织,诊断为IPAS。CT平扫示胰尾部等密度结节(A);抑脂T1WI呈低信号(B);抑脂T2WI呈高信号(C);同反相位未见信号减低(D、E);DWI呈稍高信号(F);ADC图呈低信号(G);增强扫描动脉期可见明显均匀强化,强于胰腺(H);门静脉期持续均匀强化(I);增强扫描冠状位(J);延迟期持续均匀强化,各个序列结节信号及强化程度均与脾脏相似(K)
3 讨论
3.1 病理及临床表现 副脾是脾脏以外与正常脾脏结构、功能相同的组织,一般认为是胚胎第5周胃背系膜中的脾芽融合失败形成。根据尸检报道,副脾的发生率为10%~30%,最常见于脾门;其次为胰腺尾部,约占16.8%;胰腺其他部位罕见[1]。IPAS同脾实质结构类似,主要由红髓和白髓相间构成。红髓主要由脾血窦构成;白髓主要由位于中间的T淋巴细胞、B淋巴细胞及网状上皮细胞构成[5-6]。IPAS红髓及白髓的比例是影像学表现的基础。镜下IPAS一般表现为正常的胰腺组织内分界清楚的纤维环,纤维环可薄、不完整甚至缺失,纤维环内或外周可分布少量淋巴组织[1,5-7]。
既往报道IPAS患者性别差异无统计学意义,年龄范围相差较大[5-9];本组IPAS患者中,男5例、女4例,年龄23~63岁,与既往研究结论相符。IPAS体积较小时一般无明显临床症状,绝大部分因体检偶然发现;当IPAS体积较大时,对周围组织压迫可出现相应的症状,如上腹部不适、反酸等[7]。本组7例直径<3 cm的IPAS患者均无相应症状;2例直径>3 cm的IPAS患者中,1例因腹膜后肿块就诊,1例肝硬化门静脉高压行脾脏切除术后随访,2例均未出现临床症状,可能与其对周围结构压迫不显著有关。本组病例肿瘤标志物(AFP、CEA、CA19-9)均在正常范围内,与既往研究结果一致[5-6,8-10]。当IPAS发生表皮样囊肿时,CA19-9可轻度升高[5]。本组3例发生在脾脏切除后,推测可能与脾脏切除后IPAS代偿有关。IPAS为先天解剖位置发育异常,一般不需要手术治疗,影像学医师缺乏认识易误诊为胰腺富血供肿瘤。因此,早期正确诊断可避免不必要的活检及手术治疗。
3.2 影像学表现 一般位于胰尾,呈类圆形或椭圆形,直径<3 cm。与正常胰腺相比,IPAS患者行CT平扫一般呈等密度或稍高密度,增强扫描强化一般高于正常胰腺[8-9,11-12]。与正常脾脏相比,IPAS一般与脾脏呈等密度,增强扫描强化程度与脾脏基本一致,部分患者动脉期可出现与脾脏相似的“花斑样”强化,是IPAS的特征性表现[8-9,11-12]。
与正常胰腺相比,本组IPAS患者MRI抑脂T1WI 7例均呈低信号,抑脂T2WI 2例呈等信号,5例呈高信号。Kim等[11]报道的7例IPAS病例中,T1WI均呈低信号,T2WI均呈稍高信号。本组病例与该研究结果存在一定的差异,推测可能与红髓及白髓比例不同有关。红髓因含有脾血窦T2WI呈低信号,白髓因淋巴组织富含水分而呈高信号[5,7]。本组病例DWI均呈稍高或高信号;ADC图2例呈等信号,5例呈低信号。增强扫描强化程度一般类似或高于正常胰腺,与CT表现基本相似。与正常脾脏相比,除2例脾切除IPAS患者外,其余5例抑脂T1WI、抑脂T2WI均呈等信号,与Heredia等[13]的研究结果一致。Kim等[11]报道的7例IPAS中,仅1例T2WI较脾脏表现为稍高信号,其余T1WI、T2WI均与脾脏一致。绝大部分IPAS在T1WI、T2WI与脾脏呈等信号[10]。Jang等[6]研究发现,约15%的IPAS T1WI信号较脾脏低,约5%的T2WI较脾脏信号稍高。IPAS与脾脏在T1WI、T2WI信号上的差异会对诊断产生一定的困难,这可能与IPAS红髓及白髓比例与正常脾脏不同有关。既往研究显示,DWI、ADC图、增强扫描对IPAS的诊断具有很高的价值[6,10]。本研究结果亦证实DWI、ADC图、增强强化程度均与脾脏相似。既往研究发现,20%~48%的IPAS出现“花斑样”强化[6,10,13]。本组IPAS病例CT及MRI均未见“花斑样”强化,可能与本组病例体积较小、血供相对均匀有关。
当IPAS合并肝硬化时,IPAS强化程度可低于正常胰腺,可能与肝硬化时脾脏延迟强化有关[5,7,13]。本组3例IPAS患者合并肝硬化,3例行CT增强扫描,1例动脉期低于正常胰腺,2例与正常胰腺相似,门静脉期3例均强于正常胰腺。2例行MRI增强扫描,动脉期强化程度均低于正常胰腺,而门静脉期及延迟期1例低于正常胰腺,另1例与正常胰腺相似,与既往报道一致[5,7,13]。本组3例IPAS患者均因肝硬化行脾脏切除,此时无正常脾脏进行对照,故对诊断造成一定的困难。因此,当肝硬化脾脏切除后胰尾出现新发结节时,应考虑IPAS的可能。
3.3 鉴别诊断 IPAS一般表现为胰尾部富血供结节,需与胰腺富血供肿瘤鉴别。①神经内分泌肿瘤:是一种胰腺常见富血供肿瘤[14]。Kang等[10]对IPAS和神经内分泌肿瘤对比研究发现,两者在T2WI、DWI信号及强化方式上差异明显,IPAS与脾脏相比更多地表现为等信号及同步强化。因此,对于胰尾部密度、信号、强化方式与脾脏一致富血供病灶应考虑IPAS;反之,神经内分泌肿瘤可能性大。②富血供转移瘤:一般有原发肿瘤病史,常为肾透明细胞癌或肝癌等富血供肿瘤,明确病史一般鉴别不难。
总之,当胰尾部结节的密度、信号特征及强化方式与脾脏相似或脾脏切除后胰腺尾部出现新发结节时,应该考虑IPAS的可能,避免不必要的活检及手术治疗。
