酶解法制备鲟鱼皮活性肽条件优化及抗氧化能力
2020-04-07尹剑武瑞赟阿热爱·巴合提李平兰
尹剑 武瑞赟 阿热爱·巴合提 李平兰


摘 要:为提高从鲟鱼皮中提取的生物活性肽含量,以鲟鱼皮胶原蛋白为主要材料,以蛋白酶酶解后的肽得率为主要考察指标,在单因素试验基础上利用正交试验分析加酶量、酶解温度、酶解时间对鲟鱼皮活性肽得率的影响,并优化酶解条件。在此基础上以新鲜猪肉为模型,考察鲟鱼皮活性肽溶液处理对猪肉组织抗氧化酶(总超氧化物歧化酶(total-superoxide dismutase,T-SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、谷胱甘肽S转移酶(glutathione S-transferase,GST))活力的影响。结果表明:酶解鲟鱼皮胶原蛋白的最适酶为碱性蛋白酶,最佳工艺条件为加酶量12 000 U/g、酶解温度60 ℃、酶解时间4 h,在此条件下,肽得率为(12.59±0.98)%;鲟鱼皮活性肽可以提高猪肉组织T-SOD、GSH-Px和GST活性,具有抗氧化功效。
关键词:鲟鱼皮;酶解法;活性肽;抗氧化能力
Abstract: In order to improve the yield of bioactive peptides extracted from sturgeon skin, the protease-catalyzed hydrolysis of collagen from sturgeon skin was optimized using one-factor-a-time and orthogonal array designs. The yield of bioactive peptides was investigated with respect to enzyme addition, hydrolysis temperature and hydrolysis time. Furthermore, the antioxidant effect of the peptides in fresh pork was evaluated by measuring the activities of total superoxide dismutase (T-SOD), glutathione peroxidase (GSH-Px) and glutathione S-transferase (GST). Alkaline protease was found to be the most suitable enzyme for the hydrolysis of sturgeon skin collagen. The optimal conditions for enzymatic hydrolysis were established as follows: enzyme dosage 12 000 U/g, temperature 60 ℃, and hydrolysis time 4 h, resulting in the highest peptide yield of (12.59 ± 0.98)%. The active peptides could increase the activity of T-SOD, GSH-Px and GST in pork, showing antioxidant effect.
Keywords: sturgeon skin; enzymatic hydrolysis method; active peptide; antioxidant capacity
鲟鱼皮具有高蛋白、低糖的特点,含有丰富的蛋白质、脂肪、糖类及叶黄素、蝲蛄素等[1],其中以蛋白质含量最高,具有较高的开发和利用价值。鱼皮蛋白主要成分为胶原蛋白,基本组成为(甘氨酸-X-Y)n,其中X多为脯氨酸,Y多为羟脯氨酸或羟赖氨酸,鱼皮蛋白具有良好的溶解性和消化性,无依赖性、无毒副作用,是一种优质的蛋白质资源。鱼皮胶原蛋白活性肽的提取制备方法有很多,常见的为酶解法、酸碱处理法等,但是由于天然活性肽含量少、提取较难,在实际应用中主要通过蛋白酶酶解胶原蛋白获得。目前已有文献报道从草鱼[2]、真鲷鱼[3-4]、鲢鱼[5]、罗非鱼[6-7]等鱼类副产物中提取胶原蛋白,并通过酸解、酶解制备胶原肽。胶原肽分子质量小,具有良好的胶凝性[8]、乳化性[9-10]和增稠性[11-12]等功能特性,亦具有免疫调节、抗高血压、调节血糖、降低胆固醇水平及抗氧化[13-14]等生物活性功能。近年来,随着生活节奏加快和日益增加的生活压力,造成机体氧化应激,从而诱导机体衰老及患病,使得人们越来越关注动植物蛋白源抗氧化肽及含抗氧化肽的食品,抗氧化肽的生物活性已逐渐被证实、重视和利用[15]。现有研究数据表明,动植物蛋白降解产生的小分子多肽具有控制生物大分子氧化活性及去除体内自由基的潜在生物活性。抗氧化肽是一种以休眠形式存在于母蛋白序列中的特异性蛋白片段[16],当蛋白质水解释放出后可表现出抑制、延缓脂肪氧化等抗氧化活性。因食源性抗氧化肽具有安全、种类多、活性稳定、易吸收等特点,已成为近年来的研究热点[17-19]。食源性抗氧化肽通常来源于植物或动物等食源性蛋白,一般由蛋白水解制备,如大豆蛋白[20-21]、乳铁蛋白[22-23]、鱼类蛋白[24-25]及贝类蛋白等。为清除多余自由基,延缓脂肪氧化,延长机体寿命,需要在饮食中添加适当的抗氧化剂,如食源性抗氧化肽等。
为拓展抗氧化肽的应用,微胶囊包埋[26]及保鲜剂可为其应用提供新方向。赵静[27]以林蛙胶原蛋白抗氧化肽为原料,制备出林蛙肽-海藻酸钠微胶囊与林蛙肽-微孔淀粉-海藻酸钠微膠囊。张宝林[28]以马鲛鱼鱼糜的保鲜效果为指标,考察马鲛鱼鱼骨生物活性肽、茶多酚和壳聚糖3 种保鲜剂的抗氧化效果,结果表明,鱼骨生物活性肽对鱼糜氧化产物抑制率达到80%以上,为抗氧化活性肽的应用提供了方向,但具体的作用位点或机理并没有阐释清楚,因此,抗氧化活性肽相关研发、作用机理仍然是研究者关注的热点。
本研究选取人工养殖鲟鱼鱼皮为原料,首先筛选最适酶,通过单因素试验、正交试验对最适酶酶解后肽得率进行测定,得到最佳酶解条件,然后以生鲜猪肉为氧化模型进行自由基清除实验,通过测定鲟鱼皮活性肽溶液涂抹猪肉表面处理前后猪肉中氧化酶的活性,分析具体的抗氧化效果,阐明可能的作用机理,为鱼皮胶原蛋白的进一步综合开发利用提供一定的参考。
1 材料与方法
1.1 材料与试剂
鲟鱼 北京某鲟鱼繁殖基地;豬肉 物美超市。
碱性蛋白酶、中性蛋白酶、胰蛋白酶、胃蛋白酶 宝如亿(北京)生物技术有限公司;木瓜蛋白酶 南宁庞博生物工程有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma公司;无水乙醇、盐酸、氢氧化钠 北京化工厂;铁氰化钾、三氯乙酸(trichloroacetic acid,TCA)、三氯化铁、Na2HPO4·12H2O、NaH2PO4·2H2O、Na2CO3、酒石酸钾钠、硫酸铜 西陇化工股份有限公司;总超氧化物歧化酶(total-superoxide dismutase,T-SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、谷胱甘肽S转移酶(glutathione S-transferase,GST)试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
YXQ-LS-SⅡ全自动立式电热压力蒸汽灭菌器 上海博讯实业有限公司医疗设备厂;DNP-9102恒温培养箱、FS-2内切分散机 上海精宏实验设备有限公司;FD-1PF真空冷冻干燥机 北京博医康试验仪器有限公司;BILON3-120C超声波清洗机 上海比朗仪器制造公司;UV-3200s紫外分光光度计 北京赛伯乐仪器有限公司。
1.3 方法
1.3.1 鲟鱼皮前处理
将鲟鱼皮洗净除杂,切成边长1 cm左右的正方形小块,用体积分数0.4%的盐酸浸泡2 h(1∶5,m/V),以除去鱼皮中的脂肪和可溶性杂蛋白,同时促使胶原膨胀,经过酸膨胀的胶原组织会变得柔软,可以直接用于提取明胶。之后用蒸馏水将鱼皮冲洗至弱酸性后高压浸提(121 ℃、2 h),过滤掉鱼皮后抽滤,除去油脂等杂质,得到明胶溶液。
1.3.2 鲟鱼皮明胶溶液酶解实验
取一定量用鲟鱼皮制得的明胶溶液,采用最适酶和最适酶解pH值,加入一定量酶后将鲟鱼皮明胶溶液置于不同温度的摇床中进行酶解,酶解结束后沸水浴灭酶10 min。
1.3.3 鲟鱼皮明胶溶液酶解单因素试验
1.3.3.1 最适酶的筛选
分别取5 组、每组10 mL鲟鱼皮明胶溶液,调节pH值,之后均按8 000 U/g加酶量加入不同种类的酶,并且在各酶的最适温度下酶解4 h,酶解结束后煮沸灭酶。测定各组酶解液的肽得率,同时各取一部分酶解液冷冻干燥制得肽粉,定量测定各组肽粉的DPPH自由基清除率和总还原力,综合考虑各因素,选取最适酶,后续对其酶解条件进行进一步优化。所用各酶最适酶解条件如表1所示。
1.3.3.2 加酶量对酶解效果的影响
取6 组、每组10 mL鲟鱼皮明胶溶液,分别按2 000、4 000、6 000、8 000、10 000、12 000 U/g加酶量加入最适酶,酶解温度60 ℃、酶解时间6 h进行酶解,考察加酶量对酶解效果的影响。
1.3.3.3 酶解温度对酶解效果的影响
取4 组、每组10 mL鲟鱼皮明胶溶液,分别在50、55、60、65 ℃条件下酶解,加酶量10 000 U/g、酶解时间6 h,考察酶解温度对酶解效果的影响。
1.3.3.4 酶解时间对酶解效果的影响
取6 组、每组10 mL鲟鱼皮明胶溶液,分别酶解2、4、6、8、10、12 h,其余条件均取上述单因素试验得出的最优条件,考察酶解时间对酶解效果的影响。
1.3.4 鲟鱼皮明胶溶液酶解正交试验
在单因素试验基础上,经正交试验,对鲟鱼皮明胶溶液的酶解条件进行优化。对加酶量、酶解温度和酶解时间3 个因素进行正交试验。
1.3.5 鲟鱼皮活性肽抗氧化活性测定
1.3.5.1 DPPH自由基清除率测定
取1.5 mL 5 mg/mL肽粉溶液(对照组为等体积去离子水),与1.5 mL体积分数99.5%乙醇混匀,加入0.375 mL 0.02 g/100 mL DPPH乙醇溶液振荡混匀;室温下暗室反应60 min后在517 nm波长处测定吸光度(A),吸光度越小表示DPPH自由基清除能力越强。DPPH自由基清除率按式(1)计算。式中:A样品为样品在517 nm波长处的吸光度;A对照为对照组在517 nm波长处的吸光度。
1.3.5.2 总还原力测定
取1 mL 5 mg/mL肽粉溶液,加入2.5 mL 0.2 mol/L pH 6.6磷酸缓冲液和2.5 mL 5 g/100 mL铁氰化钾溶液,混匀,50 ℃保温20 min后加入2.5 mL 10 g/100 mL TCA,混匀后3 000 r/min离心10 min,取上清液2.5 mL,加入0.5 mL 0.1 g/100 mL三氯化铁,然后在700 nm波长处测定吸光度,参照Abdelhedi等[29]的方法测定总还原力,总还原力以半胱氨酸浓度(mmol/L)表示。
1.3.6 肽得率测定
取酶解前或酶解后鲟鱼皮明胶溶液5 mL,加入5 mL 30 g/100 mL的TCA,静置20 min后4 000 r/min离心15 min,取1 mL稀释5~10 倍的上清液,加入5 mL Folin-酚甲液后混匀;在25 ℃条件下保温10 min,之后加入0.5 mL Folin-酚乙液并且立刻振荡混匀,在25 ℃条件下保温30 min,保温结束后测定500 nm波长处吸光度。参考任俊凤[30]的方法绘制标准曲线,计算样品中可溶性蛋白的质量。肽得率按式(2)计算。
(2)式中:A为酶解后溶于30 g/100 mL TCA的可溶性蛋白质量/mg;B为酶解前明胶溶液中溶于30 g/100 mL TCA的可溶性蛋白质量/mg;C为明胶溶液中可溶性蛋白总质量/mg。
1.3.7 鲟鱼皮活性肽抗氧化能力测定
配制1、2、4 mg/mL(低、中、高剂量组)肽粉溶液,将等体积3 种溶液和蒸馏水分别均匀涂抹于100 g猪后腿肉上,之后将各组猪肉以保鲜膜包裹,置于托盘,放入4 ℃冰箱中避光贮藏。每2 d取适量各组猪肉样品,加入适量生理盐水后利用内切分散机将猪肉搅碎,3 500 r/min、4 ℃低温离心10 min后取上清液,按照试剂盒测定法对T-SOD、GSH-Px及GST活性进行测定。
1.4 数据处理
所得数据均为平行测定3 次所得结果,以平均值±标准差表示。采用IBM SPSS Statistics数据处理软件对实验结果进行处理,应用中心点法对各组变量的计算结果进行方差分析和差异显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 最适酶的筛选结果小写字母不同,表示差异显著(P<0.05)。图2~3、7同。
由图3可知,碱性蛋白酶酶解产物肽得率显著高于其余4 种酶解产物(P<0.05)。综合考虑后,选择碱性蛋白酶进行酶解条件的进一步优化,这一结果与许多制备抗氧化肽的研究结果一致。薛雨菲等[31]制备巴旦杏粕蛋白抗氧化肽,利用酶解产物水解度及DPPH自由基清除率为指标,从复合蛋白酶、木瓜蛋白酶、胰蛋白酶、中性蛋白酶及碱性蛋白酶中筛选出碱性蛋白酶为最适水解酶。
2.2 碱性蛋白酶酶解条件的单因素试验结果
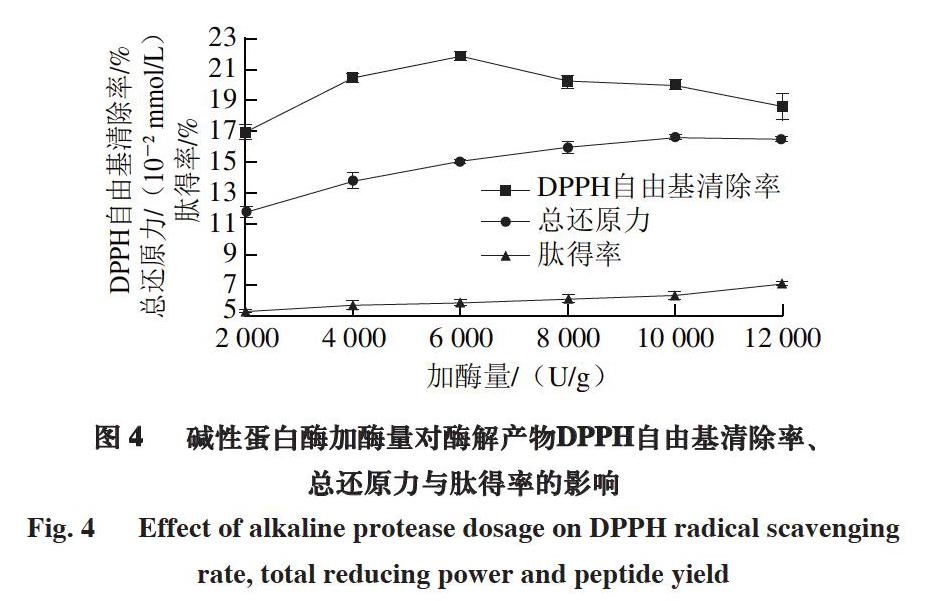
2.2.1 加酶量对酶解产物活性肽得率及抗氧化活性的影响
由图4可知,随着碱性蛋白酶加酶量增加,酶解产物DPPH自由基清除率呈现先增加后降低的趋势,在加酶量为6 000 U/g时达到最大值(21.30±0.30)%,当加酶量大于6 000 U/g时,酶解产物DPPH自由基清除率降低的原因为:一方面,底物浓度不变时,随着加酶量的增加,底物被充分水解成不具有抗氧化活性的寡肽或游离氨基酸[32];另一方面,当酶相对于底物过多时,酶浓度过高导致酶分子之间的竞争性抑制[31]。
酶解产物总还原力随着加酶量的增加先逐渐增大,加酶量达到10 000 U/g后酶解产物总还原力基本保持不变,这是由于当加酶量增加到一定程度后,底物被充分酶解,生成的具有还原性的肽量基本保持不变。当加酶量为10 000 U/g时,酶解产物总还原力达到最大值(0.166±0.002) mmol/L。
酶解产物肽得率随着加酶量的增加而逐渐增大,当加酶量为12 000 U/g时肽得率达到最大值(7.17±0.01)%,且加酶量为10 000、12 000 U/g时总还原力没有显著性差异,因此选择加酶量为8 000、10 000、12 000 U/g进行正交试验优化。
2.2.2 酶解温度对酶解產物活性肽得率及抗氧化活性的影响
由图5可知,碱性蛋白酶的酶解温度为65 ℃时,酶解产物的DPPH自由基清除率达到最大值(19.64±0.78)%。随着碱性蛋白酶的酶解温度升高,酶解产物的总还原力逐渐降低,这是由于在较高温度下碱性蛋白酶活性降低,水解得到的具有抗氧化活性的肽逐渐减少,因此水解产物的总还原力逐渐降低。当酶解温度为50 ℃时,酶解产物的总还原力达到最大值(0.081±0.002) mmol/L。由肽得率测定结果可知,肽得率随着酶解温度升高的变化趋势为先增加后降低。碱性蛋白酶活性先随着酶解温度升高而提高,后期随着酶解温度继续升高酶活性逐渐降低,原因是高温破坏维持酶分子结构的次级键,造成酶活性降低,延缓酶解过程[33]。酶解温度为60 ℃时肽得率达到最大值(6.53±0.09)%,因此选择酶解温度为55、60、65 ℃ 3 个水平进行正交试验优化。
2.2.3 酶解时间对酶解产物活性肽得率及抗氧化活性的影响
由图6可知,随着酶解时间的延长,碱性蛋白酶酶解产物DPPH自由基清除率逐渐降低,这可能是由于在蛋白质酶解刚开始时,酶解产物主要是具有DPPH自由基清除活性的肽,继续酶解过程中,这些活性肽又会被水解为更小的寡肽或氨基酸,酶解产物的DPPH自由基清除率降低[33]。酶解时间为2 h时DPPH自由基清除率最高,可达(19.27±0.14)%。随着酶解时间的延长,碱性蛋白酶酶解产物的总还原力逐渐增高,说明在酶解过程中碱性蛋白酶酶解底物中具有还原力的活性肽越来越多,当酶解时间为12 h时酶解产物总还原力达到最大值(0.14±0.01) mmol/L。碱性蛋白酶酶解时间为4 h时,肽得率达到最大值(9.23±0.05)%,说明从酶解开始至4 h时酶解产物中短肽含量逐渐增加,而底物全部被水解后蛋白酶继续水解短肽成寡肽或氨基酸。由于4 h时肽得率最高,因此选择酶解时间为2、4、6 h 3 个水平进行正交试验优化。
2.3 碱性蛋白酶酶解条件的正交试验结果与分析
2.3.1 正交试验优化结果
在上述单因素试验的基础上,选取加酶量、酶解温度和酶解时间3 个因素,以肽得率为指标采用正交试验对碱性蛋白酶酶解制备鲟鱼皮活性肽工艺进行优化。由表3可知,根据极差分析,各因素对酶解产物肽得率的影响程度大小顺序为C>A>B,即酶解时间>加酶量>酶解温度。碱性蛋白酶酶解制备鲟鱼皮活性肽工艺条件的最优组合为A3B2C2,即加酶量12 000 U/g、酶解温度60 ℃、酶解时间4 h。3 个因素的F值均小于F0.05(2,2),表明均不显著,原因可能是单因素试验存在误差,导致正交试验选择的取值范围有较小偏差。
2.3.2 验证实验
根据正交试验得出的最佳工艺条件进行酶解,即加酶量12 000 U/g、酶解温度60 ℃、酶解时间4 h,进行10 次平行实验,得到肽得率为(12.59±0.53)%,高于表3中每一组试验结果,故A3B2C2为最佳酶解工艺条件。
由图7可知,碱性蛋白酶酶解法制备鲟鱼皮活性肽优化前(优化前条件为1.3.3.1节中碱性蛋白酶的酶解条件)的肽得率为(5.31±0.34)%,优化后肽得率为(12.59±0.53)%,升高1.37 倍,且差异极显著(P<0.01)。任海伟等[34]酶解制备藏系羊胎盘肽,经过单因素及响应面试验优化得到的最优条件下肽得率为18.52%,略高于本研究结果,表明酶解鲟鱼皮肽得率仍有进一步提高的空间,将在后续实验中继续研究。
2.4 鲟鱼皮活性肽的抗氧化能力
2.4.1 鲟鱼皮活性肽对猪肉组织T-SOD活力的影响
由图8可知,随着贮藏时间的延长,各处理组猪肉组织T-SOD活力均呈现下降趋势,但是贮藏时间相同时,各组T-SOD活力大小均为高剂量组>中剂量组>低剂量组>对照组,由此可知,鲟鱼皮活性肽具有提高T-SOD酶活性的效果,且该效果与鲟鱼皮活性肽溶液的质量浓度呈正相关。
2.4.2 鲟鱼皮活性肽对猪肉组织GSH-Px活力的影响
GSH-Px是机体内一类分布很广泛的抗氧化酶,是系统发育相关酶类。SOD活性增强会引起GSH-Px活性提高,进而在通路中影响下游酶的活性,如提高GST活性。
由图9可知,贮藏时间相同时,高剂量组猪肉组织GSH-Px活力最高,其余组GSH-Px活力大小顺序为中剂量组>低剂量组>对照组,因此鲟鱼皮活性肽同样具有提高GSH-Px活力的功效,且质量浓度越大GSH-Px活性越强。
2.4.3 鲟鱼皮活性肽对猪肉组织GST活力的影响
GST是谷胱甘肽巯基转移酶,作为机体生物转化最重要的Ⅱ相代谢酶之一,是细胞抗損伤、抗癌变的主要解毒系统。由图10可知,低温贮藏过程中,贮藏时间相同时,对照组猪肉组织中GST活力最低,低剂量组比对照组稍高,中剂量组高于低剂量组,高剂量组最高,表明鲟鱼皮活性肽可以提高GST酶活力且肽质量浓度越高GST酶活力越强。各处理组猪肉组织GST酶活力均随贮藏时间延长而下降,这是由于外界氧气及其他条件的影响,脂肪氧化逐渐加剧,抗氧化酶的酶活力也随之逐渐降低。
综上所述,在鲟鱼皮活性肽的作用下,猪肉组织T-SOD活力降低的趋势得到缓解,且T-SOD活力与鲟鱼皮活性肽质量浓度呈正相关。贮藏时间相同时,处理组猪肉组织GSH-Px活力高于对照组,且鲟鱼皮活性肽质量浓度越高效果越强。最后验证了鲟鱼皮活性肽同样具有提高GST活力的作用,且鲟鱼皮活性肽质量浓度越高GST活力越强。鲟鱼皮活性肽作用于猪肉组织后,通过提高SOD活力促进GSH-Px活力,进而促进GST活力,从而达到抗氧化、延缓食物氧化的作用。
张燕等[35]发现,蛋清源活性肽可提高HEK293细胞中T-SOD、GSH-Px等抗氧化酶活性,且随着肽浓度提高酶活力均有所提高,呈现浓度依赖型关系,本研究结果与该报道一致。
3 结 论
在单因素试验结果基础上,通过正交试验确定碱性蛋白酶酶解制备鲟鱼皮活性肽最佳工艺条件为加酶量12 000 U/g、酶解温度60 ℃、酶解时间4 h,在此条件下肽得率达12.59%,相比优化前增长1.37 倍。在此基础上通过鲟鱼皮活性肽溶液处理猪肉并测定猪肉组织抗氧化酶(T-SOD、GSH-Px及GST)活力,结果表明,鲟鱼皮活性肽具有提高T-SOD、GSH-Px和GST活性的功效。以上实验结果不仅有力证实了鲟鱼皮活性肽具有抗氧化活性,而且探究了抗氧化活性的具体机制,为抗氧化活性肽的更深一步研究提供了参考。
参考文献:
[1] 赵连胜. 鱼皮漫谈(三)[J]. 内陆水产, 1997(4): 28-33.
[2] 杨莉莉, 申锋, 熊善柏, 等. 木瓜蛋白酶制备草鱼鳞胶原肽的工艺优化及产物特性分析[J]. 食品科技, 2012(2): 61-65.
[3] 申锋. 草鱼鱼鳞胶原肽的制备及其特性研究[D]. 武汉: 华中农业大学, 2009: 1-10. DOI:10.7666/d.y1597946.
[4] 胡爱军, 闫伟, 郑捷, 等. 酶法水解真鲷鱼皮和鱼鳞制取胶原蛋白肽[J]. 食品工业, 2012(10): 65-68.
[5] 陈日春, 熊文飞, 蔡一楠, 等. 鲢鱼鱼鳞胶原蛋白肽抗氧化作用研究[J]. 食品科学技术学报, 2013, 31(6): 28-35.
[6] 宋芹, 颜军, 郭晓强, 等. 酶法制取罗非鱼鱼鳞胶原蛋白寡肽的工艺[J]. 食品研究与开发, 2011, 32(4): 39-43. DOI:10.3969/j.issn.1005-6521.2011.04.011.
[7] 夏光华, 申铉日. 三酶法制备罗非鱼鱼皮胶原蛋白抗氧化肽及活性研究[J]. 食品科学, 2012, 33(23): 175-179.
[8] 周光朝, 刘良忠, 万菡, 等. 高水解度草鱼鱼鳞胶原蛋白肽的研究[J]. 粮食科技与经济, 2011, 36(2): 52-56. DOI:10.3969/j.issn.1007-1458.2011.02.019.
[9] PATI F, ADHIKARI B, DHARA S. Isolation and characterization of fish scale collagen of higher thermal stability[J]. Bioresource Technology, 2010, 101(10): 3737-3742. DOI:10.1016/j.biortech.2009.12.133.
[10] LING Jian, JIANG Weijie, ZHANG Ying, et al. Genome-wide analysis of WRKY gene family in Cucumis sativus[J]. BMC Genomics, 2011, 12(1): 471-491. DOI:10.1186/1471-2164-12-471.
[11] WANG Lingzhao, YANG Bao, DU Xiuqiao, et al. Optimization of conditions for extraction of acid-soluble collagen from grass carp (Ctenopharyngodon idella) by response surface methodology[J]. Innovative Food Science and Emerging Technologies, 2008, 9(4): 604-607. DOI:10.1016/j.ifset.2008.03.001.
[12] NAGAI T, IZUMI M, ISHII M. Fish scale collagen: preparation and partial characterization[J]. International Journal of Food Science and Technology, 2004, 39(3): 239-244. DOI:10.1111/j.1365-2621.2004.00777.x.
[13] 马海乐, 王中斌, 骆琳, 等. 不补料连续酶解-膜分离耦合制备鱼鳞胶原蛋白抗氧化肽的研究[J]. 食品工业科技, 2010, 31(8): 204-207. DOI:10.13386/j.issn1002-0306.2010.08.007.
[14] 胡松青, 张婷婷, 郭莎莎, 等. 鱼鳞明胶ACE抑制肽的制备及其活性研究[J]. 现代食品科技, 2012(11): 1491-1494.
[15] 徐鑫镁, 施文忠. 外源性抗氧化剂与人体健康之关系[J]. 上海体育学院学报, 2000, 24(增刊1): 68-69. DOI:10.16099/j.cnki.jsus.2000.s1.028.
[16] 孙德玉, 陈祚修. 抗氧化剂和健康[J]. 锦州医科大学学报, 1998(5): 46-49.
[17] KARIM A A, BHAT R. Fish gelatin: properties, challenges, and prospects as an alternative to mammalian gelatins[J]. Food Hydrocolloids, 2009, 23(3): 563-576. DOI:10.1016/j.foodhyd.2008.07.002.
[18] HUO Jianxin, ZHAO Zheng. Study on enzymatic hydrolysis of gadus morrhua, skin collagen and molecular weight distribution of hydrolysates[J]. Agricultural Sciences in China, 2009, 8(6): 723-729. DOI:10.1016/S1671-2927(08)60271-0.
[19] BAE I, OSATOMI K, YOSHIDA A, et al. Biochemical properties of acid-soluble collagens extracted from the skins of underutilised fishes[J]. Food Chemistry, 2008, 108(1): 49-54. DOI:10.1016/j.foodchem.2007.10.039.
[20] 廖群, 王利, 李詒光. 海洋胶原蛋白活性肽的研究进展[J]. 肉类研究, 2009, 23(4): 79-84.
[21] ISSOUFOU A. Lactobacillus plantarum Lp6发酵大豆蛋白粉及其抗氧化肽的研究[D]. 无锡: 江南大学, 2010: 10-11.
[22] DING Guofang, HUANG Fangfang, YANG Zuisu, et al. Anticancer activity of an oligopeptide isolated from hydrolysates of sepia ink[J]. Chinese Journal of Natural Medicines, 2011, 9(2): 151-155. DOI:10.3724/SP.J.1009.2011.00151.
[23] 罗献梅, 陈代文, 张克英. 乳铁蛋白及其活性肽的营养生理作用及应用前景[J]. 饲料工业, 2005, 26(2): 5-9.
[24] 沈澎, 刘学军. 胃蛋白酶制备鲤鱼鳞胶原肽及其特性研究[J]. 吉林农业, 2011(4): 76-77.
[25] 张莉莉. 扇贝抗氧化活性肽的制备及其活性的研究[D]. 哈尔滨: 哈尔滨工业大学, 2013: 1-20.
[26] SONG Liyan, LI Tingfei, YU Rongmin, et al. Antioxidant activities of hydrolysates of arca subcrenata prepared with three proteases[J]. Marine Drugs, 2008, 6(4): 607-619. DOI:10.3390/md6040607.
[27] 赵静. 林蛙胶原蛋白多肽的分离纯化、功能性研究及其微胶囊的制备[D]. 长春: 吉林大学, 2019: 1-10.
[28] 张宝林. 马鲛鱼鱼骨生物活性肽的提取与应用[D]. 厦门: 华侨大学, 2018: 1-8.
[29] ABDELHEDI O, JRIDI M, JEMIL I, et al. Combined biocatalytic conversion of smooth hound viscera: protein hydrolysates elaboration and assessment of their antioxidant, anti-ACE and antibacterial activities[J]. Food Research International, 2016, 86: 9-23. DOI:10.1016/j.foodres.2016.05.013.
[30] 任俊凤. 河豚鱼皮胶原蛋白肽的制备及其抗氧化活性[D]. 大连: 大连工业大学, 2008: 16-17.
[31] 薛雨菲, 李芳, 程怡媚, 等. Box-Benhnken响应面优化巴旦杏抗氧化肽的制备工艺[J]. 现代食品科技, 2019 35(12): 208-215. DOI:10.13982/j.mfst.1673-9078.2019.12.027.
[32] BAMDAD F, WU J, CHEN L. Effects of enzymatic hydrolysis on molecular structure and antioxidant activity of barley hordein[J]. Journal of Cereal Science, 2011, 54(1): 20-28. DOI:10.1016/j.jcs.2011.01.006.
[33] LIU Fengru, WANG Li, WANG Ren, et al. Calcium-binding capacity of wheat germ protein hydrolysate and characterization of peptide-calcium complex[J]. Journal of Agricultural and Food Chemistry, 2013, 61(31): 7537-7544. DOI:10.1021/jf401868z.
[34] 任海偉, 石菊芬, 蔡亚玲, 等. 响应面法优化超声辅助酶解制备藏系羊胎盘肽工艺及抗氧化能力分析[J]. 食品科学, 2019, 40(24): 265-273. DOI:10.7506/spkx1002-6630-20181101-009.
[35] 张燕, 胡榕, 郑健, 等. 蛋清源活性肽对过氧化氢诱导的HEK293细胞抗氧化酶活力及白细胞介素8分泌的影响[J]. 食品科学, 2019, 40(5): 130-136. DOI:10.7506/spkx1002-6630-20171103-035.
