益气化瘀解毒方联合索拉非尼对人肝癌索拉非尼耐药细胞移植瘤及缺氧诱导因子1α与血管拟态表达的影响*
2020-04-07王亚琪曾普华郜文辉
王亚琪,曾普华,郜文辉△
1.湖南中医药大学(长沙 410208);2.湖南省中医药研究院附属医院肿瘤中心(长沙 410006)
原发性肝癌具有起病隐匿、恶性程度高、疾病进展快、预后较差、死亡率高等特点。我国肝癌发病率位居全球首位,其发病人数和死亡人数均占全球半数以上。目前肝癌以手术、介入、分子靶向治疗为主,存在高复发和转移率、治疗缺乏针对性、难治性耐药和源头创新药物少等问题[1-2]。
肝癌患者对靶向药物Sorafenib的快速耐药是导致临床分子靶向治疗失败的主要原因之一。目前实验研究表明[3-5],Sorafenib抗血管新生可加重局肿瘤微环境乏氧状态,刺激HIF-1α的表达,肿瘤细胞在缺氧环境下可能通过变形、迁移,重新粘附,形成血管样结构,通过血管拟态(VM)获取血液供应,从而产生耐药性。目前西医对其耐药问题尚无行之有效的治疗方法,而传统中医药具有“多层次、多环节、多靶点”的作用[6],寻求逆转Sorafenib耐药的方药可望带来新突破。故本实验主要分析HIF-1α及VM的表达与耐药的关系,探讨益气化瘀解毒方联合Sorafenib对逆转人肝癌细胞Sorafenib耐药的作用及可能机制。
材料与方法
1 材 料 人肝癌QGY7702细胞和人肝癌QGY7702/Sora细胞均由上海中医药大学附属曙光医院肝病研究所刘祖龙博士惠赠。实验动物:BALB/c-nu裸鼠,雄性,4~5周龄,70只,SPF级,购于长沙斯莱克景达实验动物有限公司,许可证号:SYXK(湘)2014-0012。索拉非尼(南通飞宇生物科技有限公司,规格:200 mg,批号:FY34720409)。益气化瘀解毒方(白参10 g,黄芪30 g,醋莪术、重楼各15 g,半枝莲30 g,甘草5 g等)饮片购自湖南中医药大学第一附属医院。高糖DMEM培养基、PBS缓冲液(Hyclone);胎牛血清、0.25%胰蛋白酶、青霉素/链霉素双抗溶液(Gibco)。Anti-HIF-1α(HIF1A)Antibody(博士德),Anti-CD31 Rabbit pAb(Sevicebio),通用二步法检测试剂盒(中杉金桥)。
2 药物制备 Sorafenib稀释液配制:索拉非尼200 mg用100 ml生理盐水充分混匀,稀释浓度为2 mg/ml,置于4℃备用。中药的煎煮:按比例配置好药材,加入适量冷水浸泡30 min,文火煎煮,第一道10倍水煎煮2 h,第二道8倍水煎煮1 h,两道混合过滤、离心去渣,再将药物浓缩至含1 g生药/ml,置于4 ℃备用。
3 肿瘤细胞的培养 将人肝癌细胞株QGY7702和耐药株QGY7702/Sorafenib接种于10% 胎牛血清+90% DMEM+1%青/链霉素双抗溶液的完全培养基中,置于37 ℃,5%CO2的培养箱内。当细胞铺满85%左右时用0.25%胰蛋白酶进行消化传代。耐药细胞培养至约合120个T25瓶(每瓶长满约5×106个细胞),非耐药细胞约20个T25瓶数量以上,胰酶消化,2000 r/min,5 min离心,收集细胞,用PBS缓冲液稀释细胞浓度至约1×107个/0.2 ml。
4 动物造模、分组、给药 将收集的细胞接种至裸鼠的臀背部皮下,每只接种0.2 ml(约含1×107个细胞),接种1周后,65只裸鼠臀背部接种处均形成一黄豆大小隆起。除完全空白对照组亲本细胞模型7只外,其余耐药模型随机分为6组,模型组10只,益气化瘀解毒方组9只,重楼组10只,顺铂组10只,Sorafenib组10只,中西联合(益气化瘀解毒方+Sorafenib)组9只。成瘤后5 d/次监测裸鼠的体重变化并记录。根据人临床给药剂量倍数换算法折算动物给药总剂量。益气化瘀解毒方组裸鼠灌胃总药量为15 g/kg,1次/d;重楼组裸鼠灌胃总药量为4.5 g/kg,1次/d;Sorafenib组裸鼠灌胃总药量为30 mg/kg,1次/d;顺铂组裸鼠腹腔注射总药量为25 mg/kg,1次/5d;中西联合组药物用中药和Sorafenib各半灌胃,1次/d;空白组给予生理盐水灌胃,1次/d。根据裸鼠体重计算灌胃剂量,连续用药21 d后取瘤称重,部分组织用4%多聚甲醛固定,部分存放于液氮中。
5 免疫组化法检测瘤组织HIF-1α表达 瘤组织常规石蜡包埋,切片。脱蜡后入水,滴加抗原修复液、正常山羊血清封闭液、一抗、二抗,经 DAB 显色,苏木素复染细胞核,水洗,脱水,二甲苯透明,中性树脂封片。拍照,进行图象分析。HIF-1α表达的判定:HIF-1α主要表达在细胞核,阳性染色为棕黄/褐色颗粒。低倍镜下(×100)确定5个阳性着色密集区域,在高倍镜(×400)视野下拍照,计数阳性细胞数,取5个视野的均值。
6 CD31/PAS双重染色 石蜡切片常规脱蜡水化后,按照SP法操作,进行CD31免疫组化染色,DBA染色至血管内皮细胞着色后,终止反应,过碘酸溶液中氧化,再行PAS染色,最后用苏木素复染细胞核,脱水,透明,中性树胶封片。拍照,进行图象分析。VM表达的判定:CD31为内皮细胞标记分子,阳性定位于细胞膜。PAS 能够把血管周围富含糖原的基底膜结构染成紫红色。内皮细胞标记的血管为 CD31/PAS 双阳性,而VM是由肿瘤细胞围成的血液流通的管道,基底膜在周围包围,CD31 阴性而 PAS 阳性,并且管腔内可观察到红细胞。低倍镜下(×200)确定5个阳性着色密集区域,在高倍镜(×400)视野下拍照,计数血管拟态,取5个视野的均值。

结 果
1 各组移植瘤净重的比较 见表1。从各组瘤净重比较来看,耐药细胞模型组瘤普遍比不耐药细胞空白组小,差别具有统计学意义(P<0.01)。益气化瘀解毒方联合Sorafenib组与模型组相比差别,瘤体重量明显减轻,差别具有统计学意义(P<0.05)。

表1 各组瘤净重比较(g)
注:与模型组比较,*P<0.05;模型组与空白对照组比较,△P<0.01
2 各组瘤组织中HIF-1α表达水平 见表2。模型组瘤组织中HIF-1α表达水平高于空白对照组,差异具有统计学意义(P<0.01);益气化瘀解毒方组及中西联合组与模型组比较,差异具有统计学意义(P<0.01),两组均可抑制HIF-1α表达(图1)。
3 各组瘤组织中VM表达水平 见表2。Sorafenib组瘤组织中VM表达水平明显高于模型组的表达水平(P<0.05);中西联合组与Sorafenib组比较,差异具有统计学意义(P<0.01),可抑制VM表达水平(图2)。
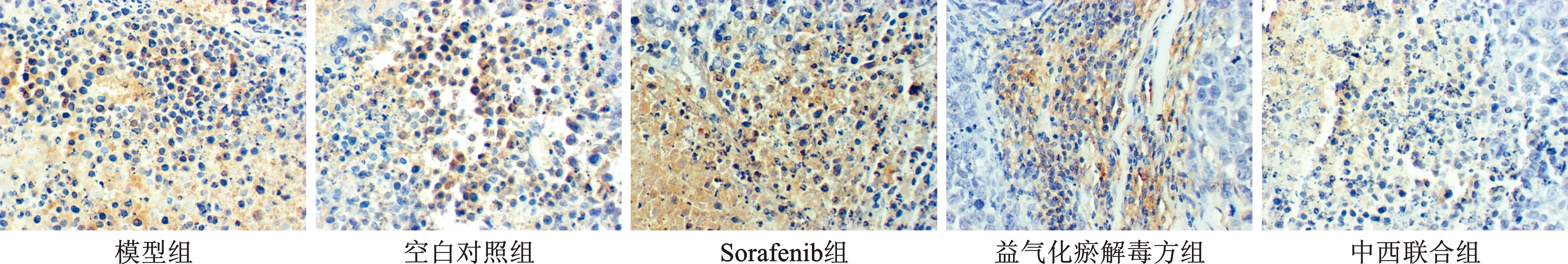
图1 各组瘤组织HIF-1α表达(免疫组化法,×400)
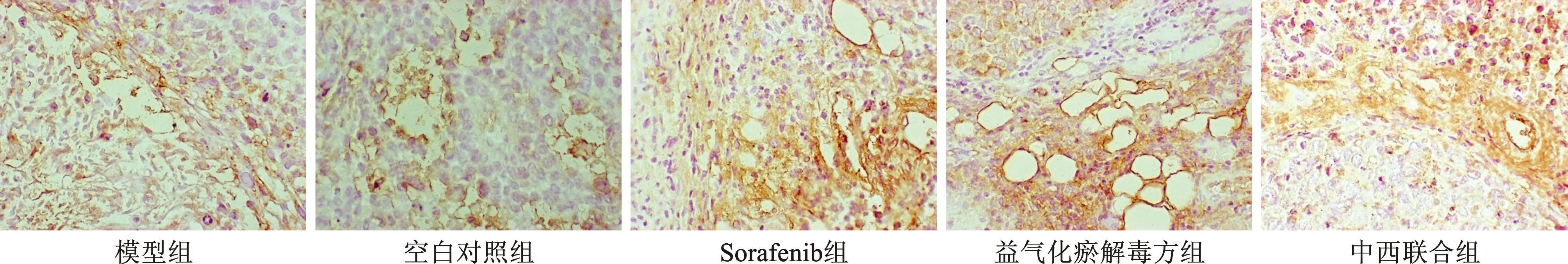
图2 各组瘤组织VM表达(CD31/PAS染色,×400)

表2 各组瘤组织HIF-1α及VM表达水平比较(个/视野)
注:与模型组比较,*P<0.05,△P<0.01;与Sorafenib组比较,
#P<0.05,◇P<0.01
3 HIF-1α与VM表达水平的相关性 HIF-1α在瘤组织中的表达水平为(51.21±7.77)个/视野,VM在瘤组织中的表达水平为(8.17±1.50)个/视野。两者之间存在相关性,呈正相关,相关系数为r=0.609>0.4,可认为两者之间存在中度相关(图3)。
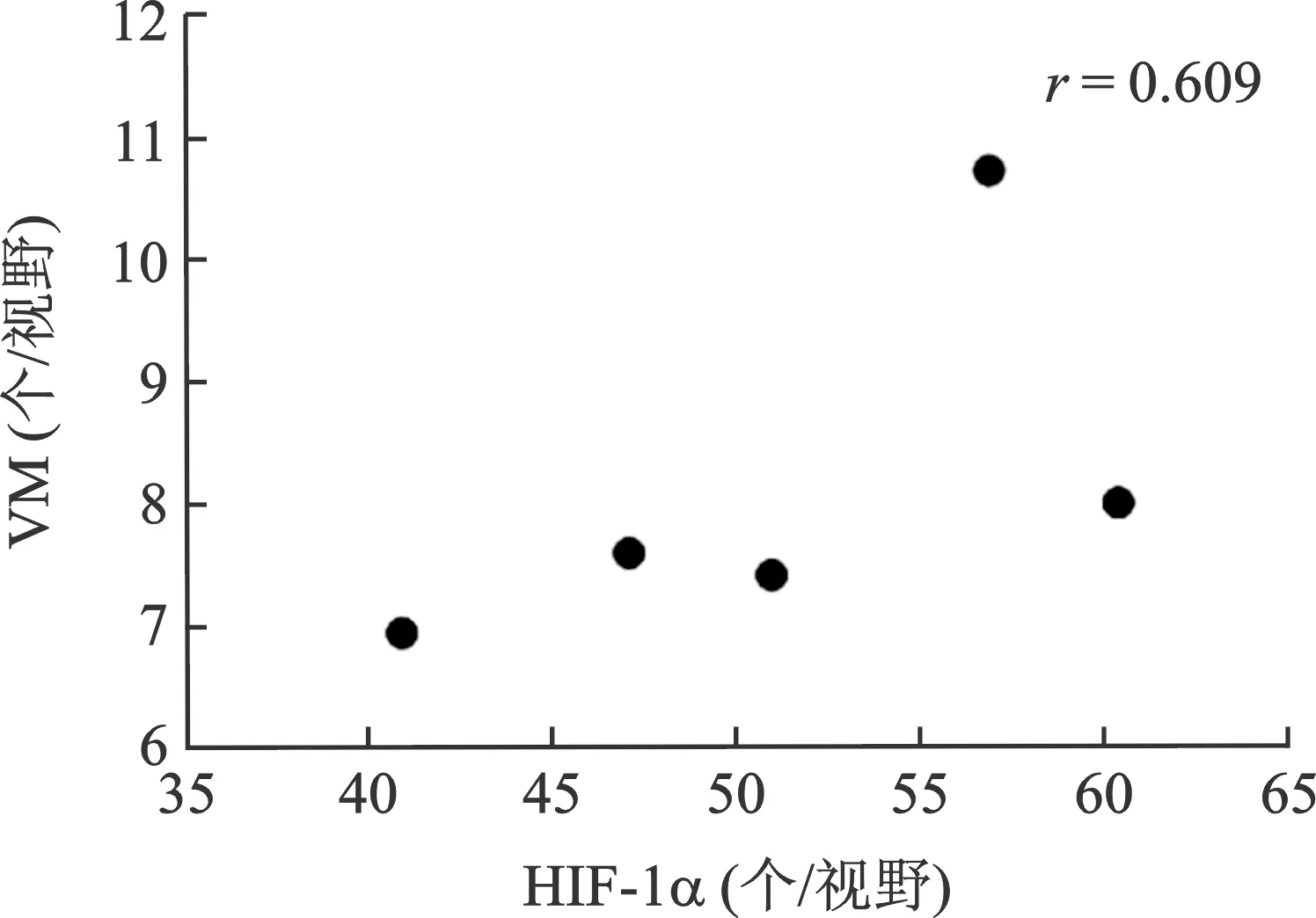
图3 HIF-1α与VM相关关系散点图及相关系数
讨 论
原发性肝癌恶性程度高、预后差,而作为一线治疗药物的分子靶向药物Sorafenib因临床快速获得性耐药问题导致客观有效率较差。因此,本实验主要深入探讨益气化瘀解毒方联合Sorafenib对耐药模型干预的影响,以明确其作用及作用机制,对于改善肝癌治疗及预后具有重要意义。
肝癌耐药在中医并确切的称谓,但根据其临床表现,可属中医“肝积”、“积聚”、“胁痛”、“肝胀”、“黄疸”、“虚劳”等相关病症。中医古籍对肝癌相关病症的病因病机论述众多。肝癌病情复杂、恶性程度高、侵袭性强、进展快、预后极差、多伴有肝病背景、多种邪毒和病理因素夹杂等,这些可归属于中医“毒”或“癌毒”的范畴;肝癌为有形之积,肝肿块常伴疼痛、舌质暗红或瘀斑是“瘀”的客观表现;肝癌患者常见腹胀、纳差、神疲、乏力伴进行性消瘦等为“脾虚”之症;癌毒、瘀血、脾虚三者始终并存,互为因果,恶性循环,贯穿于肝癌整个病程。“坚者软之”,“衰者补之”,治疗当攻补兼施,故“益气化瘀解毒”是切合肝癌病机的常用治法[7-8]。
“益气化瘀解毒方”是经病证结合、精准配伍而成的临床应用多年的效验方。全方以白参、黄芪益气健脾;莪术行气化瘀散结;重楼、半枝莲清热解毒,全方药物配伍精要,扶正抗癌,标本兼治。该组方药物富含人参皂甙、重楼皂苷、多糖、莪术醇、姜黄素、糖蛋白等[9-11]多种抗肿瘤活性组分,既往临床研究证实具有稳定瘤体、调节免疫、改善生活质量、抗复发转移而使患者呈现“带瘤生存”的特点。课题组前期基于对“益气化瘀解毒方”的“多活性组分配伍、多环节、多靶点”抗肝癌作用研究[12-14],提示该方能抑制人肝癌Hep G2细胞和裸鼠移植瘤的生长,能下调HIF-1α、VEGF等表达,上调E-cad表达,抑制肝癌血管新生及血管生成拟态、EMT的形成,对肿瘤血管微环境具调节作用。
目前多数研究证实[5],实体肿瘤普遍存在缺氧的现象,HIF-1α是肿瘤细胞缺氧调节基因表达的调控中心,在低氧环境中为肿瘤细胞提供空间和营养物质。HIF-1α是缺氧诱导因子信号调节通路的中心环节,是一种氧分压感受器,在有氧环境中受各种酶调控可被降解;缺氧时,蛋白酶体系不能泛素化使HIF-1α不能被降解而在细胞体内大量蓄积,蓄积的HIF-1α使癌细胞更适应低氧环境,为癌细胞的增殖、迁移及耐药提供有利条件。血管拟态(VM)[15]是一种不同于经典的完全不依赖于内皮细胞的血管生成模式,肿瘤细胞模拟内皮血管生成途径形成网状管道样结构,输送血液的微循环管道。VM的形成为肿瘤的增殖、迁移和侵袭,甚至耐药的产生提供良好的营养环境。同时,科学实验已证实[3,5],缺氧微环境中HIF-1α的过表达是调控VM形成的重要因素。
本实验结果提示,HIF-1α与VM的表达有中度相关性,呈正相关。耐药模型组与不耐药空白对照组比较,HIF-1α与VM表达均有高表达,说明耐药现象的发生与机体HIF-1α与VM的过表达相关。益气化瘀解毒方联合Sorafenib干预后,可明显抑制人肝癌Sorafenib耐药细胞裸鼠移植瘤瘤体生长,使瘤组织的HIF-1α与VM表达明显下降,说明益气化瘀解毒方联合Sorafeinb在基于抗肿瘤作用上亦可改善肿瘤组织乏氧微环境状态,抑制血管拟态的形成,提高机体对Sorafenib的敏感性,从而拮抗Sorafenib耐药的产生。
综上,益气化瘀解毒方联合Sorafenib基于抗肿瘤作用亦可抑制HIF-1α与VM的表达,改善瘤组织乏氧微环境状态,拮抗机体Sorafenib耐药。目前多数研究亦表明,耐药的发生与肿瘤细胞间质化的转变、肿瘤干细胞、炎性微环境、外泌体及基因调控等方面密切相关,拮抗耐药应从多角度多层次考虑,对于益气化瘀解毒方的挖掘亦有待进一步深入。
