腹腔镜术后孕三烯酮与诺雷德治疗卵巢型子宫内膜异位症的疗效对比及复发相关因素分析
2020-04-07张春霞李艳丽赵玉杰关红缨
张春霞 蔡 俊 李艳丽 赵玉杰 关红缨
子宫内膜异位症(endometriosis,EMs)指具有生长功能的子宫内膜在子宫腔被覆黏膜以外部位生长的现象,卵巢是最常见的受累部位;EMs虽为妇科良性疾病,但其所致的痛经、盆腔疼痛、月经不调、不孕等临床表现严重影响患者生活及生育质量[1]。腹腔镜下病灶切除术可在保留患者生育功能的基础上,切除肉眼可见的病灶组织、卵巢EMs囊肿并分离粘连,是治疗EMs的重要方案之一,但术后微小病灶、非典型病灶残留风险高,术中囊肿剥离存在的囊肿破裂、病灶扩散等风险,均可导致术后复发[2]。临床研究[3]指出,异位内膜组织的生长、增殖、扩散受雌激素周期性作用影响,因此,当前多采用腹腔镜术联合药物治疗以降低EMs复发风险。孕三烯酮是目前治疗EMs的有效药物,可通过抗雌激素、抗孕激素、抗性腺效应等一系列作用营造低雌激素环境,减少腹腔镜术后复发,但存在一定药物毒副反应[4]。而诺雷德则是促性腺激素释放激素激动剂(gonadotropin-releasing hormone agonist, GnRHa),对垂体GnRH受体具高亲和力,连续长期应用可减少垂体分泌促卵泡激素(follicule-stimulating hormone,FSH)、促黄体生成素(luteinizing hormone,LH),抑制卵巢激素分泌,使机体呈低雌激素状态,从而达到抑制异位内膜生长的目的[5]。但当前EMs的术后用药选择尚无统一标准。鉴于此,现回顾性分析150例卵巢EMs患者的临床资料,分析腹腔镜术后分别应用孕三烯酮与诺雷德治疗卵巢型EMs的临床疗效,并对复发相关因素进行探究,旨在为卵巢型EMs的临床治疗、复发防治提供参考。具体报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2015年1月至2018年12月在信阳市中心医院妇产科接受腹腔镜术的150例卵巢型EMs患者,根据治疗方式不同将患者分为A、B两组,其中使用孕三烯酮72例纳入A组,使用诺雷德的78例纳入B组。两组年龄、体质量指数(body mass index ,BMI)、孕次、产次、病程、术前FSH、LH、雌二醇(estradiol,E2)、更年期临床症状调查表(Kupperman)评分[6]、美国生育协会修订的修正的腹腔镜诊断内异症的评分系统(revised classification of the American Fertility Society,r-AFS)[7]分期及盆腔炎、子宫腺肌病、子宫肌瘤、盆腹腔粘连情况、病变位置等一般资料比较差异无统计学意义(P>0.05),具可比性。见表1。
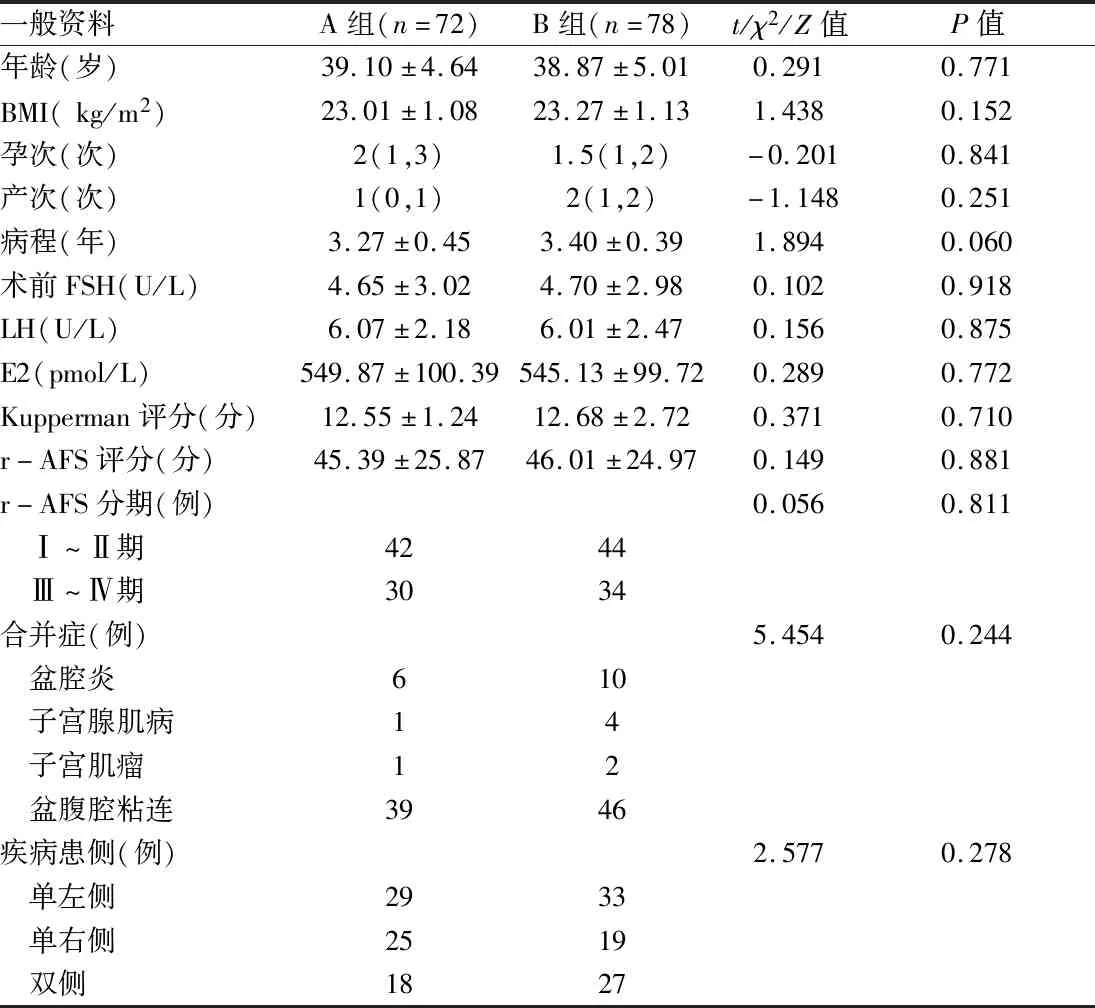
表1 两组一般资料比较
注:BMI为体质量指数,FSH为促卵泡激素,LH为促黄体生成素,E2为雌二醇,Kupperman评分为更年期临床症状调查表,r-AFS为美国生育协会修订的修正的腹腔镜诊断内异症的评分系统
1.2 纳入与排除标准 纳入标准:①符合《子宫内膜异位症的诊治指南》[8]中卵巢型EMs诊断要求,并经腹腔镜术明确分期;②首诊EMs;③入组前6个月内无激素类药物使用史;④无宫内节育器;⑤月经周期规律;⑥术后随访时长≥18个月。排除标准:①合并异位妊娠;②EMs复发患者;③既往接受过EMs针对性治疗;④生殖道畸形;⑤合并恶性肿瘤疾病;⑥纵膈子宫;⑦合并慢性内科疾病。
1.3 方法 两组患者参照《子宫内膜异位症的诊治指南》[8]进行规范化腹腔镜术,全麻后采取头低臀高位,于脐上缘作1 cm横切口,建立气腹(气腹压力12~14 mmHg),先置入10 mm Trocar探查盆腹腔,再分别于左右下腹部脐与髂前上棘连线中外1/3处穿刺,放置5 mm Trocar 2个,若有需要可视情况在主刀侧作第4穿刺孔;明确子宫内膜异位灶位置、与周围脏器关系、有无粘连及粘连程度等,结合r-AFS分期对患者进行评分及分期,依据r-AFS分期、患者年龄、生育情况等选择具体术式。术后均常规抗感染,术后第5天开始给予孕三烯酮或诺雷德,并告知患者药物可能出现的不良反应,一旦出现不良反应及时门诊就诊。A组口服孕三烯酮,剂量每次2.5 mg、2次/周;B组给予诺雷德,皮下注射,单次剂量3.75 mg,间隔28 d给药,共给药6次。两组患者疗程均为6个月,以门诊定期复查方式持续随访,疗程结束后第1年按3个月/次频率随访,次年按6个月/次频率随访,随访时间截止至2019年6月。
1.4 观察指标 ①复发率及不良反应发生率:腹腔镜术治疗3个月后,经影像学复查可见典型卵巢异位囊肿征象,且2个月经周期后仍未消退认为复发,复发率=复发例数/总样本量×100%;不良反应则包括关节酸痛、痤疮、体质量增加、阴道出血等,不良反应发生率=不良反应发生例数/总样本量×100%。②卵巢型EMs复发因素分析:按随访期间复发情况将患者分为复发组、无复发组,比较两组患者年龄、BMI、职业性质、初潮年龄、孕产次、人工流产次数、病程、术前激素水平(FSH、LH、E2)、最大囊肿直径、Kupperman评分、r-AFS评分及分期、合并症(盆腔炎、子宫腺肌病、子宫肌瘤、合并粘连)、疾病患侧、手术情况(保留子宫及单侧或双侧卵巢))、术后妊娠情况、术后诺雷德应用情况等的差异。
1.5 疗效评价 参照文献[6],结合患者术前、疗程结束后的临床症状、体征、B超复查等情况将临床疗效分为完全缓解(临床症状及体征消失,B超复查盆腔包块消失)、部分缓解(临床症状及体征有一定改善或消失,B超复查盆腔明显缩小)、未缓解(临床症状及体征改善程度未达部分缓解标准,或有加重现象,B超复查显示盆腔包块无变化或恶化)3个等级,计算缓解率,完全缓解率=完全缓解例数/总样本量×100%、部分缓解率=部分缓解例数/总样本量×100%。

2 结果
2.1 两组患者临床疗效比较 两组疗效差异有统计学意义(Z=2.387,P=0.017),其中B组完全缓解率高于A组,差异有统计学意义(χ2=5.749,P=0.016)。见表2。
2.2 两组患者累积无复发生存率及不良反应发生率比较 A组治疗期间出现2例关节酸痛、4例痤疮、2例体质量增加;B组阴道少量出血、痤疮各4例,两组不良反应发生率比较差异无统计学意义(P>0.05);且随访期间,B组累积无复发生存率高于A组,差异有统计学意义(P<0.05)。见表3、图1。

表2 两组患者临床疗效比较[例(%)]

表3 两组患者累积无复发生存率及不良反应发生率比较

图1 两组患者Kaplan-Meier生存曲线分析
2.3 复发组与无复发组一般资料比较 两组患者BMI、职业性质、初潮年龄、孕次、产次、人工流产次数、术前激素水平、Kupperman评分、合并疾病、粘连情况、术后药物不良反应发生率比较差异无统计学意义(P>0.05);但复发组年龄小于未复发组,病程、最大囊肿直径、r-AFS评分高于未复发组,r-AFS分期中Ⅲ~Ⅳ期比例、双侧病变、保守手术比例高于未复发组,术后妊娠、术后应用诺雷德比例低于未复发组,差异均有统计学意义(P<0.05)。见表4。
2.4 卵巢型EMs复发的多因素logistic回归分析 以复发为因变量,将年龄(原值输入)、病程(原值输入)、最大囊肿直径(原值输入)、r-AFS评分(原值输入)、r-AFS分期(Ⅰ~Ⅱ期=1、Ⅲ~Ⅳ=2)、疾病患侧(单侧=1、双侧=2)、保守手术(是=1、否=0)、术后妊娠(是=1、否=0)、术后应用诺雷德(是=1、否=0)等差异有统计学意义选项作为协变量纳入多因素logistic回归分析模型,结果显示,年龄,r-AFS评分、保守手术、术后妊娠、术后应用诺雷德均是卵巢型EMs复发的独立影响因素,年龄越小、r-AFS评分越高及行保守手术的卵巢型EMs患者复发风险越高,术后妊娠、术后应用诺雷德的卵巢型EMs患者复发风险则更低。见表5。

表4 复发组与无复发组一般资料比较
续表4
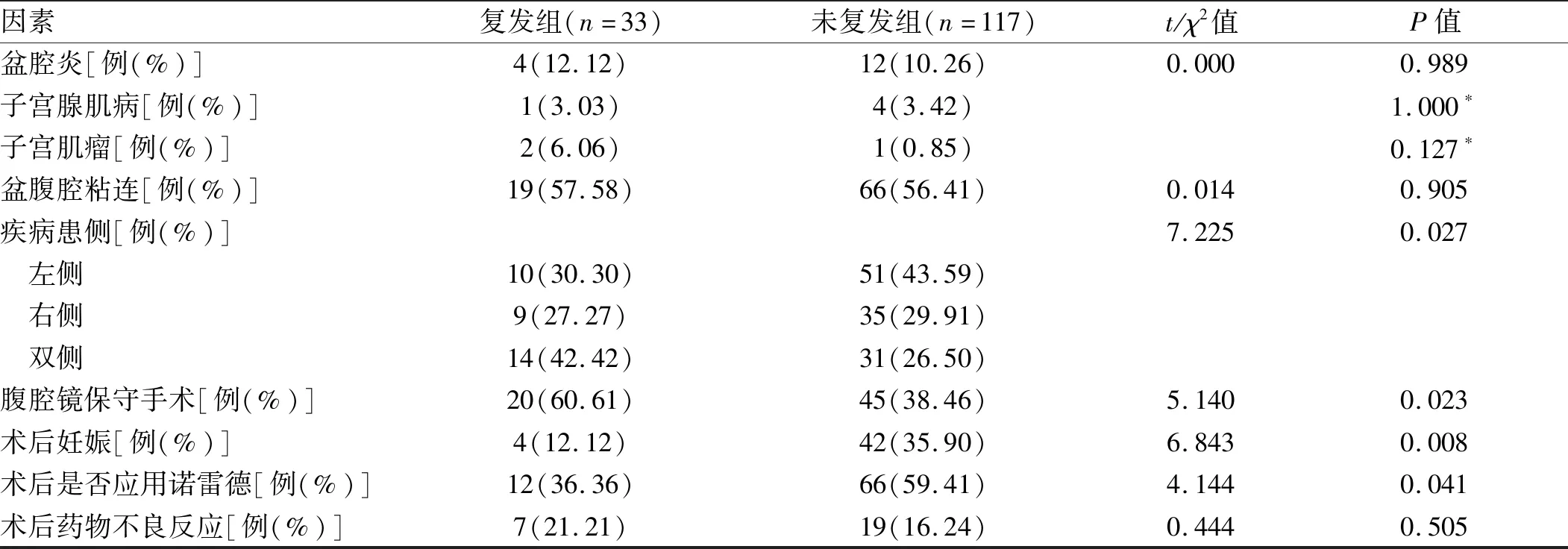
因素复发组(n=33)未复发组(n=117)t/χ2值P值盆腔炎[例(%)]4(12.12)12(10.26)0.0000.989子宫腺肌病[例(%)]1(3.03)4(3.42)1.000∗子宫肌瘤[例(%)]2(6.06)1(0.85)0.127∗盆腹腔粘连[例(%)]19(57.58)66(56.41)0.0140.905疾病患侧[例(%)]7.2250.027 左侧10(30.30)51(43.59) 右侧9(27.27)35(29.91) 双侧14(42.42)31(26.50)腹腔镜保守手术[例(%)]20(60.61)45(38.46)5.1400.023术后妊娠[例(%)]4(12.12)42(35.90)6.8430.008术后是否应用诺雷德[例(%)]12(36.36)66(59.41)4.1440.041术后药物不良反应[例(%)]7(21.21)19(16.24)0.4440.505
注:*采用Fisher确切概率法;BMI为体质量指数,FSH为促卵泡激素,LH为促黄体生成素,E2为雌二醇,Kupperman为更年期临床症状调查表,r-AFS为美国生育协会修订的修正的腹腔镜诊断内异症的评分系统

表5 卵巢型EMs复发的多因素logistic回归分析
3 讨论
卵巢型虽为良性妇科疾病,但其与恶性肿瘤疾病存在一定相似特征,均可表现出较强的增殖能力、远处转移能力,并具雌激素依赖性。基于理论角度,双侧卵巢切除是治疗卵巢型EMs的治愈性术式,但基于患者对生育功能、卵巢功能的保留需求,保守型手术仍是临床首选方案[9]。而因保守手术的姑息性切除特征,术后复发率极高,临床为改善这一现状,推荐保守手术后采用口服避孕药或GnRHa等药物治疗[10]。孕三烯酮作为19-去甲睾酮衍生物,可抗雌激素、孕激素、性腺效应,营造低激素环境,萎缩、吸收异位的子宫内膜组织,并具排卵抑制效应,是治疗EMs的有效药物之一[12]。而诺雷德则是GnRHa的一种,作为人工合成的十肽类化合物,其与垂体促性腺激素释放激素(gonadotropin releasing hormone GnRH)受体亲和力较强。临床研究[13]指出,持续、长期应用诺雷德可对垂体形成降调作用,减少垂体分泌FSH、LH,耗尽GnRH受体,通过对垂体的降调作用下调卵巢激素分泌,维持机体低雌激素环境,抑制异位内膜生长。
本研究结果显示,B组完全缓解率高于A组,这与姜涛等[14]的报道结论相似,皆提示腹腔镜术后联合诺雷德治疗卵巢型EMs疗效更佳。另本研究还显示两组不良反应发生率比较差异无统计学意义,但张庆霞等[15]报道重度EMs患者术后诺雷德不良反应发生率显著低于联合孕三烯酮患者,与本研究存在差异,分析或因其研究中诺雷德使用周期仅为3个月有关。但基于本研究结论,仍在一定程度上提示腹腔镜术后接受6个周期的诺雷德治疗与孕三烯酮的安全性相当。而在复发率上,本研究显示B组累积无复发生存率显著高于A组,提示腹腔镜术后应用诺雷德,较应用孕三烯酮具更低的复发风险,这与相关报道[14]结论相似。但腹腔镜术后应用诺雷德复发率仍高达15.38%,因此,探究此类患者术后复发的影响因素,识别复发高危风险,为临床早期防治提供依据十分必要。而当前研究EMs复发因素的临床报道虽并不少见,但受变量、样本量差异等因素影响,不同报道结论也不尽相同。
本研究结果显示,年龄是经腹腔镜术后应用孕三烯酮或诺雷德治疗卵巢型子EMs复发的独立影响因素,且年龄越小,复发风险越高。王凤英等[16]亦有类似报道,认为年龄≤35岁是卵巢EMs囊肿剥除术后复发的独立危险因素,分析或因年龄更小的卵巢EMs囊肿剥除术患者机体内雌激素水平更高所致。本研究结果还显示,r-AFS评分、保守手术是经腹腔镜术后应用孕三烯酮或诺雷德治疗卵巢型子EMs复发的独立危险因素。这与权丽丽等[17]的报道结论相似,究其原因,r-AFS评分是对患者病灶位置、大小、粘连程度的综合评价,r-AFS分值与病情严重程度正相关,因此分值越高,复发风险愈高;而保守手术之所以是复发的危险因素,分析或与保守手术术后残留异位内膜组织更多有关,而非保守手术对病灶的切除更彻底、术后残留异位内膜组织更少,因此,保守切除术具更高的复发风险。
本研究结果提示,术后妊娠、术后应用诺雷德是卵巢型EMs腹腔镜术后复发的保护因素,即此类患者具更低的复发风险。袁明[18]亦报道,术后妊娠是卵巢EMs患者复发的保护因素。究其原因,术后妊娠可直接使卵巢不排卵、停经,并发生子宫内膜蜕膜样改变,从而引起异位的病灶坏死,降低复发风险;再者,妊娠后经阴道分娩还可扩大宫颈口,减少输卵管子宫内膜运动,同样可在一定程度上降低复发风险。但袁明报道术后应用诺雷德并非卵巢型EMs患者术后复发的影响因素,且不良反应较多,与本研究结论存在一定差异,分析或与其报道中未纳入r-AFS分期Ⅰ~Ⅱ期患者有关。谢莹等[19]等报道,较单纯腹腔镜术,联合诺雷德可改善重度EMs患者术后1年复发率,但在降低轻度EMs患者复发率上无显著优势。基于上述研究差异性,作者认为腹腔镜术后联合诺雷德对卵巢型EMs复发的影响需排除分期、治疗方案、随访时间等混杂因素影响后进一步补充及完善。
综上所述,腹腔镜术后应用诺雷德治疗卵巢型EMs疗效较应用孕三烯酮疗效更佳,复发率更低,且复发或与年龄、r-AFS评分、保守手术、术后妊娠、术后应用诺雷德等因素密切相关。但本研究也存在一定局限性,如样本量少,可能存在一定统计学核算误差;加之本文为回顾性分析,影响因素采集上尚有欠缺,有待进一步深入研究。
