雄激素受体αA基因甲基化和tHcy对颅内动脉狭窄的影响
2020-04-06黄毓娟万里杨志宏沈舒文
黄毓娟,万里,杨志宏,沈舒文,4
1.陕西中医药大学基础医学院,陕西咸阳712046;2.西安大兴医院神经内科,陕西西安710016;3.陕西中医药大学附属医院脑病科,陕西咸阳712046;4.陕西中医药大学中医系,陕西咸阳712046
前言
缺血性脑血管疾病发生发展的基础是动脉硬化,动脉硬化是造成心脑血管疾病和死亡的重要因素。大量结果表明,雄激素受体αA(Androgen reciptor-αA,AR-αA)基因表达下调与动脉粥样硬化患者粥样斑块的发生相关,本课题组进一步研究表明,AR-αA基因启动子区CpG 岛存在的高甲基化可能使AR 基因表达沉默,从而致脑梗死发病,同时血液总同型半胱氨酸(total Homocysteinet, tHcy)的增高可以调控AR-αA基因启动子区甲基化强度[1-2]。
国内研究表明,颅内动脉狭窄是中国人缺血性脑血管事件发生的主要原因,而国外相关研究认为,引起狭窄的斑块性质可能是决定缺血性脑卒中反复发作和进展的重要因素。由于斑块的成分不同,导致其在磁共振成像下的成像过程中,出现不同信号的斑块,为继续探究基因启动子区甲基化与缺血性脑卒中之间的关系,因此决定利用1.5 T高分辨率磁共振成像(High-Resolution Magnetic Resonance Ⅰmaging,HR MRⅠ)作为检查手段,探讨颅内动脉大脑中动脉M1段斑块性质与基因启动子区甲基化、tHcy 之间的关系,是否存在AR-αA基因启动子区甲基化调控导致血管平滑肌细胞(Vascular Smooth Muscle Cell,VSMC)的过度增殖与迁移,这种变化是否导致血管内皮损伤、斑块的形成,导致颅内动脉狭窄,VSMC的过度增殖与迁移是否可以导致斑块的继发性改变,理论阐明易损斑块的分子生物学形成机制。本研究在HR MRⅠ颅内成像基础上,用临床病例进行研究,并讨论AR-αA基因启动子区甲基化与颅内动脉不同信号斑块的内在生物学关系。
1 对象与方法
1.1 对象
试验组:纳入标准:所有患者均为急性缺血脑卒中,年龄≥18 岁,发病时间≤7 d。排除标准:心源性脑梗死、颈部血管及双下肢血管狭窄率>50%、无症状及体征的脑梗死、不能完成核磁共振检查者,一般情况登记。辅助检查:心脏结构及功能评价,包括心脏彩超、心电图、颈部血管彩超、双下肢血管彩超。
对照组:纳入标准:非急性腔隙性脑梗死,时间≥7 d,年龄≥18岁。排除标准和实验组相同。
1.2 颅脑HR MRⅠ的大脑中动脉(Middle Cerebral Artery,MCA)斑块检查
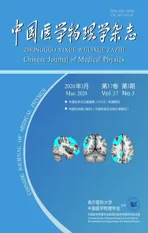
影像采集:采用Philips(荷兰)1.5 T磁共振(MR)系统,切换率50 mT/ms,8通道扫描线圈。参与实验的患者均进行常规头颅MR扫描,扫描的序列及参数:横截面T1W1(TR 400 ms,TE 15 ms,T11 150 ms)、T2W1(TR 4 000 ms,TE 120 ms)、T2-FLAⅠR(TR 9 000 ms,TE 120 ms,T12 600 ms)、DWⅠ(b=1 000 s/mm2,TR 3 000 ms,TE 87 ms),及矢状面T2W1(TR 3 000 ms,TE 90 ms),厚度5 mm,层间距1.5 mm,FOV 240 mm×240 mm,矩阵320×256,使用造影剂钆喷酸葡胺,剂量为0.1 mmol/kg进行磁共振血管造影(Magnetic Resonance Angiography,MRA)及T1VⅠSTA HR MRⅠ;1.5T MR进行头颅HR MRⅠ检查颅内动脉粥样硬化斑块至狭窄处,明确不同信号强度的斑块,以周围肌肉组织信号作为对比,实验组分为高信号或混杂信号组、等信号或低信号组。
图像分析标准:HR MRⅠ评估脑动脉粥样硬化斑块的易损性具有较高的可信度[3]。目前认为HR MRⅠ检查中T1WⅠ序列,参考斑块病理学变化可以更好地解释HR MRⅠ图像的意义。高低信号主要是相对于周围肌肉组织而言,如纤维帽在T1、T2序列呈高信号,高于周围肌肉信号2倍以上[4];斑块内出血在T1加权项呈高信号,呈高亮状态,与周围肌肉组织形成鲜明对比[5];脂质核心在T1、T1加权和T2、T2*呈现高信号[6-7];钙化在T1、T2序列呈低信号,信号比肌肉暗[8]。由2位高年资影像医师双盲分析各序列斑块的分布及信号特点,进行分组。
1.3 标本的采集
抽取参与者清晨空腹肘静脉血4 mL,2 mL 血用于检测血tHcy 浓度;2 mL 血用来提取基因组DNA,检测甲基化程度,-80 ℃冰箱保存备用。
1.4 AR-αA基因启动子区甲基化状态的检测
提取DNA 及其甲基化修饰、纯化与吸收:用DNA Methylation TM Kit试剂盒(购自美国ZYMO 公司),严格按说明书进行操作;取5 μL M-Dilution Buffer添加到14 μL 的DNA 标本中,用无菌双蒸水调整使总容量为50 μL,轻弹混合后室温在37 ℃水浴箱孵育15 min,使DNA变性。合格标本中加入CT试剂100 μL混合。避光下,50 ℃孵育14 h;4 ℃孵育10 min;取400 μL M-Binding Buffer 加入ⅠC 管中,ⅠC 管放入已提供的集合管中。上述标本入ⅠC 管中,摇床混匀后进行全速离心,时间为30 s,弃去上清液。取MWash Buffer 100 μL置入至ⅠC管中,全速离心30 s。取200 μL M-Desulphonation Buffer 加入ⅠC 管中,室温静置15~20 min 孵育,全速离心,时间为30 s。取MWash Buffer加入ⅠC管中200 μL,行全速离心,时间为30 s,再取M-Wash Buffer 200 μL,将其加入至ⅠC管中进行全速离心,离心时间为30 s。之后置入ⅠC 管于微离心管中,取M-Elution Buffer 10 μL 直接悬滴入ⅠC管中,全速离心,时间为30 s,之后进行洗提。
甲基化特异性聚合酶链反应(Methylation Specific Polymerase Chain Reaction,MSP)引物设计:引物由上海英俊生物技术有限公司合成,引物的合成批号分别为:20180512、20180515、20180516,ARαA基因特异性聚合酶链反应(Polymerase Chain Reaction,PCR)引物如表1所示。

表1 AR-αA基因PCR引物Tab.1 PCR primers of androgen reciptor-αA(AR-αA)gene
AR-αA基因PCR 方法及步骤:反应体系:含修饰DNA模板2 μL,包括Taq 酶0.1 U/μL,dNTP 500 μmol/L,20 mmol/L HCl,pH 8.3;100 mmol/L KCl,3 mmol/L MgCl2,引物各0.3 μL,加无菌双蒸水,总体积共12.5 μL。94 ℃5 min,65 ℃30 s,72 ℃1 min,20 个循环,72 ℃7 min,结束反应。得到PCR产物模板。AR-PN、AR-PM、AR-PU按上述反应体系扩增。在1%的琼脂糖凝胶上,取PCR产物进行电泳,同时对其进行观察并拍照存档。检测方法:荧光生化法检测血tHcy水平。
1.5 统计学方法
采用SPSS 21.0 统计软件,计数资料用χ2检验,年龄进行Kruskal-Wallis 检验,计量资料组间用t检验,偏态分布计量资料组间均数比较采用秩和检验,相关性分析采用Spearman 等级相关分析,P<0.05 为差异有统计学意义。
2 结果
2.1 临床资料
在tHcy 患者中,高信号或混杂信号斑块患者40例(95.2%),明显多于等信号或低信号患者20 例(74.1%),也显著高于对照组18例(60.0%),差异具有统计学意义(χ2=6.49,P=0.023)。其他各项临床资料比较,差异均无统计学意义(P>0.05,表2)。

表2 受试者的临床资料比较Tab.2 Comparison of clinical information among 3 groups of subjects
2.2 影像学结果
在观察69 例患者的双侧大脑中动脉M1段可见斑块101处;其中42例患者高信号或混杂信号42处,27 例患者中等信号或低信号59 处。典型病例如图1~图3所示。
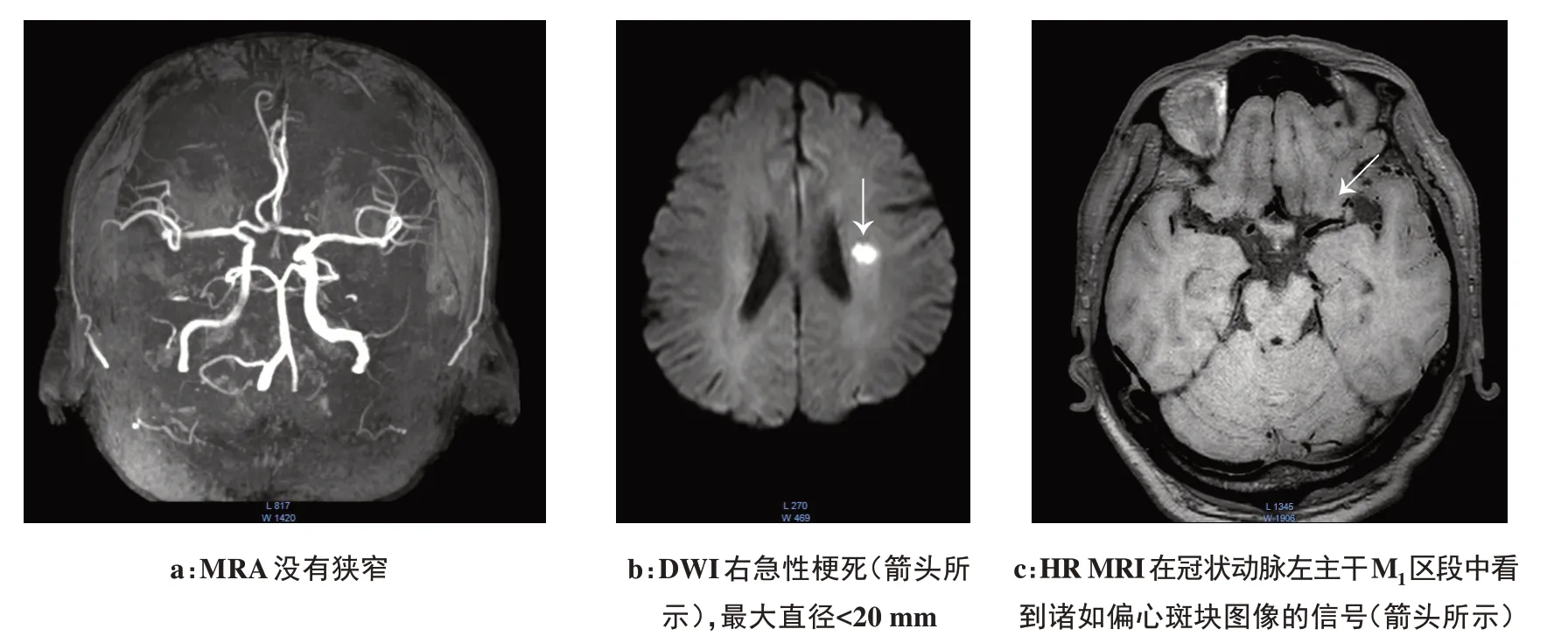
图1 70岁男性的中动脉供血区脑梗死左脑斑块Fig.1 Left cerebral plaque in a 70-year-old male patient with cerebral infarction in the blood supply area of the middle cerebral artery
2.3 MSP结果
通过电流得到甲基化结果,电泳产物大小为130 bp。高信号或混杂信号组血液AR-αA基因启动子甲基化水平高于其他两组;而等信号或低信号组甲基化水平高于对照组(图4)。
图2 患有短暂性脑缺血的60岁男性患者Fig.2 60-year-old male patient with transient ischemic attack

图3 63岁男性的脑梗塞-RMCA供血区脑梗死Fig.3 63-year-old male patient with cerebral infarction in RMCA blood supply area

图4 MSP法检测AR-αA基因启动子甲基化电泳图Fig.4 Electropherogram of the methylation of AR-αA gene promoter detected by methylation specific polymerase chain reaction
2.4 不同性质斑块的甲基化率比较
甲基化检测表明,等信号或低信号组标本中有19 例发生了甲基化,占比70.4%;高信号或混杂信号组标本中发生甲基化者33 例,占比为78.6%;正常对照组发生甲基化者8 例,占比26.6%。3 组对比差异有显著性意义(P<0.001,表3)。
2.5 甲基化与tHcy水平的关系
按甲基化程度不同将入组患者分为3 组,tHcy(μmol/L)在其中的水平差异较大,即完全甲基化组43 例,tHcy 水平为(13.2±4.7)μmol/L、半甲基化组17例,tHcy 水平为(19.8±4.2)μmol/L,均高于非甲基化组39例,tHcy水平为(3.2±4.7)μmol/L,组间对比有统计学意义(P<0.05)。采用Spearman 等级相关分析法对AR-αA基因甲基化程度与tHcy 水平进行分析,二者存在不完全相关且为正相关(r=0.549,P<0.05),根据双侧显著性值小于0.01,可见甲基化程度与tHcy水平存在显著相关关系,提示高tHcy 与AR-αA基因启动子区的甲基化有关系。
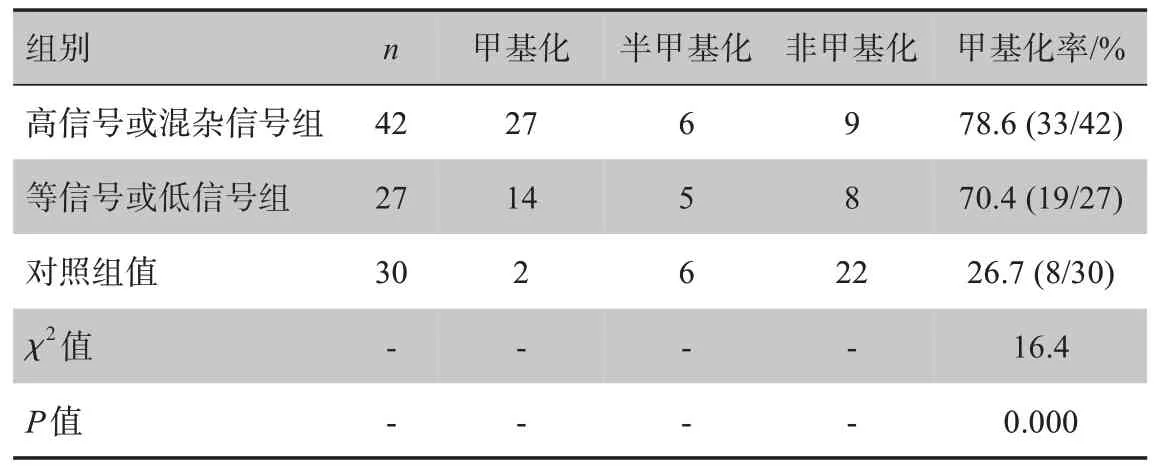
表3 3组样本甲基化率的比较(例)Tab.3 Comparison of methylation rates in 3 groups(cases)
2.6 甲基化与颅内动脉狭窄率的关系
3 组与管腔狭窄率比较有显著的统计学意义(P<0.05),说明管腔狭窄与AR-αA基因启动子甲基化程度不同(表4)。

表4 管腔狭窄率比较(例)Tab.4 Comparison of rate of arterial stenosis(cases)
3 讨论
在血管阻塞性疾病中病理解剖可以显示平滑肌细胞的过度增生,多项体内和体外实验中发现雄激素可以抑制VSMC 的增殖和新的血管内膜出现[9]。中国成年人颅内动脉粥样斑块普遍存在,MCA 和后循环即椎动脉(Vertebral Artery, VA)、基底动脉(Basilar Artery,BA)板块形态性质不同,斑块新生毛细血管、斑块出血是MCA、BA 及VA 斑块的普遍特点,脂质核心是MCA 的特点,钙化多出现在颅内动脉后循环[10]。颅内动脉斑块的解剖和病理类型研究发现,颅内动脉斑块在人群中普遍存在,MCA、VA、BA 的管壁病变不同,MCA 主要为偏心斑块,与VA、BA进行比较存在差异[11]。
实验结果从生物学角度显示了tHcy 对AR-αA基因启动子的甲基化的调控作用;AR-αA基因启动子的甲基化受到体内tHcy 的调控,tHcy 调控AR-αA基因启动子的甲基化可能是通过氧化应激作用[12]。有研究表明,高tHcy时,tHcy长期作用于内皮细胞使内皮型一氧化氮合成酶(eNOS)受损,eNOS 基因表达减少,会加速NO 降解,使得保护机制丧失,其中心致病机制可能主要与tHcy 引起的游离自由基生成增多及氧化应激有关,内皮型一氧化氮合酶基因启动子序列DNA 甲基化程度随tHcy 浓度的升高而增加[13]。本研究发现缺血性脑卒中患者的血清tHcy 水平显著高于正常人,且同AR-αA基因启动子的甲基化程度呈正相关,这可能是易损斑块形成的重要环节。
斑块性质不同,AR-αA基因启动子的甲基化程度不同,而且有显著的差异性且呈正相关性;AR-αA基因启动子的高甲基化可使AR-αA基因沉默,雄激素激活AR-αA后,可以减慢由于血管壁损伤引起VSMC的增殖[14]。
环境因素导致血管内皮损伤,高血压、高血脂及tHcy 等引起的血流动力学改变,造成动脉血管内皮细胞的损伤,内皮损伤在修复过程中引起动脉管壁增厚变硬,有研究认为,血流动力学原因会加大颅内最大动脉管壁前壁侧的压力,导致大脑中动脉容易发生斑块粥样硬化斑块[15-16],而基因水平上因AR-αA基因沉默会使血管内皮损伤处的VSMC 过度增殖而形成斑块,再出现斑块继发性改变。不稳定斑块与AR-αA基因启动子的甲基化程度、tHcy 均呈正相关;有关细胞实验证实,AR-αA均有抑制VSMC 增殖和迁移的能力。斑块信号强度升高与吸烟史、高血压病史和糖尿病史有相关的趋势,但无明显统计学差异,可能统计样本不够大;高tHcy 患者与斑块信号强度及甲基化程度呈密切正相关且有统计学差异。因此认为,外在环境导致血管内皮损伤,在血管内皮修复过程中由于AR-αA基因启动子甲基化,导致平滑肌细胞的异常增殖,使斑块的不稳定性增加。
颅内动脉狭窄是中国人缺血性脑血管病发病的一个主要原因[17-18],本研究利用HR MRⅠ技术和nMSP 的方法揭示AR-αA基因启动子甲基化与颅内动脉狭窄的关系,表明易损斑块导致的狭窄是由于机体环境和表观遗传学的共同结果,防治颅内血管病变表观遗传学是否可以提供有益的临床预测效果还需临床循证医学的支持,以及对颅内斑块的深入认识还需从病理学上认识斑块,以更好地解释影像图像,结合分子生物学更好地认识和判定斑块的形态和风险,本次初步了解易损斑块的形成是多种因素合力的结果。目前国际上已开始7T MR 超导系统对斑块形态学的研究,同时尝试对颅内后循环血管壁情况的探查,期待在未来,高分辨率能对斑块的认识更加深入,更好地指导临床与疾病的研究[19-20]。同时,本次研究对象皆为咸阳地区人口,结果显示咸阳地区颅内动脉狭窄的患者中,87%的患者患有高tHcy 血症,体检的过程中发现60%健康人群患有tHcy 血症,远高于其他地区30%的发病率,颅内动脉狭窄不同的原因可能是地域不同,这还有待进一步调查。同时本研究对大脑中动脉、椎动脉、基底动脉的斑块形态和性质与AR-αA基因甲基化和tHcy 的相关性没有研究,后续研究还需要进一步的研究。