钾盐对超临界水中水气转换反应的影响
2020-04-06丁启忠陆柒安
丁启忠, 张 军, 赵 亮, 陆柒安
(东南大学 能源热转换及其过程测控教育部重点实验室, 南京 210096)
近年来,随着世界经济发展加快,全球能源需求迅速增长,使得化石能源日益枯竭;同时,大量使用化石能源还造成了严重的全球性环境问题。面对日益严重的能源与环境问题,世界各国都在积极寻找化石能源的替代能源,使得可再生能源越来越受到重视。
生物质超临界水气化制氢技术是最近发展起来的新型生物质气化技术。该技术可直接利用湿生物质,不需要高能耗的干燥过程,具有气化率高、无污染等特点,因此越来越受到人们的重视[1]。

为提高气化率,通常采用催化的方法。已证实的有效催化剂主要有铁系高温转换催化剂、铜锌系低温转换催化剂、钴钼系耐硫宽温转换催化剂以及其他无机化合物催化剂[8-10],
其他无机化合物催化剂主要包括碱金属催化剂、碱土金属催化剂和过渡金属催化剂等,其中碱金属催化剂的催化活性最好。
生物质中也含有K、Na、Ca、Mg等碱性金属活性成分,了解碱金属催化剂对水气转换的影响规律及催化机理,有助于全面认识生物质超临界水气化转换规律、机理、路径等问题,是解决这些问题的关键之一。部分学者提出了碱金属催化剂的几种催化机理[10-11],但这些反应机理均是在亚临界水条件下,而且目前对亚临界水条件下该反应的机理还没有明确的结论[12]。
笔者以生物质中主要的钾盐为对象,对超临界水条件下钾盐对水气转换影响的规律进行了实验研究,并对其作用机理进行了讨论。
1 实验部分
1.1 实验装置
实验装置见图1。

1—储料罐;2—储液缸;3—高压柱塞泵;4—泄流阀;5—前置冷却器;6—冷却水;7—反应区;8—陶瓷管;9—电炉丝;10—K形热电偶;11—隔热保温材料;12—后置冷却器;13—压力表;14—第一级过滤器(50 μm);15—第二级过滤器(5 μm);16—背压阀;17—气体收集器;18—气液分离器。
图1 连续式超临界水反应系统示意图
该实验系统主要由四部分组成,分别是加料装置、反应器、冷却管路和样品采集系统。反应器由长600 mm、直径16 mm、壁厚4.5 mm的不锈钢管制成,其材质为316 L;反应器温度由布置在反应器中心外壁面的一个K形热电偶进行控制,系统的设计温度为650 ℃;反应系统的压力通过柱塞泵及背压阀来控制,系统的设计压力为40 MPa;在背压阀前安装有两级过滤器,以保证背压阀的安全。
反应器前后各有一套管式冷却装置,前面的冷却装置保护柱塞泵的安全,后面的冷却装置装在背压阀前,以方便反应产物的排出。反应产物经冷却后依次流经两级高精度过滤器过滤后,从背压阀排出,然后进入气液分离器,气相产物从上方排出,反应残液由下方排出。利用气袋对气体产物进行收集,并采用皂膜流量计对气体流量进行测量。
由于实验系统规模小,CO能否准确地加入是一个难点。采用溶解的方法,即通过高压将CO溶解在水中,然后将溶解有CO的水通过柱塞泵送入反应器。CO溶解时储液罐中水面上方的CO分压控制在10 MPa,同时保持罐内温度为20 ℃,此时CO可大量溶于水,并在3 h后达到溶解平衡。根据实验前多次标定后得到的CO气体与水的物质的量比n(CO)/n(H2O)为0.000 6。
1.2 钾盐的选择
生物质中的K在水中易于析出,其在水溶液中可与多种阴离子结合。笔者选取了KHCO3、K2CO3和KOH三种钾盐作为研究对象,系统研究不同工艺参数(反应温度、压力、停留时间)条件下,单一钾盐以及混合钾盐(KHCO3+K2CO3+KOH)对超临界水中水气转换过程的影响程度及规律。
实验中所用的原料为:φ(CO)=99.99%,KOH、KHCO3、K2CO3为分析纯。
1.3 实验流程
首先用去离子水配制C(K+)=0.001 5 mol/L的溶液,其中配制混合钾盐时各钾盐中K+的物质的量比n(K+)KHCO3∶n(K+)K2CO3∶n(K+)KOH为1∶1∶1。将配好的溶液加入储液罐进行混合,将CO通入完成CO的溶解。
实验过程中先采用去离子水加热系统,待达到设定的温度和压力时,切换至高压储液缸,将含有CO气体和钾盐的溶液输入反应系统。待反应器的出气量达到基本稳定后,借助分液漏斗进行气液分离并开始收集气体产物。
气体经收集后利用福立GC9790plus型气相色谱仪进行定性定量分析。分析采用热导检测器(TCD),以高纯He作为载气。色谱柱为Porapak Q、分子筛柱串联;六通阀进样;检测器温度为250 ℃;所用标准混合气体由南京特种气体厂有限公司提供。
在进行变压力和变温度实验中,通过调节反应器入口的溶液流量来保证反应时间一致。
1.4 实验条件
在反应温度为450~600 ℃、反应压力为25 MPa、反应停留时间为6 s、n(CO)/n(H2O)=0.000 6、C(K+)=0.001 5 mol/L条件下进行实验。
2 实验结果与分析
2.1 实验结果处理
对气体产物的气相色谱分析表明:超临界水中水气转换的气体产物为H2、CO和CO2,未检测到CH4气体及C2-C3烃类有机气体。
从水气转换反应来看,气体产物中H2和CO2的体积比应该为1∶1,但实际情况并非如此。在实验条件的区域内,大多情况下H2和CO2的体积比>1(见图2)。
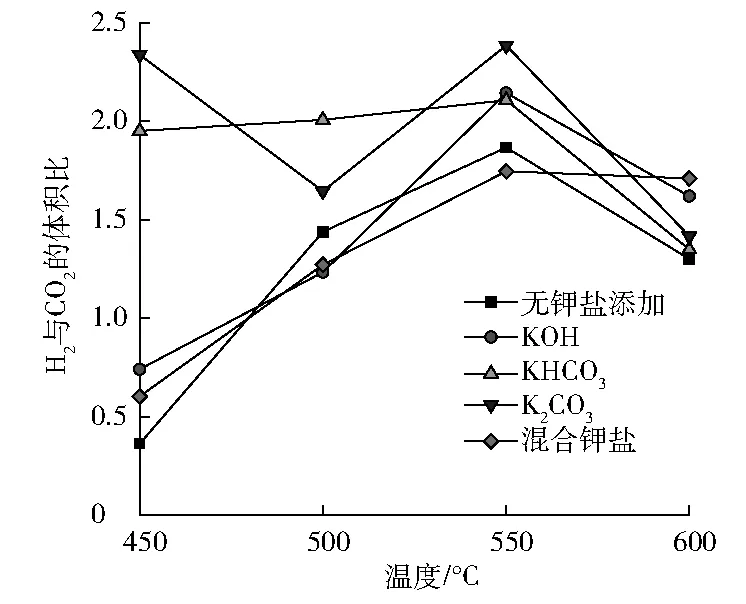
图2 不同温度时H2和CO2的体积比
由于CO2在水中的溶解度较大,尤其是在碱性溶液中,而H2在水中的溶解度非常小,导致大部分实验条件下H2和CO2的体积比>1[13]。KHCO3可能会受热分解生成K2CO3和CO2。在超临界水条件下无机盐的溶解度会减小很多,可能会有部分无机盐在反应器中形成沉淀,进而影响液相产物中CO2的含量[14]。在低温时可能生成其他中间产物(如草酸等)[15],生成的H2也可能进一步发生反应生成CH4、CH3OH、HCHO等,这些都会导致部分实验条件下H2和CO2的体积比<1;可能发生的反应[16]为:
(1)

(2)

(3)

(4)

(5)
同时水气转换反应的中间产物HCOOH也会和H2进一步发生反应[17]:

(6)

(7)
在反应温度为450 ℃、反应压力为25 MPa、反应停留时间为6 s、n(CO)/n(H2O)=0.000 6条件下,对液相产物的检测发现有少量甲醇和微量甲醛的存在,没有检测到其他中间产物,而CH4的含量几乎可以忽略,这表明发生了反应(4)~(7)。
无钾盐添加时,除水气转换反应外,还会发生反应(4)~(7)生成甲醇和甲醛,反应过程消耗H2,导致H2含量低于CO2的含量,出现H2和CO2体积比<1的情况;而添加KOH及混和钾盐时,由于在超临界水中OH-被中和[15],也会发生消耗H2的反应(4)~(7),此时H2和CO2的体积比<1。
KHCO3和K2CO3对反应(4)~(7)存在抑制作用[18],而对水气转换反应有促进作用,此时CO主要参与水气转换反应,因此添加KHCO3和K2CO3条件下没有出现H2和CO2体积比<1的情况。
综上所述,CO2含量的影响因素比较复杂,因此H2和CO2体积比随着温度以及钾盐不同的变化并没有明显的规律[13]。
采用H2的产率进行转化效果的评价,其计算公式为:
(8)
式中:YH2为H2产率,即每摩尔CO生成的H2的物质的量,mol·mol-1;JCO,0为CO的物质的量流量,mol/min;JH2为H2的物质的量流量,mol/min;qV,gas为气体产物的总体积流量,mL/min;qV,H2O为水的体积流量,mL/min;φ(H2)为气体产物中H2的体积分数,%。
2.2 不同温度时不同钾盐的影响
图3为实验条件下不同温度时不同钾盐对H2产率的影响。
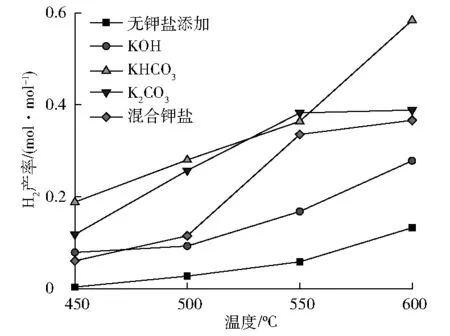
图3 不同温度时不同钾盐对H2产率的影响
由图3可以看出,在没有催化剂下由于温度的限制,H2的转化效率不高。
钾盐的添加对H2的生成有显著的影响。在所有的温度范围内,钾盐均提高了H2的产量,表明这些钾盐对水气转换反应具有催化作用。
从图3中亦可看出,所研究的三种钾盐的催化效果存在差别:KHCO3展现出了明显高于其他两种钾盐的催化效果(特别是在高温下),而KOH的催化效果最差,这是由于阴离子的种类会影响到CO的转化路径。
钾盐的影响与温度有关,在所研究的温度范围内(450~600 ℃),随温度的增加钾盐的催化作用加强。温度的影响也随不同的钾盐而改变,在KOH以及KHCO3作用下,H2产率的变化规律相同,均随温度的增加而增加;在K2CO3作用下H2产率虽随温度的增加而增加,但在高于550 ℃后增速变缓。
混合钾盐的实验结果也列于图3,可以看到混合钾盐作用下H2产率变化与单一钾盐的结果之间展示出较为复杂的关系:低于500 ℃时,混合钾盐作用下产生的气体中H2产率比各单一钾盐的均低;高于550 ℃时,混合钾盐作用下产生的气体中H2产率比KOH作用下的高。实际生物质在高湿状态下K+会与多种阴离子结合,且高湿生物质液体中K+浓度以及阴离子的浓度、种类随生物质来源而发生变化,因此这一结果反映出实际生物质中K+浓度对水气转换的影响将十分复杂。
2.3 不同压力时不同钾盐的影响
图4为实验条件下不同压力时不同钾盐对H2产率的影响。反应压力的改变会对超临界水的热力学性质(介电常数、离子积、密度等)产生影响;当反应压力升高时,超临界水的介电常数增大,同时离子积、密度明显增大,有利于离子反应的进行,从而有利于H2的生成[19]。
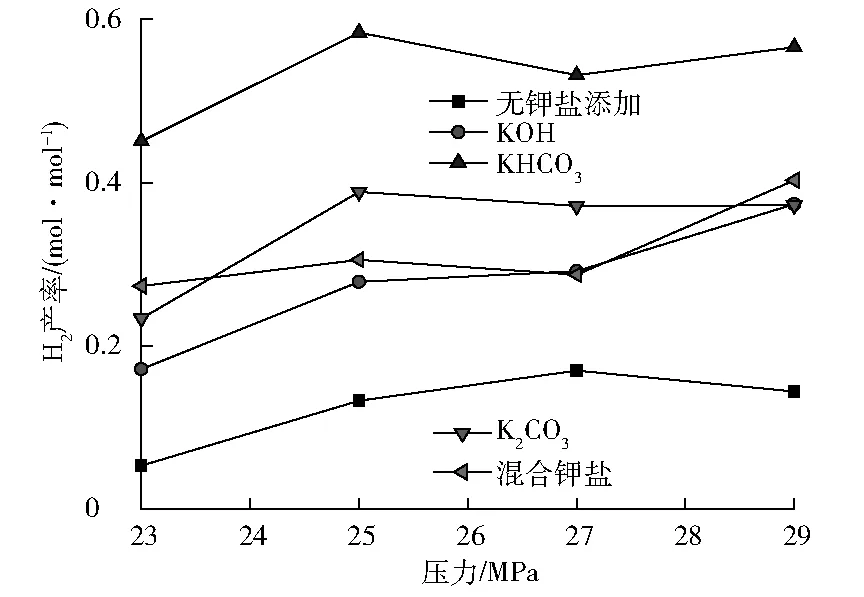
图4 不同压力时不同钾盐对H2产率的影响
由图4可以看出:压力的影响没有温度的影响明显。压力影响大致可分为3个区段。在23~25 MPa,随压力的增加,H2产率出现明显增加;在25~27 MPa,压力对H2的生成影响不大;在27~29 MPa,无添加钾盐时压力的增加对H2生成基本没有影响,添加KHCO3和K2CO3时压力增加对H2生成的影响也很小,但添加KOH及混合钾盐后H2的产率又出现明显增加。
从图4还可以看出:不同钾盐的影响也是不同的,其程度从大到小依次为:KHCO3、K2CO3、混合钾盐、KOH。KHCO3与其他两种钾盐对H2生成影响能力的差异随压力而有所变化,在低压下差异更为明显。
2.4 不同停留时间时不同钾盐的影响
图5为实验条件下不同停留时间时不同钾盐对H2产率的影响。由图5可以看出,随着停留时间的变化,H2产率总体上表现出增加的趋势。

图5 不同停留时间时不同钾盐对H2产率的影响
停留时间对H2产率的影响与钾盐成分有关。无添加钾盐时,5 s之后停留时间才显示出一定影响。对KHCO3,4 s之前停留时间的增加没有什么影响,而在4~5 s,随停留时间增加H2产率快速增加;之后,随停留时间增加H2产率增加速度减缓。K2CO3下停留时间对H2产率的影响也主要表现在4~5 s的时间段,但KOH下主要表现在小于4 s时间段,混合钾盐的表现则与KOH相似。与无添加钾盐时的结果对比可以看到,钾盐使停留时间的影响提前,表明催化剂使水气转化反应速度加快。
2.5 不同浓度时K+浓度的影响
图6为实验条件下不同K+浓度对H2产率的影响。由图6可以看出:KHCO3仍然表现出最好的催化效果,其他三种成分的催化效果则与K+浓度有关,总体上在C(K+)=0.001 0 mol/L之前混合钾盐的催化效果最差,而在这之后,KOH的催化效果最差。
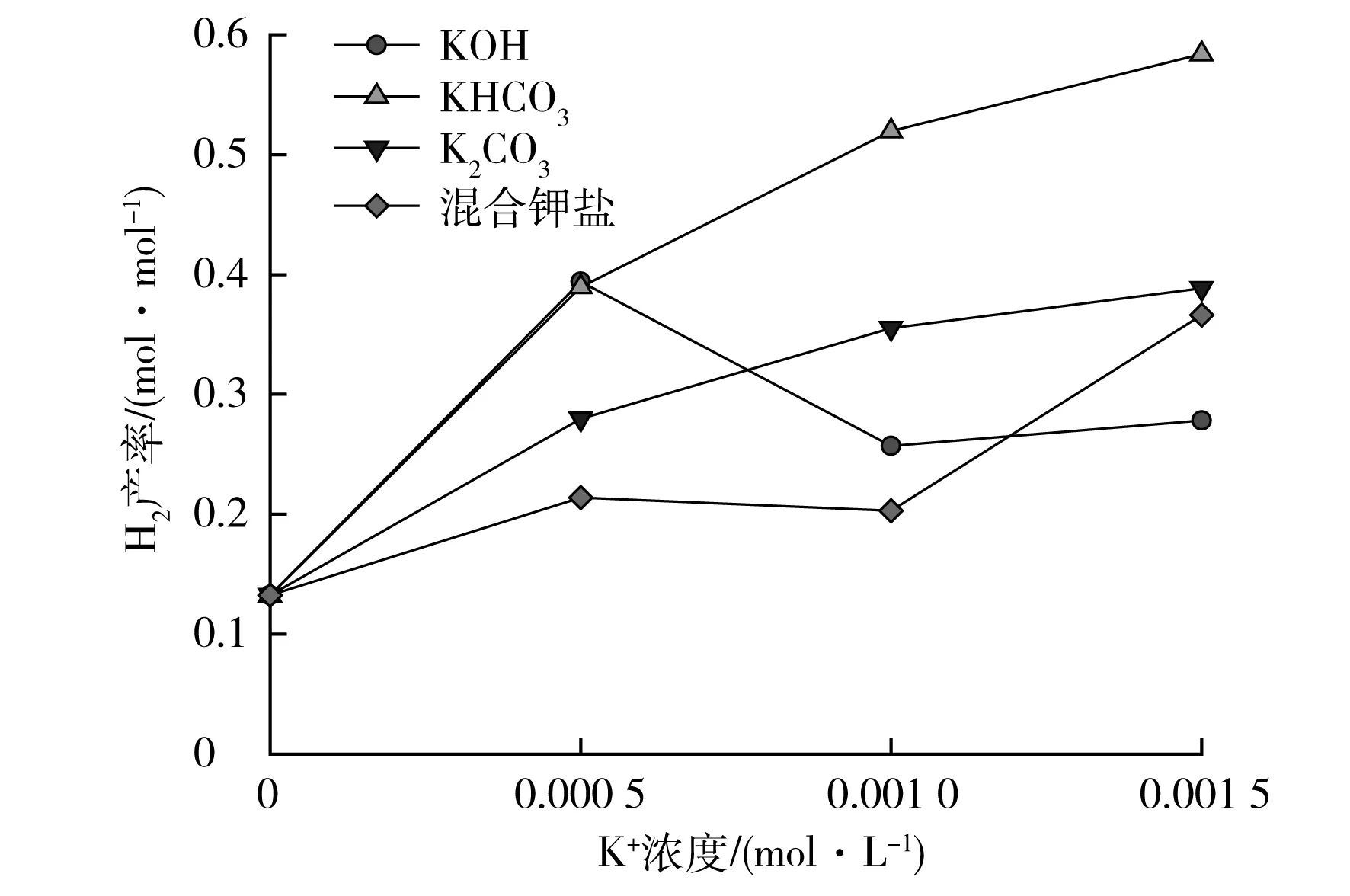
图6 不同K+浓度的钾盐对H2产率的影响
由图6可以看出:H2产率与K+浓度之间并未完全表现出单调增加的关系,这取决于添加的钾盐成分。对KHCO3,其作用下H2产率随K+浓度单调增加,但随K+浓度增加,H2产率增加的速度减慢;K2CO3表现出了与KHCO3相似的变化规律;在中低浓度时混合钾盐对H2产率的影响不明显,而在高浓度时H2产率随浓度增加而增加;例外的是KOH,随K+浓度增加,H2产率先快速增加,然后减少,在高K+浓度下H2产率的变化很缓慢。由这些结果可以预计,生物质中K+浓度对生物质超临界水气化转化过程的影响将十分复杂,实际生物质的实验结果证实了这种复杂性[3,20]。
3 作用机理
从上述实验结果可以看到,在超临界水条件下三种钾盐对水气转换的催化能力不同,总体上KHCO3的催化能力最强,其次是K2CO3,而碱性强的KOH的催化能力最弱。
对无催化剂的水气转换,其反应路径通常认为CO和水首先反应生成甲酸作为中间产物,甲酸进一步发生脱羧反应生成CO2和H2[6]:
(9)
ONSAGER O T等[11]认为,钾盐对水气转换的催化作用主要是通过甲酸盐作为中间产物进行的,其反应路径如下:

(10)

(11)

(12)

(13)
但按上述反应路径,显然无法解释三种碱性钾盐催化能力的区别。
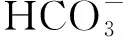
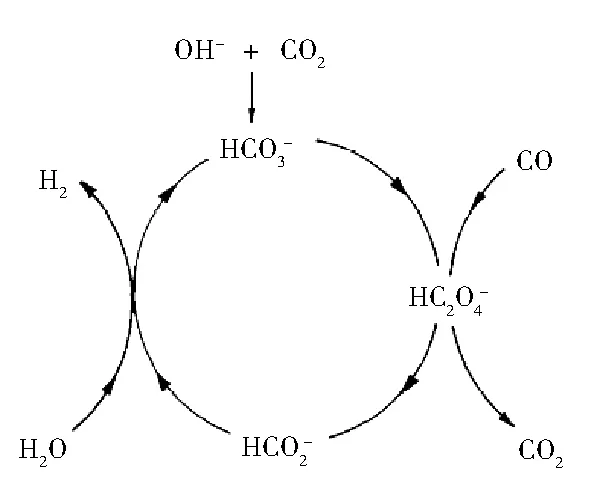
图7 钾盐对水气转换作用的影响机理
K2CO3也会与CO2反应形成KHCO3:

(14)
KHCO3的分解温度在120 ℃左右,虽然本实验过程中温度远高于此值,但系统的压力也极高,因此K2CO3通过式(14)的转化过程有可能成立。由于增加了K2CO3与CO2反应过程,显然其作用能力也将低于KHCO3。
KOH首先与CO2反应产生K2CO3:

(15)
K2CO3再通过式(14)进一步作用。显然,KOH的作用步骤比K2CO3的多,导致其对水气转换的作用能力会低于K2CO3。
由上述讨论可见,图7的转化过程能较好解释三种钾盐对水气转化作用能力之间的差异。但从实验结果可以看到,除KHCO3外,其他两种钾盐以及混合钾盐之间作用能力的差异随过程条件会出现一些改变;此外,一些因素影响的规律还不能很好解释,因此对超临界水条件下钾盐对水气转化的作用机理还须进一步研究。
4 结 语
(1) 超临界水中水气转换的气体产物为H2、CO和CO2。
(2) KOH、KHCO3、K2CO3和混合钾盐均提高了H2产率,且KHCO3对H2产率的影响程度最强,而其他成分的影响程度随过程条件而变化。
(3) 提高反应温度、延长反应停留时均促进H2的生成,增大反应压力和增加K+浓度对H2产率的影响则比较复杂。
(4) 钾盐对水气转换的影响可能是通过以草酸氢盐和甲酸盐为中间产物的机理进行。
