非小细胞肺癌患者外周血及肿瘤组织中CD4+T淋巴细胞上Tim-3的表达及其对巨噬细胞活性的影响
2020-04-03魏徵霄何雪梅
魏徵霄,何雪梅
(1.四川金域医学检验中心有限公司实验室,四川成都 610000;2.西南医科大学附属医院实验中心,四川泸州 646000)
非小细胞肺癌(NSCLC)是肺癌中发病率最高的肿瘤疾病,其发病人数占据肺癌总数的80%,也是导致肺癌患者死亡的主要原因[1-2]。大多数NSCLC患者确诊时已为中晚期,由于免疫系统失调,癌细胞快速增殖并转移到其他部位,导致预后极差,5年生存率约为20%[3]。有研究指出,免疫系统在肿瘤细胞的增殖、转移过程中发挥了重要作用,尤其是T细胞免疫球蛋白黏蛋白结构域分子3(Tim-3)是T细胞表面重要的信号分子,具有负性免疫调节作用,与相应的配体结合可激活相关信号通路从而抑制Th1细胞功能[4-5]。程序性死亡蛋白配体-1(PD-1)作为负性调控分子,与T细胞耗竭密切相关[6-7]。有报道显示,肿瘤疾病中巨噬细胞活化可影响相关生长因子而促进癌细胞的生长、转移、浸润,加剧病情进展[7-9]。但在NSCLC中,外周血、肺癌组织、正常组织Tim-3 和PD-1的表达对巨噬细胞活化有何影响未见报道。本研究旨在探讨NSCLC患者外周血、肿瘤组织及正常组织中CD4+T细胞上Tim-3和PD-1的表达及其对巨噬细胞活性的影响,现报道如下。
1 资料与方法
1.1一般资料 选取西南医科大学附属医院2017年1月至2018年6月收治住院的首次诊断为NSCLC的64例患者作为研究对象。研究对象纳入标准:(1)首次诊断为NSCLC,且病理HE染色确诊者;(2)属原发性肿瘤者;(3)行手术切除术后未进行放疗及化疗者;(4)临床资料完整者。排除标准:(1)合并其他恶性肿瘤者;(2)肝肾功能异常、合并心脑血管疾病者;(3)精神异常不配合者。入选患者中男35例,女29例;年龄51~74岁,平均(64.73±9.28)岁;肺鳞状细胞癌42例,腺癌22例;根据2009年UICC第7版TNM分期,Ⅰ、Ⅱ期27例,Ⅲ期37例。同时,选取40例健康者作为健康对照组,其中男22例,女19例;年龄48~72岁,平均年龄(62.18±8.75)岁,本研究经西南医科大学附属医院医学伦理委员会同意后开展。
1.2方法
1.2.1标本采集 治疗前,清晨采集NSCLC患者空腹静脉血(4 mL),3 000 r/min离心10 min,取上清液-20 ℃冻存备用。同时,抽取健康对照组人群静脉血作为对照。患者签署知情同意书后,收集手术切除的肺癌组织标本,以及癌旁5 cm以上的正常肺组织(HE染色证实无肿瘤浸润)。样品制备:取部分肿瘤组织和对应的正常组织置于含有庆大霉素(900 IU/mL)、青霉素(500 IU/mL)及链霉素(500 μg/mL)的无血清培养基中,并将组织剪切成 1~2 mm3的组织碎块;采用消化酶液体(胶原酶Ⅰ1 μg/mL,胶原酶Ⅳ1 μg/mL,DNase 25 μg/mL,2%胎牛血清混合配置)消化30 min,经Percoll组织标本分离液获取单细胞悬液备用。
1.2.2流式法检测外周血及肺组织Tim-3和PD-1表达 流式法检测在 CD4+T 细胞上Tim-3和 PD-1的表达:取外周抗凝血,肿瘤组织及正常组织单细胞悬液各 100 μL,然后加入5 μL荧光标记的特异性抗体,包括抗Tim-3-PE、抗 PD-1-FITC及抗 CD4-PerCP-cy5.5,排除死细胞后混匀置于冰上避光孵育20 min;同时,设定各对照管。反应完毕后,将1 mL红细胞裂解液加至外周血流式管中,振荡混匀,避光放置于37 ℃恒温箱中反应 20 min,肿瘤组织及癌旁组织单细胞悬液管可略过此步骤。将含有5%牛血清清蛋白及0.09%叠氮钠的磷酸盐缓冲液(FACS缓冲液,2 mL)离心后,去除上清液,再用 300 μL 的 FACS 缓冲液重悬。最后,采用FACS AriaⅡ流式细胞仪进行数据采集,通过FlowJo软件分析数据,计算阳性细胞比例。
1.2.3实时荧光定量PCR(qPCR)检测巨噬细胞诱导型一氧化氮合酶(iNOS)和精氨酸酶1(Arg1) mRNA水平 各组肺组织40 mg,根据试剂盒说明书,采用TRizol法提取总RNA,测定水平;然后根据cDNA Kit试剂盒进行反转录。GAPDH、iNOS和Arg1 mRNA水平按照操作说明,在Takara qPCR仪上进行检测。反应体系中总体积10 μL:cDNA模板(50 ng/μL)1 μL,正反向引物(10 μmol/L)各0.5 μL。反应条件:95 ℃预热3 min,95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸20 s;循环40次。每个样品设置3个重复,并以GAPDH作为内参测定iNOS和Arg1 mRNA水平;定量PCR特异产物通过熔解曲线分析,以2-ΔΔCt表示相对基因表达变化。PCR引物序列见表1。

表1 引物序列
2 结 果
2.1外周血中Tim-3和PD-1的阳性表达比较 见图1,肺癌患者外周血中CD4+T淋巴细胞上Tim-3表达百分比为4.96%(0.94%~28.46%),PD-1表达百分比为24.13%(12.05%~33.64%),均显著高于健康对照组的Tim-3和PD-1表达水平[2.05%(0.54%~7.04%)及10.25%(3.12%~20.68%)],差异均有统计学意义(P=0.021,P=0.005)。且肺癌患者外周血CD4+T 淋巴细胞上Tim-3+PD-1+的表达水平为4.36%(2.73%~27.94%),明显高于其在健康对照组外周血中的表达[2.63%(1.27%~25.08%)],差异有统计学意义(P=0.008)。
2.2肺组织中Tim-3和PD-1的阳性表达比较 见图2,肺癌组织中CD4+T淋巴细胞上Tim-3表达明显高于癌旁正常组织(28.52%vs. 11.59%),差异有统计学意义(P=0.016);同时肺癌组织中CD4+T淋巴细胞上PD-1表达水平也显著高于正常组织(41.73%vs. 20.26%),差异有统计学意义(P=0.007)。进一步分析肺组织中CD4+T淋巴细胞上Tim-3和PD-1的共表达情况,肺癌组织中CD4+T淋巴细胞上Tim-3+PD-1+共表达明显高于正常组织(36.72%vs. 16.28%),差异有统计学意义(P=0.011)。

图1 外周血CD4 阳性细胞上Tim-3和 PD-1表达水平比较
2.3肺组织中巨噬细胞活性物质iNOS和Arg1 mRNA水平比较 与癌旁正常组织比较,肺癌组织中iNOS mRNA略有降低(P>0.05),而Arg1 mRNA水平则显著升高,差异有统计学意义(t=3.953,P=0.012)。见表2。
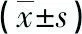
表2 肺组织中巨噬细胞活性物质iNOS和Arg1 mRNA水平比较
2.4肺组织中Tim-3和PD-1表达与巨噬细胞活性的相关性 采用Pearson相关分析统计发现,肺组织中Tim-3、PD-1表达和Tim-3+PD-1+共表达与巨噬细胞活性iNOS/Arg1比值均呈负相关(P<0.05),见表3。

表3 肺组织中Tim-3和 PD-1表达与巨噬细胞活性的相关性

图2肺组织CD4阳性细胞上Tim-3和PD-1表达水平比较
3 讨 论
肿瘤细胞增殖、转移、浸润及扩散过程中,巨噬细胞及其炎症因子对促进肿瘤血管生长起着重要作用,巨噬细胞活化可加速机体代谢,通过免疫系统介导相关信号通路促使肿瘤细胞增殖、扩散及转移,导致疾病恶化[10-11]。有研究发现,Tim-3和 PD-1等负性调控因子,在恶性肿瘤中CD4+T淋巴细胞上大量表达,与相应的配体结合可激活相关信号通路从而抑制Th1细胞功能,其增高导致负性免疫调节,加快了肿瘤细胞的侵袭、增殖及转移环节,正常细胞更易发生凋亡,预后极差[12]。
本研究得到了类似的结果,肺癌患者外周血中CD4+T淋巴细胞上Tim-3、PD-1表达百分比为4.96%和24.13%,均显著高于健康对照组的2.05%及10.25%(P<0.05);且肺癌患者外周血 CD4+T淋巴细胞上Tim-3+PD-1+的表达水平为4.36%,也明显高于健康对照组的2.63%,这一结果提示,NSCLC患者肺癌组织中CD4+T淋巴细胞上Tim-3和PD-1高表达是肿瘤发生、发展的重要因素。此外,本研究还发现肺癌组织中CD4+T淋巴细胞上Tim-3表达明显高于癌旁正常组织,同时肺癌组织中CD4+T淋巴细胞上PD-1表达水平也显著高于正常组织。为进一步分析肺组织中CD4+T淋巴细胞上Tim-3和 PD-1的共表达情况,检测得到肺癌组织中CD4+T淋巴细胞上Tim-3+PD-1+共表达明显高于正常组织。这证实Tim-3通过提高调节性T细胞扩增,再介导PD-1信号通路负性调控T细胞的免疫应答,形成负性的肿瘤微环境导致肿瘤免疫逃逸。
前期研究证实,肿瘤疾病中巨噬细胞活化,例如促使M1型巨噬细胞转变为M2型巨噬细胞可分泌相关生长因子而促进癌细胞的生长、转移、浸润,加剧病情进展[6-7]。本研究结果显示,与癌旁正常组织比较,肺癌组织中M1巨噬细胞标志物iNOS mRNA略有降低(P>0.05),而M2巨噬细胞标志物Arg1 mRNA水平则显著升高,说明巨噬细胞活性发生变化。为探讨肺癌组织中Tim-3和 PD-1表达与巨噬细胞活性的相关性,本研究采用了Pearson相关分析,发现肺组织中Tim-3、PD-1表达和Tim-3+PD-1+共表达与巨噬细胞活性iNOS/Arg1 比值均呈负相关,Tim-3、PD-1表达越高,Arg1 mRNA水平越高,iNOS/Arg1 比值越低,这和张娟等[6]的报道一致。
4 结 论
NSCLC患者外周血及肿瘤组织中CD4+T淋巴细胞上Tim-3和PD-1表达上调,促使M1型巨噬细胞转变为M2型,具有负性免疫调节作用。
