不同程度冠状动脉粥样硬化病变下心肌组织中melusin的表达研究*
2020-04-03万昌武于燕妮汪元河汪家文
李 竹, 万昌武, 于燕妮, 黄 江, 夏 冰, 汪元河, 汪家文, 王 杰
(贵州医科大学法医学院, 贵州 贵阳 550004)
冠心病(coronary heart disease, CHD)指因冠状血管病变导致心肌供血不足而引起的缺血性心脏病,是由于冠状动脉病变导致血管结构性或功能性狭窄,使心肌供血不足,从而引起一系列心脏代谢、功能及结构的紊乱疾病。研究表明,CHD是心血管系统疾病中发病率最高的疾病,也是导致猝死最常见的疾病,对人类健康及生命构成了极大危害[1]。melusin蛋白是一种特异性的肌肉组织蛋白,属于黏附分子的一员,其具有独特的结构域,不仅介导了细胞与细胞外基质及其细胞自身的黏附,还参与了细胞的信号转导与活化等重要的生理病理过程(生长、分化、炎症反应及创伤修复等)[2]。研究表明,melusin在血管平滑肌细胞特别是在斑块内微血管中存在,对冠状动脉粥样硬化中血管的形成具有显著的调节作用[3-4]。动物实验也证实,在动脉粥样硬化早期,melusin的高表达可以引起粥样斑块的生长;同时其能帮助平滑肌细胞浸润血管内膜从而促进新生血管的生成,在动脉粥样硬化晚期可以防止斑块破裂、出血[5]。在小鼠的左前降支冠状动脉结扎模型中,melusin的表达发挥了重要的保护作用,不仅减少了炎症细胞的浸润,还改善了缺血远端的冠脉痉挛及心肌组织的缺血状态,有效防止了心脏破裂[6-7]。有研究报道,在动脉粥样硬化患者的心肌中,melusin的蛋白及mRNA表达量较正常实验者显著降低[8-9]。由此可见,melusin作为一种保护性因子,参与了心血管系统疾病的发生,在冠状动脉疾病,尤其是冠状动脉粥样硬化的发生发展过程中发挥了重要的作用。但上述研究结果来源仅限于动物模型、血清学等层面,关于直接检测人体心脏组织中melusin表达的报道较为罕见。
本研究旨在通过收集法医鉴定中冠心病案例,检测心肌组织中melusin蛋白的表达水平,分析其在不同程度冠状动脉粥样硬化病变下的改变情况,探讨melusin表达与冠心病发生发展的关系,为冠心病的早期预防和治疗提供更为充分的实验依据。
材 料 和 方 法
1 实验材料收集
根据卫生部颁布的《解剖尸体规则》并获得了贵州医科大学伦理委员会的认可(伦审批件号:2018-60-01),提取了贵州医科大学法医司法鉴定中心2014年5月~2018年10月经尸体解剖检验的人体冠状动脉及心脏组织样本,主要为左心室肌实验组和对照组。实验组案例纳入标准:(1)纳入的案例为常温保存1 d或冰冻保存3 d以内(后于室温解冻24 h)者;(2)经组织病理学检查确认存在冠心病病变:①冠状动脉管壁内膜增厚、管腔变窄,增厚的冠脉内膜见粥样斑块形成,存在或不存在继发病变(粥样斑块破裂、斑块内出血、动脉瘤形成等);②合并心肌病变(心肌纤维化、心肌梗死等);(3)冠状动脉粥样硬化伴有或不伴有心肌缺血改变;(4)冠心病伴有或无心脏肥大;(5)按WHO规定,猝死是指从症状发作至死亡时间在24 h内。实验组案例排除标准:(1)组织自溶、腐败,结构不清的病例;(2)尸体检验及组织病理学检查证实有风湿性心脏病、心肌病、心肌炎等病变;(3)具有恶病质或多器官功能障碍及全身感染性炎症的病例。对照案例纳入标准:(1)纳入的案例为常温保存1 d或冰冻保存3 d以内(后于室温解冻24 h)者;(2)死亡原因明确为意外高坠、机械性窒息死亡或溺死且无冠状血管及心肌组织病变。排除标准同实验组。
根据上述纳排标准,对照案例选取无病变的冠状动脉前降支及左心室肌;实验组选取肉眼所见的冠状动脉粥样硬化病变最重(狭窄最重)血管段,经组织学检查证实为粥样硬化病变的案例,同时提取案例对应的左心室肌组织。所取组织均以4%中性甲醛液固定供HE染色和免疫组织化学(immunohistochemical staining,IHC)染色,其中部分心肌组织置于-80 ℃冰箱冻存供Western blot及real-time PCR检测。
2 主要仪器与试剂
兔抗人melusin单克隆抗体(GeneTex);兔抗人β-actin单克隆抗体(Bioss);PV9000二步法试剂盒(中杉金桥);辣根过氧化物酶标记的羊抗兔IgG(Thermo);SYBR® Select Master Mix试剂(Applied Biosystems)。显微镜(Olympus);ND2000 超微量紫外分光光度计和ABI Fast 7500型实时荧光定量PCR仪(Thermo)。
3 主要方法
3.1心肌组织HE染色及形态观察 经4%中性甲醛液固定的心肌组织,石蜡包埋后行4 μm切片,HE染色后于光镜下观察心肌的结构变化,并采集图像。
3.2Western blot检测人心肌组织内melusin蛋白的表达 取出-80 ℃冰箱冻存的心肌组织(重量70~90 mg)匀浆,提取蛋白。用紫外分光光度计测量其浓度,以β-actin为内参照,行SDS-PAGE分离(12% SDS胶浓度)。PVDF膜转膜,5%脱脂牛奶封闭后孵育Ⅰ抗β-actin(1∶2 000)、melusin(1∶1 000),4 ℃孵育过夜,加入辣根过氧化物酶标记的羊抗兔IgG(1∶10 000)Ⅱ抗,经过底物显色后进行图像采集,采用ImageJ软件检测各泳道的灰度值并分析。
3.3IHC染色检测心肌组织内melusin蛋白的表达与分布 石蜡包埋的4 μm切片,脱蜡,水化,高压热修复抗原,以melusin抗体(1∶150)为Ⅰ抗,以PBS缓冲液为阴性对照,4 ℃孵育过夜。以辣根过氧化物酶标记的羊抗兔IgG为Ⅱ抗,室温孵育40 min,经DAB显色2 min,苏木素复染30 s后封片。于镜下观察阳性表达细胞的位置、强度后在400倍镜下选取5个视野拍照,测量平均吸光度(阳性表达吸光度/测量总面积)以反应蛋白表达水平。
3.4real-time PCR测量心肌组织内melusin mRNA的表达量 采用TRIzol试剂提取心肌组织(70~90 mg)的总RNA。用紫外分光光度计对RNA进行定量,并进行逆转录。后加入荧光Mix试剂和引物在实时荧光定量PCR仪上测量Ct值,用2-ΔΔCt法计算mRNA表达量。PCR条件为:50 ℃ 2 min;95 ℃ 2 min;95℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,共40个循环。解离曲线条件为:95 ℃ 15 s;60 ℃ 1 min;95 ℃ 15 s。所得的引物均是在NCBI网站Gene库中检索,并按照引物设计原则设计,最后由上海生物工程有限公司合成的。引物序列见表1。
4 统计学处理
所得数据行正态分布及方差齐性检验。计量资料采用均数±标准差(mean±SD)表示,多组间均数比较采用单因素方差分析;计数资料组间比较采用卡方检验。利用logistic回归对各个单变量与CHD的关系进行单因素分析,得出各个变量对CHD的优势比(odds ratio, OR)和95%可置信区间(confidence interval, CI);并采用广义相加模型评估melusin的表达和CHD的相关性。数据均来自3次独立实验结果。使用SPSS 22.0统计学软件分析。以P<0.05为差异有统计学意义。

表1 Real-time PCR引物序列
结 果
1 光镜下观察并分组
按纳排标准收集冠状动脉及心肌组织,实验组各70例,对照组(A组)各20例。光镜下观察冠脉内膜,以脂质坏死核心占斑块面积的40%为标准[10],进而根据斑块内是否存在继发病变将实验案例分为:B组,动脉粥样硬化斑块稳定组;C组,粥样硬化斑块不稳定组但无血栓形成、斑块破裂、斑块内出血等任一种继发病变者;D组,斑块不稳定组且伴有上述任一种继发病变者。分组依据见表2。

表2 分组的依据
In the case of secondary lesions, there is a single lesion or a combination of two or three secondary lesions.
2 病例基本情况
比较各组间基线资料,组间性别、身高、是否饮酒、是否有慢性呼吸系统疾病及慢性肝脏疾病等资料差异无统计学意义(P>0.05);年龄、是否肥胖、心脏重量、左心室壁厚度、是否吸烟、是否有高血压及慢性肾脏疾病等资料差异有统计学意义(P<0.05),见表3。
3 冠状动脉及心肌结构的病理变化
HE切片光镜下可见对照组血管壁薄,内膜平滑完整;B、C、D组见血管壁偏心性增厚,管腔不同程度狭窄,内膜下见纤维帽形成,于坏死核心底部及周边见泡沫细胞、淋巴细胞浸润及大量薄壁小血管增生;部分病例出现典型粥样坏死灶,坏死核心周边残留数量不等的泡沫细胞等炎症细胞,病灶表面纤维帽厚薄不一;病灶内还可见斑块内出血,血栓形成等继发病变,血管中膜弹性纤维断裂、平滑肌细胞受压萎缩变薄,外膜可见结缔组织增生及少量淋巴细胞浸润,见图1。

表3 案例的基线资料比较
BMI: body mass index.

Figure 1.Microscopic changes in coronary vascular structures (HE staining, ×40). A: control group; B: atherosclerosis but no sudden coronary death; C: sudden coronary death but coronary atherosclerotic lesions without secondary lesions; D: sudden coronary death and coronary atherosclerotic lesions associated with thrombosis.
图1 冠状动脉血管结构的显微改变(HE染色)
HE切片光镜下可见对照组心室肌细胞横纹结构清晰,核椭圆且染色均匀,心肌纤维形态规则; B组见部分心肌细胞体积增大,胞核增大、深染,形态不规则;部分心肌细胞出现萎缩改变,核浆比相对增大,心肌纤维间隙增宽,横纹模糊不清;C组可见心肌间质增宽,围绕间质小血管的心肌出现纤维化改变;D组见部分心肌伴不同程度的脂肪组织浸润,部分心肌于梗死灶的周边部出现凝固性坏死,呈网状分布,心肌细胞核消失,肌浆均质红染,嗜酸性染色增强,间质水肿,心肌纤维部分溶解消失,细胞间可见散在的单核细胞和淋巴细胞浸润等炎症反应,见图2。

Figure 2.Microscopic change in human myocardial tissue (HE staining, ×100).
图2 人心肌镜下病理变化(HE染色)
4 心肌组织内melusin蛋白的表达
Western blot结果显示与对照组相比,B组心肌组织中melusin表达显著升高(P<0.05),C组中melusin水平较对照组比较明显降低,且D组melusin水平明显低于C组(P<0.05),见图3。

Figure 3.The result of Western blot for melusin. Mean±SD.*P<0.05vsA group;#P<0.05vsB group;△P<0.05vsC group.
图3 melusin的Western blot结果
5 心肌组织melusin的表达水平
IHC染色结果表明,对照组心肌细胞胞浆中有分布均匀的棕黄色着色,B组心肌细胞中棕黄色着色细胞颜色增深;C组中棕黄色染色的心肌细胞数量明显减少,着色变淡;而D组的心肌细胞胞浆中部分未见棕黄色颗粒的阳性表达,melusin表达显著减弱,阳性染色呈点片状分布,部分心肌可见大片缺染及淡染的情况,见图4。
用IPP 6.0软件分析检测melusin表达的平均吸光度,与对照组比较,B组阳性表达明显增高,C组和D组阳性表达显著降低(P<0.05),见图4。
6 心肌组织内melusin mRNA的表达
real-time PCR结果显示,B组中melusin mRNA的水平与对照组比较有显著升高(P<0.05);C组mRNA水平较对照组明显降低,D组melusin mRNA水平较C组减少(P<0.05),见图5。
7 logistic回归和多元回归分析
各变量与CHD发病关系的回归分析结果显示,年龄、心脏重量、是否肥胖、是否吸烟、是否有高血压为CHD发生的危险因素;而melusin的表达是CHD发病的保护因素,见表4。在调整了各变量后,广义相加模型结果显示melusin的表达与CHD的发病密切相关,呈现显著的负相关性(OR=0.3; 95% CI: 0.2~0.4;P<0.01)。

Figure 4.Expression of melusin protein in human myocardial tissues (IHC staining,×400). Mean±SD.*P<0.05vsA group;#P<0.05vsB group;△P<0.05vsC group.
图4 人心肌组织melusin蛋白表达的IHC结果

Figure 5.The melusin mRNA expression in heart tissues. Mean±SD.*P<0.05 A groups;#P<0.05vsB group;△P<0.05vsC group.
图5 各组melusin mRNA相对表达量
讨 论
研究表明,心源性猝死是法医病理猝死案件中最常见的类型[1],其中冠心病性猝死位居第1位,约占心源性猝死的50%[11]。CHD是指因冠状血管病变导致心肌供血不足而引起的缺血性心脏病,缺血程度较轻者可没有明显不适或仅表现为心绞痛,程度较重者可因发生心肌梗死而危及生命,缺血程度严重者则会因心脏功能严重紊乱致短时间内死亡,即猝死。引起CHD发作的原因较多,其中以冠状动脉粥样硬化最为多见。由于冠脉内膜下脂质沉积、纤维组织增生及粥样坏死灶的形成等,使得病变部位血管壁出现不同程度增厚、弹性降低,管腔出现不同程度狭窄等改变,致使心肌供血不足从而引起CHD发作。
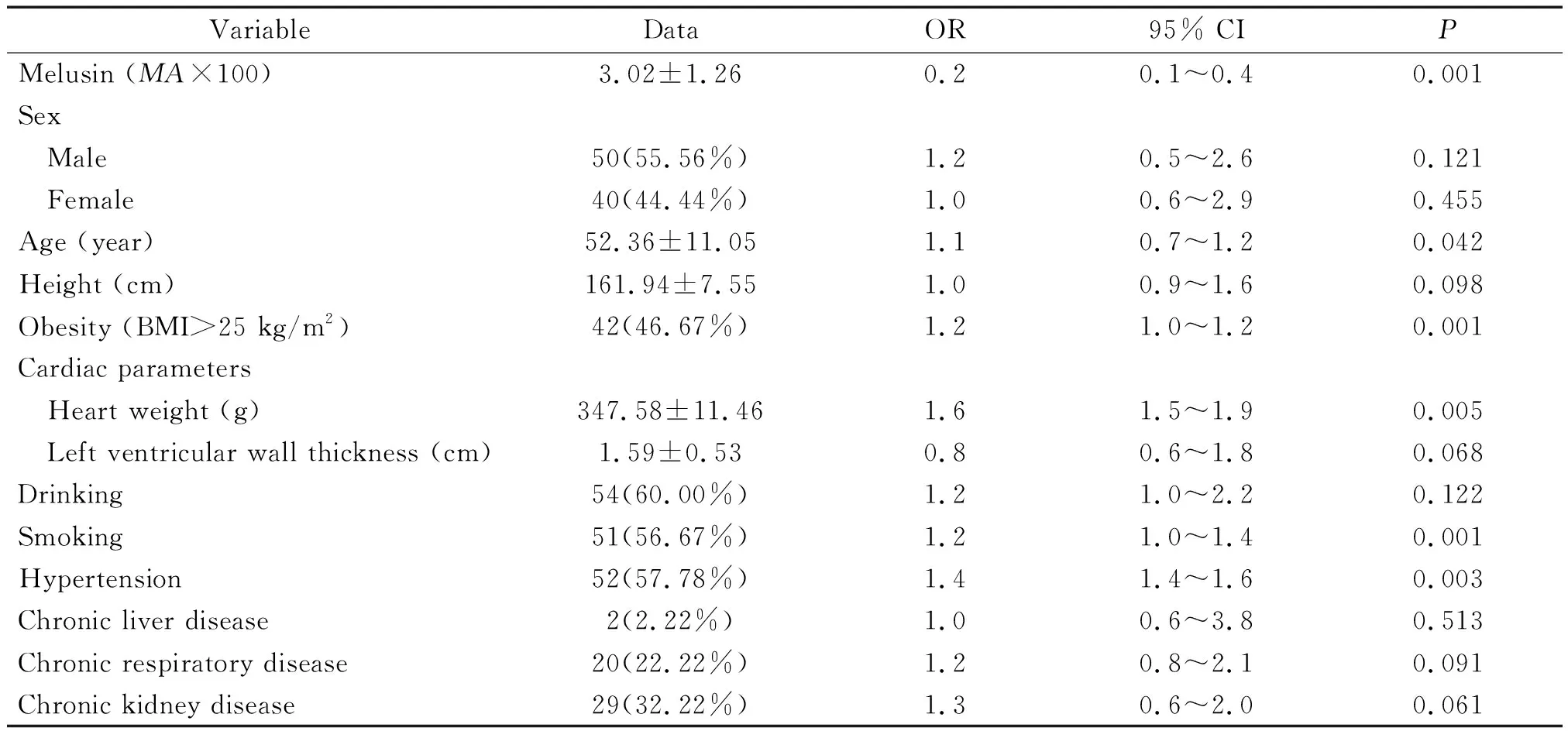
表4 logistic回归分析结果
Melusin is the correction factor.MA: mean absorbance.
Melusin蛋白是由基因ITGB1BP2(Xq12~q13) 编码的一种特异性肌肉组织蛋白,在骨骼肌和心肌中特异性的高表达。其作为整合素β1的功能性伴侣蛋白和支架蛋白,使细胞与细胞外基质的变化相互传导,让细胞能够更好的适应环境变化,从而维持细胞基本功能,提高生存适应性[7]。诸多研究证实,在正常生理条件下,心脏的发育和基础功能均不受melusin的影响[12],但在出现主动脉瓣狭窄、冠状动脉粥样硬化、高血压等病理改变后,其表达增高可以维持心脏正常的节律性和收缩性,保持心脏形态,防止心室扩张并向心力衰竭过渡[13]。在小鼠冠状动脉粥样硬化模型中,melusin的存在不仅能减少炎细胞的浸润,还可以改善缺血远端的冠脉痉挛及心肌的状态,防止心脏发生破裂[6-7],以上研究表明melusin作为一种保护性因子,参与了心血管系统疾病的发生,能够有效的减少心肌细胞凋亡,维持心脏的正常结构和生理功能,在冠状动脉疾病,尤其是冠状动脉粥样硬化的发生发展过程中发挥了积极的保护效应。
研究表明,melusin的高表达可以诱导心肌肥大,适度增加左心室壁厚度而不改变收缩功能,并且阻止进一步向扩张型心肌病和心力衰竭过渡,同时也可使远端缺血区域的存活心肌组织缺血情况有所改善[6]。本研究检测了不同程度冠状动脉粥样硬化病变下心肌组织中melusin的表达改变,发现在粥样硬化病变轻、心肌缺血程度较轻者的心肌中,melusin表达量增加,心肌细胞呈现出肥大改变。但在粥样硬化病变、心肌缺血严重的患者心肌中,我们检测到melusin表达量显著降低,甚至消失。同时我们将收集的各变量与CHD发病关系进行logistic回归分析,得到melusin蛋白在心肌组织中的表达和CHD发病呈显著负相关性,这提示melusin作为CHD发病的一种保护因素,可能通过调节某种信号转导通路,如PI3K/AKT及MAPK信号通路等[14-15],减少了炎症细胞的浸润及纤维化,使心肌细胞凋亡减少,免受氧化应激的诱导,从而发挥保护心肌细胞的作用;而melusin含量的减少可能影响了上述信号通路对心肌组织的保护调节作用,进而加速病程的进展。但对其所影响的具体信号通路及机制还有待于进一步探讨。
此外,本研究还存在一定的局限性。首先,本研究资料统计属于回顾性研究,难以追溯缺失的基础资料,如血脂、血压、血糖等无法测量[16],所以无法对这类因素与CHD发病之间的相关性作出评估;其次,本研究的样本量有限,可能存在选择偏倚。
综上所述,在不同程度冠状动脉粥样硬化病变下心肌组织中melusin的表达差异显著,且与冠心病的发生发展呈负相关,提示melusin可能是冠心病发生发展过程中心脏的保护因素。
