N-辛基吡啶类离子液体对钒渣水浸液中钒的萃取机理
2020-04-02薛向欣
周 超,李 勇,薛向欣
N-辛基吡啶类离子液体对钒渣水浸液中钒的萃取机理
周 超,李 勇,薛向欣
(东北大学 冶金学院,沈阳 110819)
钒是重要的战略资源,目前主要是从钒钛磁铁矿经“高炉冶炼−转炉吹钒”工艺所得钒渣中采用湿法冶金提取,其中萃取方法应用最多。本文研究以N-辛基吡啶类离子液体为萃取剂,正戊醇为稀释剂,采用溶剂萃取法考察萃取分离V(Ⅴ)的影响因素,包括温度、时间以及溶液pH并对其萃取机理进行研究。结果表明:在[OPy]Cl和[OPy][BF4]萃取V(Ⅴ)最适宜的条件下,即萃取时间分别为60 s和40 s、pH=2.957~8.029、温度为25 ℃时,两者的V(Ⅴ)萃取率分别达到95.42%和93.52%;结合离子选择性电极法、斜率法、紫外−可见光谱分析、红外光谱分析等方法研究并确定了N-辛基吡啶类离子液体萃取V(Ⅴ)的机理为阴离子交换。
钒渣水浸液;N-辛基吡啶类离子液体;萃取机理

钒是重要的稀有金属元素之一,因其特殊的物理化学性质被广泛的应用于钢铁行业、化工、电极材料、航空航天的等诸多领域[1-2]。目前,我国最主要的钒资源是钒钛磁铁矿,它是一种铁、钒、钛等多种过渡金属元素共生的复合矿,具有极高的综合利用价值[3]。钒钛磁铁矿经“高炉冶炼−转炉吹钒”的火法工艺得到钒元素富集程度极高的中间产物钒渣,再经过“钠(钙)化焙烧−水浸”工艺得到水浸液,最终可以通过湿法冶金制备钒产品。
目前,湿法提钒的方法主要有离子交换法、化学沉淀法以及溶剂萃取法等。离子交换法[4-5]制得钒产品纯度高,但工艺流程长,生产效率低;化学沉淀法[6]工艺简单,但产生大量废液,产品纯度不高。萃取法具有操作简便、工艺流程简单、所得产品纯度高等优点,广泛应用于金属的回收、富集和废水处理等方向[7−8],也是湿法提钒采用的最主要方法。目前提钒常用的萃取剂有阴离子型和阳离子型萃取剂,其中,常见的阴离子型萃取剂[9−11]有P204和P507,萃取机理为阳离子交换,钒以[VO2]+形式进入有机相,形成[VO2]+[P204]−或[VO2]+[P507]−形式萃合物。但钒渣水浸液中钒的主要存在形式不是[VO2]+,而是多钒酸根([VO]5x−2y),而且[VO]5x−2y和[P204]−([P507]−电性相同,从而导致钒的提取率不高,使得该工艺的工业化应用较少。因此,在钒渣水浸液提钒采用阳离子萃取剂就是一种必然的选择,常见的阳离子型萃取剂有N263、季铵盐离子类、季鏻盐离子类、咪唑盐离子液体类以及吡啶盐离子液体类,其中离子液体是研究热点。
离子液体是一种新型绿色有机溶剂,由于阴阳离子的结构与组合的“可设计性”,使其具有卓越的溶解性和显著的离子性[12−13],已广泛应用于诸多领域,并表现出巨大的发展潜力与前景[14−16]。基于本课题组采用辛基咪唑四氟硼酸盐离子液体对钒表现出的优秀的萃取性能[17],为进一步探究离子液体萃取钒的条件及萃取机理,本文提出N-辛基吡啶氯盐和N-辛基吡啶四氟硼酸盐离子液体萃取金属离子的新思路,吡啶类离子液体较咪唑类离子液体具有成本低的优点,并且吡啶类离子液体对于萃取钒渣水浸液中钒的研究还未见报道。
本文以N-辛基吡啶类离子液体为萃取剂,以正戊醇为稀释剂,采用偏钒酸钠模拟钒渣水浸液对钒渣水浸液中钒的萃取性能和机理进行实验研究。该方法有利于环境,不会产生二次污染,并且为钒渣水浸液的资源化利用提供了一种高效、绿色的技术。
1 实验
1.1 材料
水相的配制:依据实际钒渣水浸液中V(Ⅴ)的浓度,选取NaVO3固体,模拟水相(V)=2.517 g/L,准确称量所需质量的NaVO3固体,溶于去离子水中。
有机相的配制:按照一定萃取剂浓度准确称量N-辛基吡啶氯盐和N-辛基吡啶四氟硼酸盐,加入正戊醇进行稀释,充分搅拌后定容。其中,偏钒酸钠(NaVO3)(分析纯)(国药集团化学试剂有限公司生产)、N-辛基吡啶氯盐([OPy]Cl)、N-辛基吡啶四氟硼酸盐([OPy][BF4])(化学纯)(林州市科能材料科技有限公司生产)、正戊醇(分析纯)(国药集团化学试剂有限公司生产)。
1.2 分析测试仪器
PXSJ−216离子计(上海雷磁仪器厂生产);Nicolet 380型傅里叶变换红外光谱仪(FT-IR)(美国热电集团生产);离子选择性电极(上海仪电科学仪器股份有限公司生产);SHA-C型恒温水浴振荡器(巩义市予华仪器有限公司生产);TG−60型高速离心机(巩义市予华仪器有限公司生产);DF−101S型集热式恒温加热磁力搅拌器(巩义市予华仪器有限公司生产)。
1.3 实验方法
按照一定比例准确量取水相和有机相(萃取剂)置于150 mL锥形瓶中,将其放入恒温水浴振荡器中,在一定温度、振荡速度为200 r/min匀速振荡一定时间,经离心机在2000 r/min下离心5.0 min。用硫酸亚铁铵滴定分析法测定水相(萃余液)中钒的浓度,用差减法推算有机相中钒的浓度,从而求得钒的萃取 率[18]。萃取体系的萃取率()、分配比()根据式(1)、(2)计算。

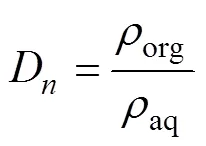
其中,萃取率是指萃入有机相的物质总量占两相中物质总量的百分比。分配比指有机相中被萃取物的总浓度与水相中被萃取物的总浓度之比。分配比愈大,萃取率愈高。
2 结果与讨论
2.1 时间对萃取率的影响
萃取时间指的是萃取达到平衡所需要的时间,水相中金属离子进入有机相与萃取剂结合形成萃合物,萃取时间过短,萃取不完全,效率低;萃取时间过长,又会降低生产效率[19]。本文分别选取了10、20、30、40、60、90、120 s七个不同的时间,在萃取剂浓度([OPy]Cl)=50.0 g/L、([OPy][BF4])=50.0 g/L、溶液pH为8.029,相比为1,温度为25 ℃,研究时间对V(Ⅴ)萃取率的影响。实验步骤同1.3节,结果如图1所示。
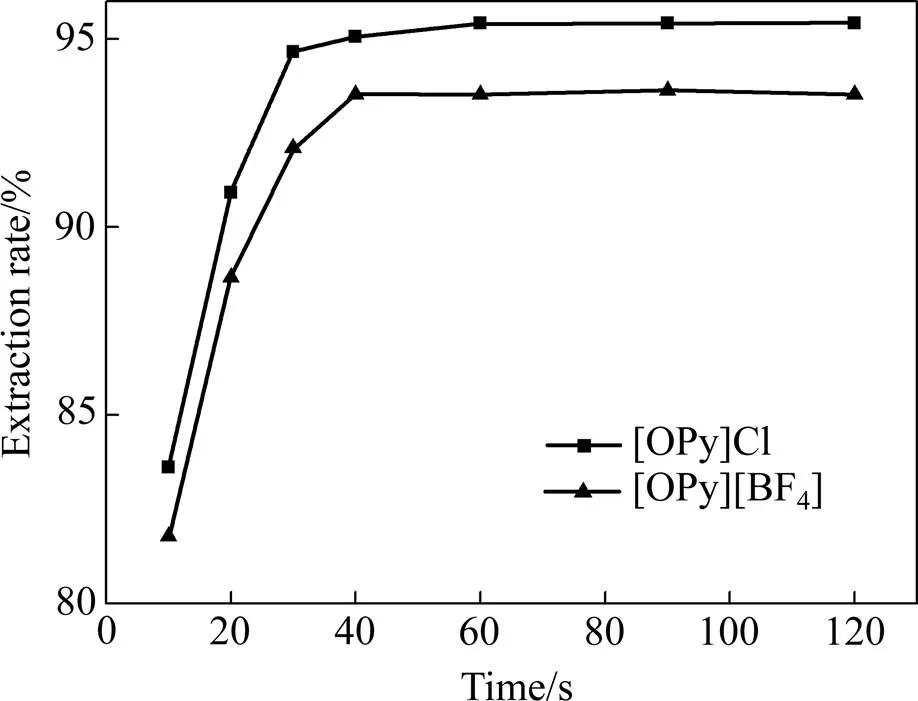
图1 时间对萃取率的影响
由图1可见,V(Ⅴ)的萃取率随着萃取时间的增加快速升高,当振荡至40 s时,[OPy][BF4]萃取的效率达到最大,为93.52%;当振荡至60 s时,[OPy]Cl萃取的效率达到最大,为95.42%。此后,萃取率保持不变。为保证较高的V(Ⅴ)萃取率,以下实验振荡时间选取为60 s。
2.2 温度对萃取率的影响
本文分别选取25、30、35、40、45 ℃五个不同的温度,研究温度对V(Ⅴ)萃取率的影响。萃取剂浓度、溶液pH、相比等实验条件同2.1节,其中萃取时间为60 s,实验步骤同1.3节,结果如图2所示。
由图2可见,温度变化对萃取过程的作用不显著,在温度为25 ℃时,V(Ⅴ)的萃取率达到最大。随着温度的升高,V(Ⅴ)的萃取率略有下降,这是由于离子液体的密度降低,且黏度随温度的升高而减小[20],温度过高会造成有机相的损失,导致萃取率降低。因此,本文其他实验选取的温度为25 ℃。

图2 温度对萃取率的影响
2.3 溶液pH对萃取率的影响
溶液pH会影响金属离子的赋存形式,不同pH条件,金属离子与离子液体的结合方式不同,萃取率不同,因此,pH对萃取过程来说是一个很重要的影响因素。水溶液中V(Ⅴ)的存在形式如图3所示[21]。
本文分别选取1.090、2.108、2.957、4.013、5.007、5.974、7.081、8.029、8.956九个不同的pH条件,研究溶液pH对V(Ⅴ)萃取率的影响。萃取剂浓度、相比等实验条件同2.1节,其中萃取时间为60 s,萃取温度为25 ℃。实验步骤同1.3节,结果如图4所示。
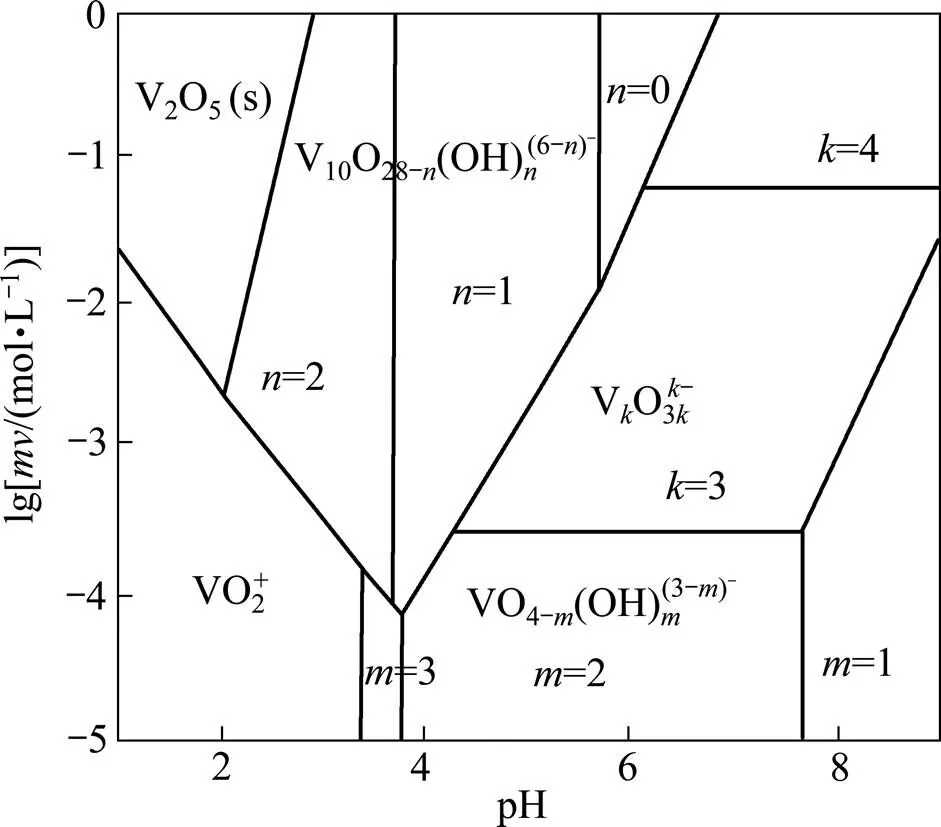
图3 水溶液中V(Ⅴ)的存在形式
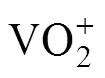
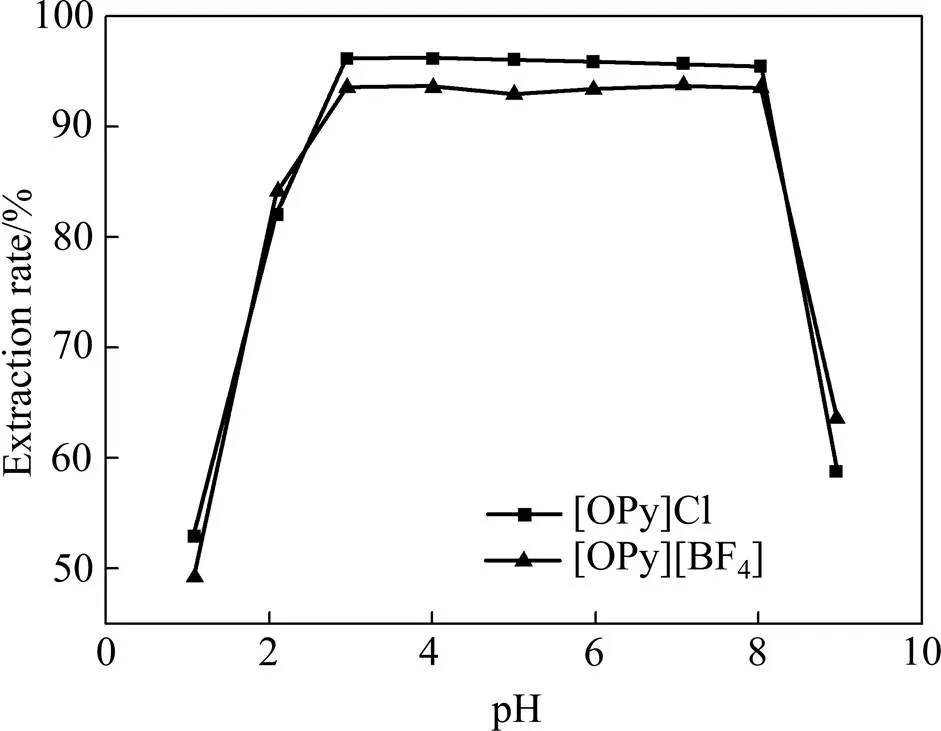
图4 溶液pH对萃取率的影响
2.4 [OPy]Cl、[OPy][BF4]萃取分离V(Ⅴ)的机理研究
通过前文进行的实验可以发现,N-辛基吡啶氯盐、N-辛基吡啶四氟硼酸盐离子液体萃取体系均对V(Ⅴ)有着明显的分离性能,这与离子液体萃取体系有着密切的关系,因此对萃取机理的研究十分重要。
2.4.1 离子选择性电极法
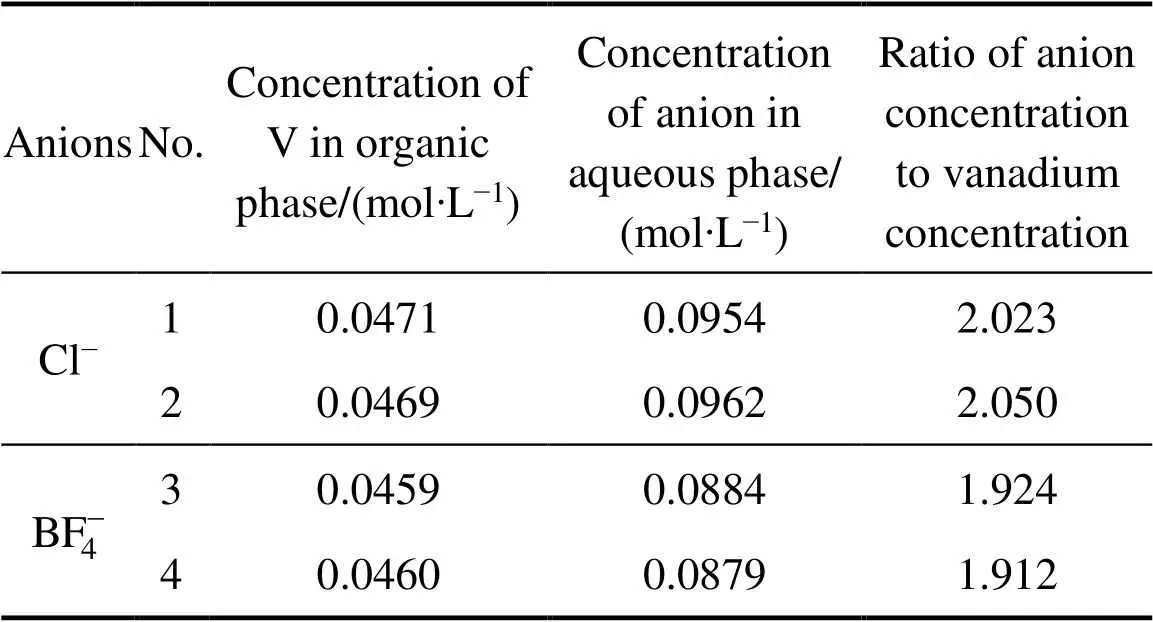
表1 离子选择性电极法实验结果
2.4.2 斜率法


[OPy][HVO4](n−2)+(org)+Cl−(aq) (3)

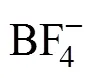
萃取平衡常数
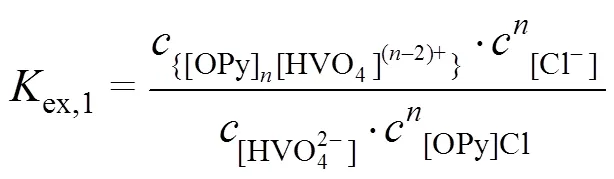
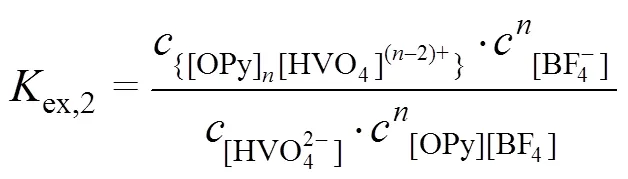
分配比

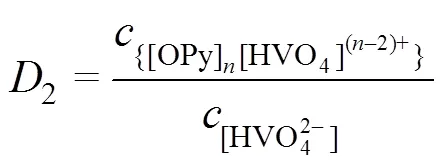
整理得
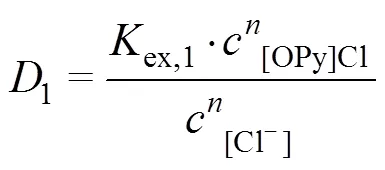
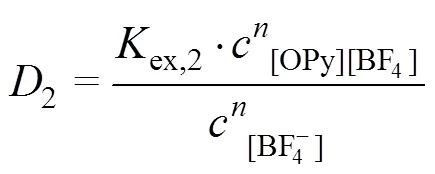
取对数
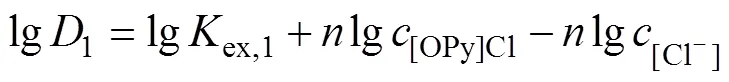


(14)
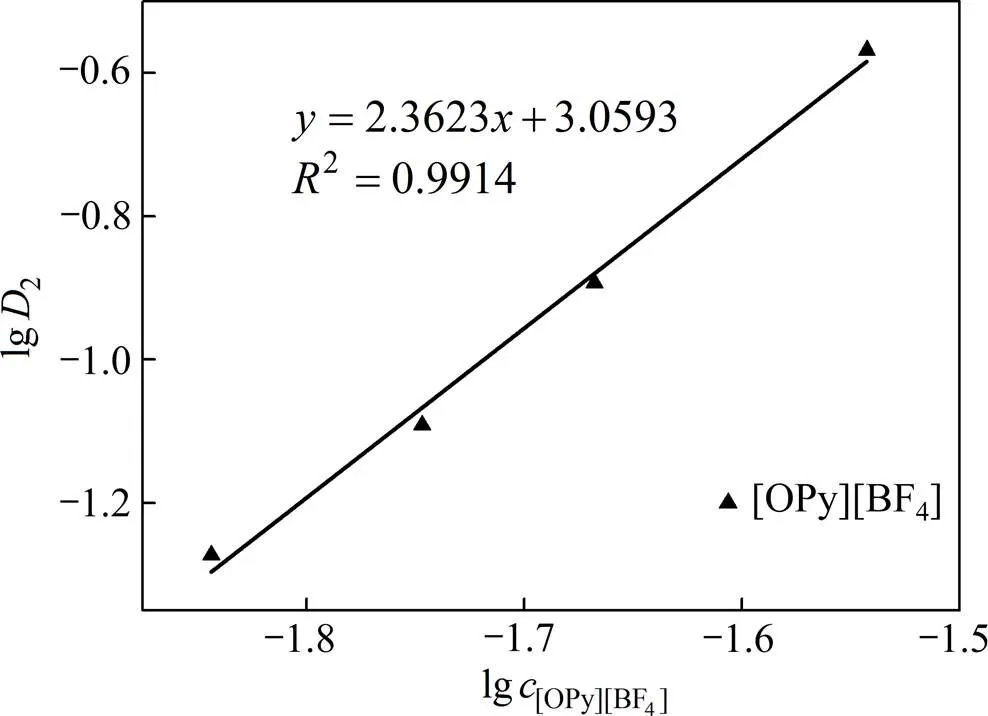
图6 曲线
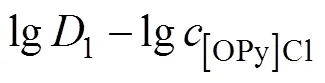
2.4.3 紫外−可见光谱分析
本文采用日本岛津公司生产的UV−2550型紫外可见分光光度计测定并比较水相、有机相及萃合物的吸收峰变化,紫外−可见光谱图如图7所示。
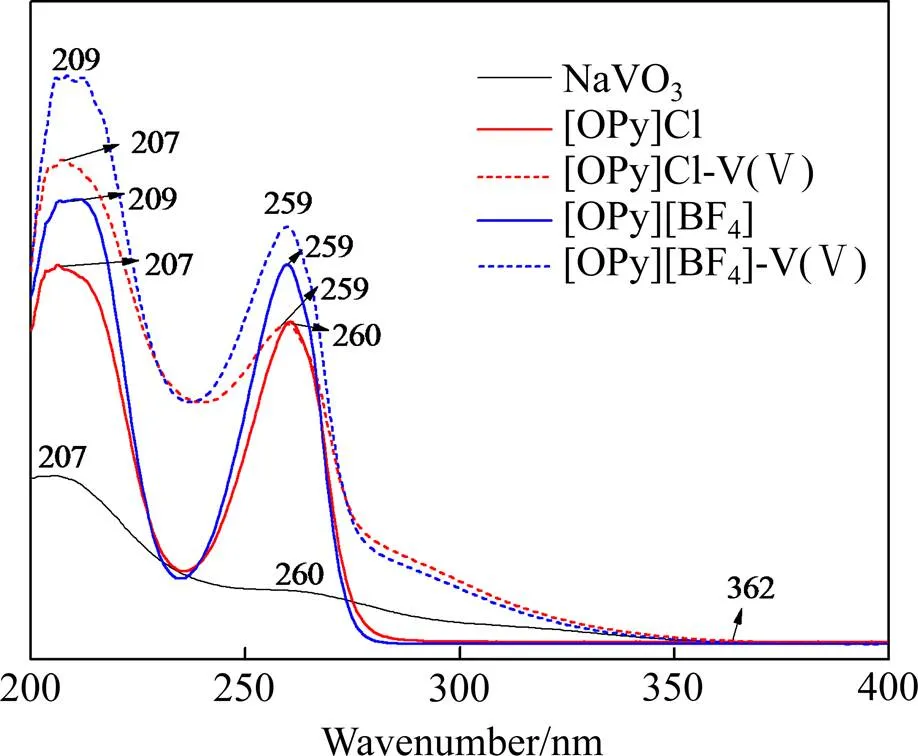
图7 紫外−可见光谱图
由图7可知,NaVO3溶液的紫外−可见光谱在 207 nm、260 nm处有两个吸收峰,在362 nm处产生了明显的吸光度变化。[OPy]Cl-V(Ⅴ)萃合物在 207 nm、259 nm处产生了两个吸收峰,与[OPy]Cl离子液体在207 nm、260 nm处的吸收峰位置相同;[OPy][BF4]-V(Ⅴ)萃合物在209 nm、259 nm处产生了两个吸收峰,与[OPy][BF4]离子液体在209 nm、259 nm处的吸收峰位置相同;两种离子液体萃合物的峰较原离子液体的峰均变高,推测是离子液体的峰与NaVO3溶液的峰发生重叠,此外,两种离子液体萃合物谱图在362 nm处都产生了明显的吸光度变化,与NaVO3溶液的吸光度发生明显变化的位置相近,产生了相同的信号。
通过对比紫外−可见光谱图,可以说明[OPy]Cl、[OPy][BF4]萃取V(Ⅴ)时,V(Ⅴ)被萃取进入了萃合物中,同时[OPy]+结构形式未发生改变,进一步证明了[OPy]Cl、[OPy][BF4]萃取V(Ⅴ)的机理符合阴离子交换。
2.4.4 红外光谱分析
为了进一步确定萃取机理,本文采用Nicolet−380型傅立叶变换红外光谱仪测定萃合物的化学结构。[OPy]Cl、[OPy][BF4]萃取V(Ⅴ)的红外光谱图如图8所示。
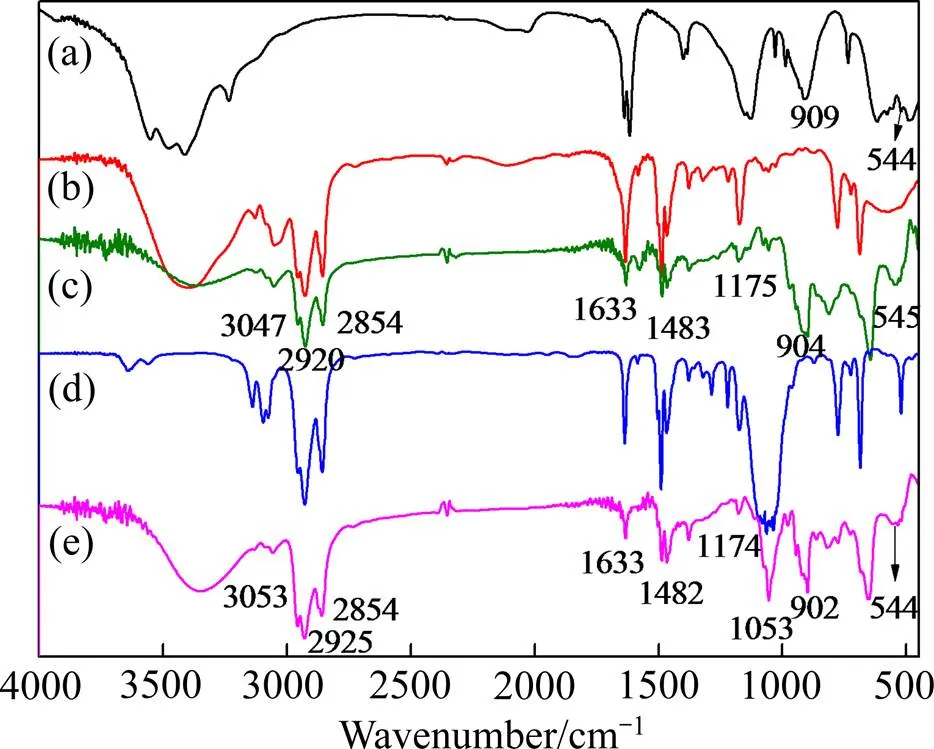
图8 样品的红外光谱图
由图8可见,NaVO3粉末的特征吸收峰在909、544 cm−1处。萃取之后,吡啶环大部分特征吸收峰未发生明显位移且强度变化不大。两种离子液体萃合物中,波数为3047、3053 cm−1处的峰值是吡啶环C—H伸缩振动峰;波数为2920、2854、2925、2854 cm−1处的峰值是辛基上饱和C—H键伸缩振动峰;波数为1633 cm−1处的峰值是吡啶环上C=N键和C—N键的伸缩振动;波数为1483、1482 cm−1处的峰值是吡啶环骨架的振动吸收峰;波数为1175、1174 cm−1处的峰值是吡啶环上C—H键的面内变形振动;波数为1054 cm−1处的峰值为B—F的振动吸收峰[24]。由此可见,萃合物的阳离子结构与[OPy]+保持一致[25],吡啶阳离子的结构没有发生改变。
此外,两种萃合物中均在904、902、545、544 cm−1处出现了强的振动吸收峰,表明V=O、V—O键的存在[26-27],因此,萃取过程符合阴离子交换。
综上所述,该方法可以有效地将钒从钒渣水浸液中分离出来,萃取机理为阴离子交换,通过此法为钒渣水浸液的高效资源化利用提供了可行的新途径。
3 结论
1) 实验结果表明,N-辛基吡啶类离子液体对V(Ⅴ)萃取效果良好。[OPy]Cl萃取V(Ⅴ)最适宜的条件如下:萃取时间为60 s,pH=2.957~8.029,温度为25 ℃。在该条件下,[OPy]Cl 对V(Ⅴ)的萃取率为95.42%。[OPy][BF4]萃取V(Ⅴ)最适宜的条件如下:萃取时间为40 s,pH=2.957~8.029,温度为25 ℃。在该条件下,[OPy][BF4]对V(Ⅴ)的萃取率为93.52%。
2) 结合离子选择性电极法、斜率法、紫外−可见光谱分析法、红外光谱分析法研究并确定N-辛基吡啶类离子液体萃取V(Ⅴ)的过程符合阴离子交换,主要是吡啶阳离子[OPy]+起作用,萃合物结构为[OPy]2[HVO4]。
3) 利用N-辛基吡啶类离子液体萃取钒渣水浸液中的钒具有一定的应用性以及创新性。
[1] ZHANG Guo-yuan, ZHANG Ting-an, LÜ Guo-zhi, ZHANG Ying,LIU Yan, LIU Zhuo-lin. Extraction of vanadium from vanadium slag by high pressure oxidative acid leaching[J]. Metallurgy and Materials, 2015, 22(1): 21−22.
[2] WANG Ming-yu, ZHANG Gui-qing, WANG Xue-wen,ZHANG Jia-liang. Solvent extraction of vanadium from sulfuric acid solution[J]. Rare Metals, 2009, 28(3): 209−211.
[3] 储满生, 唐珏, 柳政根, 应自伟. 高铬型钒钛磁铁矿综合利用现状及进展[J]. 钢铁研究学报, 2017, 29(5): 335−343. CHU Man-sheng, TANG Yu, LIU Zheng-gen, YING Zhi-wei. The status and progress of comprehensive utilization of high chromium vanadium-titanium magnetite[J]. Journal of Iron and Steel research, 2017, 29(5): 335-343.
[4] 王学文, 王明玉, 付自碧, 孟钰麒, 高大雄, 陈边防. 钒渣提钒工艺过程钒铬分离现状及展望[J]. 钢铁钒钛, 2017, 38(6): 1−5. WANG Xue-wen, WANG Ming-yu, FU Zi-bi, MENG Yu-qi, GAO Da-xiong,CHEN Bian-fang. Present status and prospects of vanadium and chromium separation in vanadium extraction from vanadium-chromium slag[J]. Iron Steel Vanadium and Titanium, 2017, 38(6): 1−5.
[5] 高官金, 彭 毅, 曹宏斌. 钒铬溶液离子交换法提钒研究[J]. 钢铁钒钛, 2015, 36(5): 1−5. GAO Guan-jin, PENG Yi, CAO Hong-bin. Study on vanadium extraction of vanadium chromium solution by ion exchange method[J]. Iron Steel Vanadium and Titanium, 2015, 36(5): 1−5.
[6] 张 东. 钒铬还原渣资源化利用技术进展[J]. 有色冶矿, 2014, 30(5): 52−54. ZHANG Dong. The approach to reclamation of vanadium- chromium slag[J]. Non-ferrous Mining and Metallurgy, 2014, 30(5): 52−54.
[7] STE´PHANIE B, AMINOU M, LAURENT D. Efficient extraction of gold from water by liquid-liquid extraction or precipitation using hydrophobic ionic liquids[J]. Royal society of chemistry, 2014, 38: 5573−5581.
[8] 康海涛. 1-烷基-3-甲基咪唑六氟磷酸盐做稀释剂萃取铀(Ⅵ)的研究[D]. 东华理工大学, 2016: 55−56.KANG Hai-tao. Study on the extraction of uranium(Ⅵ) using 1-Alkvl-3-methylimidazolium Hexafluorophosphate diluents[D]. East China University of Technology, 2016: 55−56.
[9] SMITH D N, EDWARDS H G M, HUGHES M A, COURTNEY B. Odorless kerosene degradation and the formation of interfacial deposits during the alkaline solvent wash in the purex process[J]. Separation Science and Technology, 1997, 32(17): 2821−2849.
[10] HU Guo-ping, CHEN De-sheng, WANG Li-na, LIU Jing-chong, ZHAO Hong-xin, LIU Ya-hui, QI Tao, ZHAO Chang-qiao, YU Ping. Extraction of vanadium from chloride solution with high concentration of iron by solvent extraction using D2EHPA[J]. Separation and Purification Technology, 2014, 125: 56−59.
[11] LI Xing-bin, WEI Chang, WU Jun, LI Cun-xiong, LI Min-ting, DENG Zhi-gan, XU Hong-sheng. Thermodynamics and mechanism of vanadium(Ⅳ) extraction from sulphatemedium with D2EHPA, EHEHPA and CYANEX 272 in kerosene[J]. Transactions of Nonferrous Metals Society of China, 2012, 22(2): 461−466.
[12] HWANG L D, KIM H S , KIM B H , KANG M, PARK J W. Effect of potassium on alumina supported chromium oxide catalysts for methylene chloride oxidation[J]. Reaction Kinetics and Catalysis Letters, 2004, 81(2): 349−355.
[13] JIAO Tian-tian, ZHUANG Xu-lei, HE Hong-yan, ZHAO Li-hong, LI Chun-shan, CHEN Hong-nan, ZHANG Suo-jiang. An ionic liquid extraction process for the separation of indole from wash oil[J]. Green Chemistry, 2015, 17: 3783−3790.
[14] ZHOU Xia, LI Zai-jun, YUAN Rui, LIU Hui-zhen. A novel room temperature ionic liquid extraction spectrophotometric determination of trace germanium in natural water with methybenzeneazo salicylfluorone[J]. Chemical and Biosensors, 2006, 39: 863−877.
[15] KUMAR M P. Actinide ion extraction using room temperature ionic liquids: Opportunities and challenges for nuclear fuel cycle applications[J]. Dalton Transactions, 2017, 46: 1730−1747.
[16] DEFERM C, VOORDE M V D, LUYTEN J, OOSTERHOF H, FRANSAER J, BINNEMANS K. Purification of indium by solvent extraction with undiluted ionic liquids[J]. Green Chemistry, 2016, 18: 4116−4127.
[17] 魏君怡, 李 勇. 应用[Omim][BF4]为萃取剂分离钒铬渣酸浸液中钒/铬的研究[J]. 电镀与精饰, 2017, 39(8): 37−42. WEI Jun-yi, LI Yong. Separation of vanadium and chromium from chrome vanadium slag acid dipping by alkyl imidazoles ionic liquid as extractant[J]. Plating and Finishing, 2017, 39(8): 37−42.
[18] 林经萍, 刘耀池, 庄树新, 刘后芝, 孔 秀. 从高硅质钒矿浸出液中萃取钒的工艺研究[J]. 广州化工, 2015, 43(3): 70−71. LIN Jing-ping, LIU Yao-chi, ZHUANG Shu-xin, LIU Hou-zhi, KONG XiuTechnology of extracting vanadium from the siliceous navajoite acid-leaching solution with P204[J]. Guangzhou Chemical Industry, 2015, 43(3): 70−71.
[19] 汤正河, 孙纯国, 刘 璐, 汤德元. 从湿法磷酸副产品氟硅酸中提碘的研究[J]. 贵州工业大学学报(自然科学版), 2006, 35(4): 46−49. TANG Zheng-he, SUN Chun-guo, LIU Lu, TANG De-yuanResearchon the extraction of iodine from the wet process phosphoric acid by-product fluorosilicic acid[J]. Journal of Guizhou University of Technology (Natural Science Edition), 2006, 35(4): 46−49.
[20] 康贤取, 王 玉, 周司文, 朱光来, 唐晓闩, 汪小丽. 温度对吡啶离子液体性质影响的分子动力学模拟研究[J]. 原子与分子物理学报, 2017, 34(4): 728−733. KANG Xian-qu, WANG Yu, ZHOU Si-wen,ZHU Guang-lai, TANG Xiao-shuan, WANG Xiao-li. The influence of temperature on the properties of pyridinium ionic liquids study by molecular dynamics simulation[J]. Journal of Atomic and Molecular Physics, 2017, 34(4): 728−733.
[21] LIU Feng, NING Peng-ge, CAO Hong-bin,ZHANG Yi. Measurement and modeling for vanadium extraction from NaVO3-H2SO4-H2O system by primary amine N1923[J]. Chemical Thermo Dynamics, 2014, 80: 13−21.
[22] WOJCIECHOWSKA A, WIESZCZYCKA K, WOJCIECHOWSKA I, OLSZANOWSKI A.Lead(Ⅱ) extraction from aqueous solutions by pyridine extractants[J]. Separation and Purification Technology, 2017, 177: 239−248.
[23] NAYL A A, ALY H F. Solvent extraction of V(Ⅴ) and Cr(Ⅲ) from acidic leach liquors of ilmenite using Aliquat 336[J]. Transactions of Nonferrous Metals Society of China, 2015, 25(12): 4183−4191.
[24] 郑丽丽, 郭 晨, 刘会洲. 离子液体的红外光谱研究[D]. 光谱学与光谱分析, 2006, 26(7): 33−34. ZHENG Li-li, GUO Chen, LIU Hui-zhou. The FTIR study of ionic liquids[D]. Spectroscopy and Spectral Analysis, 2006, 26(7): 33−34.
[25] 赵志刚, 田 鹏, 张 璇, 秦天灵, 孟 波, 张 柏. 溴化N一正辛基吡啶的制备及其乙醇溶液的电导率[J]. 沈阳师范大学学报(自然科学版), 2012, 30(2): 262-264. ZHAO Zhi-gang, TIAN Peng, ZHANG Xuan, QIN Tian-ling, MENG Bo, ZHANG Bai. Conductivity of preparation of N-n-octylpyridine bromide and its ethanol solution[J]. Journal of Shenyang Normal University (Natural Science), 2012, 30(2): 262−264.
[26] POLOWCZYK I, CYGANOWSKI P, URBANO B F. Amberlite IRA-400 and IRA-743 chelating resins for the sorption and recovery of molybdenum(Ⅵ) and vanadium(Ⅴ): Equilibrium and kinetic studies[J]. Hydrometallurgy, 2017, 169: 496−507.
[27] JING Xiao-hua, NING Peng-ge, CAO Hong-bin,WANG Jian-you, SUN ZhiHigh-Performance recovery of Vanadium(Ⅴ) in leaching/aqueous solution by a reusable reagent-primary amine N1519[J]. Chemistry & Engineering, 2017, 10: 3096−3102.
Extraction mechanism of vanadium from vanadium slag leaching solution by N-Octylpyridine ionic liquids
ZHOU Chao, LI Yong, XUE Xiang-xin
(School of Metallurgy, Northeastern University, Shenyang 110819, China)
Vanadium is a vitally important strategic resource. At present, the main method to recover vanadium from vanadium slag which obtains from “blast furnace smelting-converter blowing vanadium” process of vanadium-titanium magnetite is hydrometallurgical technology, and the most applied method is solvent extraction. The study was designed to extract V(Ⅴ) from vanadium slag leaching solution by solvent extraction using N-Octylpyridine ionic liquids as extractant and 1-pentanol as diluent. Different parameters affecting the extraction process such as extraction temperature, equilibrium time and extraction pH were investigated. The extraction mechanism was also studied. The results show that under the optimal conditions of pH 2.957−8.029 and 25 ℃, the maxmium extraction rate reaches 95.42% with [OPy]Cl after 60 s and 93.52% with [OPy][BF4] after 40 s, respectively. Furthermore, based on the methods of ion selective electrode, slope analysis, ultraviolet-visible spectrum and infrared spectrum analysis, the mechanism of extraction is determined as anion exchange.
vanadium slag leaching solution; N-Octylpyridine ionic liquids; extraction mechanism
Project(U1502273) supported by the National Natural Science Foundation of China
2018-12-07;
2019-04-24
LI Yong; Tel: +86-13709847505; E-mail: liyong@smm.neu.edu.cn
1004-0609(2020)-01-0172-08
O652.62
A
10.11817/j.ysxb.1004.0609.2020-37478
国家自然科学基金资助项目(U1502273)
2018-12-07;
2019-04-24
李 勇,副教授,博士;电话:13709847505;E-mail:liyong@smm.neu.edu.cn
(编辑 王 超)
