功能MRI联合临床预后因素预测同步放化疗治疗宫颈鳞癌疗效
2020-04-02何剑莉田海萍丁伟伟冯少彤
杨 蔚,杨 妍,何剑莉,田海萍,丁伟伟,冯少彤
(1.宁夏医科大学总医院肿瘤医院放射科,3.放疗科,宁夏 银川 750004;2.中国人民解放军联勤保障部队第九四二医院信息科,宁夏 银川 750004;4.宁夏医科大学总医院病理科,宁夏 银川 750004)
宫颈癌是女性常见的恶性肿瘤,占发展中国家女性癌症相关死亡的第2位[1]。对于失去手术机会的晚期宫颈癌患者,放射治疗及化学治疗是主要治疗手段,而首次治疗一旦失败,补救性治疗往往效果有限[2]。虽然肿块大小、病理类型、临床分期、淋巴结转移等已作为临床预后因素指导宫颈癌治疗,但对于病情相似患者,治疗结果仍有不同[3]。早期准确预测治疗效果至关重要。MRI功能成像技术DWI对病变敏感,可比常规MRI更早发现病变的变化[4]。ADC可提供与细胞构成等相关重要信息[5]。动态增强MRI(dynamic contrast enhanced MRI, DCE-MRI)可反映肿瘤灌注和氧合状态[6],是评价肿瘤血供最常用的方法。本研究探讨DWI及DCE-MRI联合临床预后因素(clinical prognostic factor, CPF)预测宫颈鳞癌同步放化疗(concurrent chemoradiotherapy, CCRT)效果的效能,旨在为个性化治疗宫颈癌提供依据。
1 资料与方法
1.1 一般资料 收集2016年12月—2018年1月59例于宁夏医科大学总医院肿瘤医院接受CCRT的宫颈鳞癌患者,年龄31~75岁,中位年龄48岁;根据国际妇产科联盟(International Federation of Gynecology and Obstetrics, FIGO)分期方法, 3例Ⅰ期,35例Ⅱ期,18例Ⅲ期,3例Ⅳ期。
1.2 仪器与方法 采用GE Signa excite HD 3.0T MR诊断仪,对所有患者于CCRT治疗前和治疗后3个月行盆腔MR检查。DWI采用单次激发平面回波成像序列行横断位扫描,b值为1 000 s/mm2。DCE-MRI采用三维容积超快速多期动态T1W序列,以速率 2 ml/s注射对比剂Gd-DTPA 0.2 mmol/kg体质量后,于0、30、60、90、120、150、180 s重复扫描,共采集7期图像。
1.3 图像分析 将原始数据导入GE ADW 4.4后处理工作站,获得ADC图像。由2名分别具有9年及19年腹部影像学诊断经验的主治医师及主任医师根据治疗前DWI包括肿瘤实体部分的所有连续层面图像,避开肿瘤囊变、坏死或出血等区域,于对应ADC图上手动勾画肿瘤边缘为ROI,得到各层面ADC值,以其均值为肿瘤的ADC值;于DCE-MRI最大实体部分的肿瘤层面图像上,分别于低和高强化区域手动勾画2个大小约40~50 mm2的圆形或椭圆形ROI(图1),软件自动生成时间-信号强度曲线(time-signal intensity curve, TIC),计算最大上升斜率(maximum slope of increase, MSI)、信号增强率(signal enhancement ratio, SER)和最大下降斜率(maximum slope of decrease, MSD)。MSI=(SImax-SIpre)/SIpre;SER=(SImax-SIpre)/(SIlast-SIpre);MSD=(SImax-SIlast)/SImax,其中SIpre为肿块平扫信号强度,SImax为肿块增强扫描中最大信号强度,SIlast为肿块增强扫描结束后的信号强度[7]。
1.4 治疗前CPF 临床预后因素包括肿块大小、FIGO分期及盆腔和腹主动脉旁淋巴结是否转移。以淋巴结短径≥1 cm为阳性淋巴结。以肿块最大径线≥4 cm,或FIGO分期Ⅲ~Ⅳ,或淋巴结阳性为CPF不利;同时具备肿块最大径线<4 cm、FIGO分期Ⅰ~Ⅱ和淋巴结阴性3个条件为CPF有利。
1.5 治疗效果评价 根据治疗效果将所有患者分为无肿瘤残余组和肿瘤残余组。无肿瘤残余定义:完成治疗后随诊3个月,同时具备:①T2WI未发现肿瘤,且治疗前肿瘤相应区域DWI未见高信号、DCE-MRI未见异常强化;②妇科检查宫颈状态良好,未见糜烂充血及肿块;③宫颈刮片脱落细胞学检查未见恶性细胞;④血清肿瘤标志物检测阴性。肿瘤残余定义:完成治疗后随诊3个月,T2WI可见残余肿瘤,治疗前DWI及DCE-MRI于肿瘤相应区域可见高信号及异常强化;结合以下三项进行综合评判:①妇科检查宫颈糜烂充血或可见肿块;②宫颈刮片脱落细胞学检查可见恶性细胞;③血清肿瘤标志物检测阳性。
1.6 统计学分析 采用SPSS 17.0统计分析软件。以±s表示计量资料,以百分比表示计数资料。采用Pearson卡方检验比较2组间FIGO分期及淋巴结转移差异,独立样本t检验分析2组间肿块大小以及MRI结果差异。绘制差异有统计学意义MRI参数的ROC曲线,并计算其AUC,评估诊断效能,分析MRI参数及CPF预测宫颈鳞癌治疗后肿瘤残余的概率。采用单因素和多因素Logistic回归分析宫颈鳞癌CCRT的预后因素。P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。

图1 患者女,49岁,宫颈低分化鳞状细胞癌ⅣA期,同步放化疗结束后肿瘤残余,治疗前盆腔MRI A.轴位T1WI示肿块呈不规则等低信号(箭); B.矢状位T2WI示肿块呈不规则等高信号(箭),与膀胱后壁关系密切; C.矢状位增强T1WI示肿块不均匀强化(短箭为低强化区,长箭为高强化区); D.轴位DWI图像示肿块明显高信号(箭); E.矢状位动态增强T1WI示宫颈癌强化信号不均匀,分别于高强化区及低强化区勾画ROI; F.相应TIC示低强化区血供差,存在缺血缺氧
2 结果
对所有患者均完成CCRT及相应检查。59例中,19例存在肿瘤残余,40例无残余。肿瘤残余组治疗前肿瘤低强化区域的MSI(MSIL)和SER(SERL)低于无肿瘤残余组(P均<0.01),而ADC值、患者FIGO分期和淋巴结转移例数均高于无肿瘤残余组(P均<0.05);2组间治疗前肿块大小、高强化区域MSI(MSIH)、SER(SERH)、MSD(MSDH)及低强化区域MSD(MSDL)差异均无统计学意义(表1、2)。
绘制治疗前MSIL、SERL和ADC值评价CCRT效果的ROC曲线见图2。治疗前MSIL评价宫颈癌CCRT效果的诊断效能高于SERL。治疗前MSIL联合ADC值预测宫颈癌CCRT后肿瘤残余的诊断效能高于单一MRI参数;MRI联合CPF多参数的诊断效能最高(表3)。患者治疗前ADC值和MSIL均不满足阈值时,治疗后肿瘤残余概率为100%(14/14);如2个参数均满足阈值,治疗后肿瘤残余概率仅为3%(1/32);仅1个参数不满足阈值时,治疗后肿瘤残余概率为30.77%(4/13)。患者治疗前ADC值和MSIL均不满足阈值及CPF不利时,治疗后肿瘤残余概率100%(14/14);而如治疗前ADC值和MSIL均满足阈值及CPF有利,治疗后肿瘤残余概率为0(0/7);若治疗前ADC值和MSIL均满足阈值而CPF不利,治疗后肿瘤残余机率为4.00%(1/25)。当患者CPF有利而治疗前仅ADC值和MSIL之一满足阈值时,治疗后肿瘤残余概率100%(1/1);CPF不利而治疗前仅ADC值和MSIL之一满足阈值时,治疗后肿瘤残余概率为25.00%(3/12)。
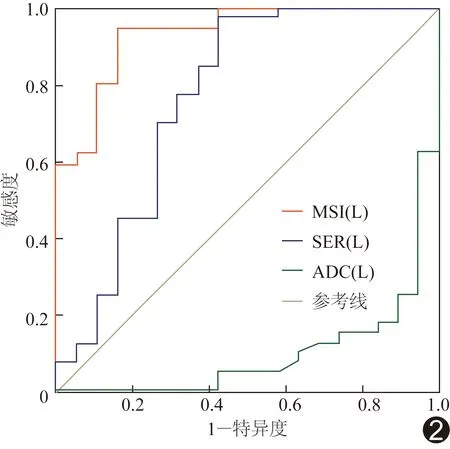
图2 治疗前肿瘤MSIL、SERL和ADC值的ROC曲线

表1 2组间治疗前临床预后因素比较
表2 2组间治疗前肿瘤区域MRI结果比较(±s)

表2 2组间治疗前肿瘤区域MRI结果比较(±s)
组别MSIHSERHMSDHMSILSERLMSDLADC(×10-3 mm2/s)肿瘤残余组(n=19)1.87±0.561.24±0.890.13±0.030.46±0.240.80±0.260.10±0.071.08±0.24无肿瘤残余组(n=40)1.91±0.241.27±0.430.12±0.061.32±0.821.04±0.270.08±0.080.83±0.10t值1.141.080.496.243.181.296.00P值>0.05>0.05>0.05<0.01<0.01>0.05<0.01
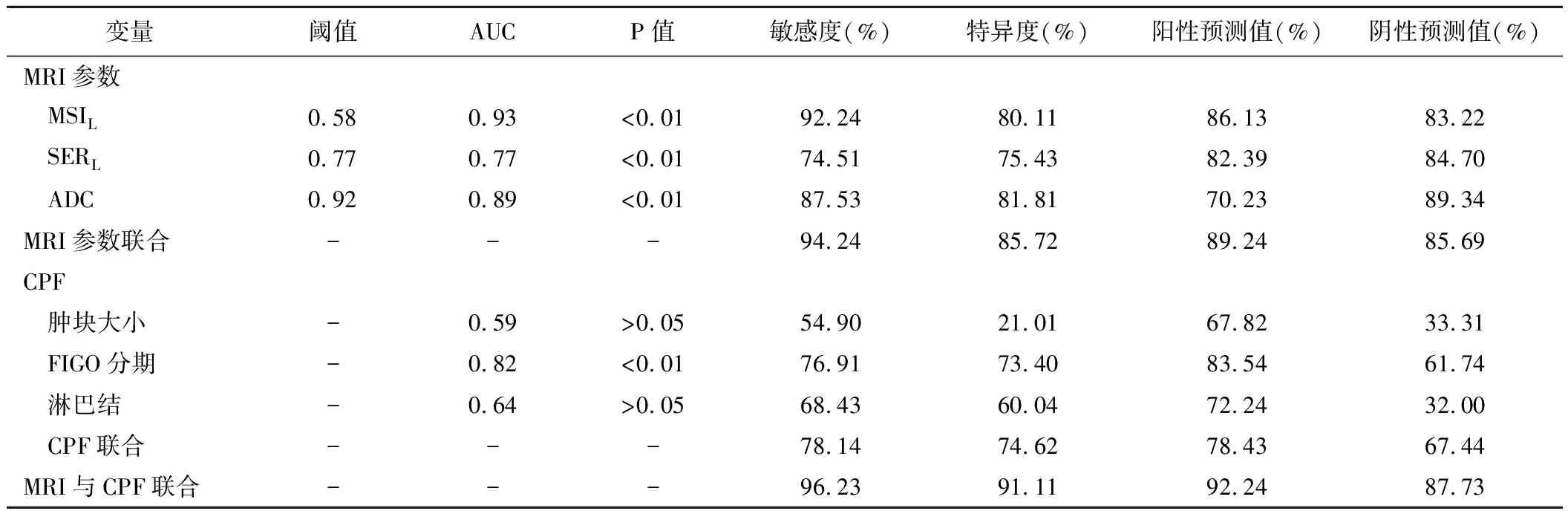
表3 MRI和CPF参数单独及联合预测宫颈鳞癌治疗后肿瘤残余的效能
MRI参数和CPF单因素及多因素Logistic分析宫颈癌治疗后肿瘤残余危险因素结果(表4)显示,治疗前MSIL和ADC值是宫颈癌治疗后肿瘤残余的独立预测因素。

表4 MRI参数和CPF的单因素及多因素Logistic分析宫颈癌治疗后肿瘤残余的危险因素
3 讨论
MR功能成像技术迅速发展,有望成为潜在的影像生物学标记物,在临床诊断中发挥重要作用。
本研究结果显示,CCRT后肿瘤残余组患者治疗前ADC值高于无肿瘤残余组,与既往研究[8]一致。文献[9]指出,ADC值增高是肿瘤坏死的标志。肿瘤增殖过程中缺血、缺氧及内部坏死使水分子运动增强,致ADC值升高。射线杀伤肿瘤细胞DNA主要依靠氢氧自由基,后者是射线于有氧状态下照射肿瘤时产生。肿瘤缺氧时,氢氧自由基生成减少,射线的杀伤力减弱,导致放射治疗抵抗。
本研究中2组间治疗前宫颈癌高强化区MSI和SER差异无统计学意义,而低强化区的MSI和SER是预测肿瘤残余的重要参数,与既往研究[10]相符。既往研究[11]通过对比宫颈癌MRI动态增强表现与组织病理,发现肿瘤具有异质性,强化明显区域血供丰富,微循环灌注好,含氧量多;而弱强化的区域灌注差,毛细血管相对较少,缺血缺氧,对放射治疗产生抵抗;且肿瘤体积大而强化明显的宫颈癌患者5年生存率(55%)显著低于肿瘤体积小而强化程度低者(92%)[12]。MAYR等[13]证实肿瘤低强化区域对治疗效果具有关键性的制约作用,根据低强化区域比高强化区域更能准确预测异质性肿瘤对于治疗的反应。
肿瘤内异常丰富而不成熟的微血管在TIC中显示出更高的信号强度和更快的信号变化。MSI是TIC上升最陡峭段的斜率,代表微循环血液流入的速度,是反映血流量的直接指标;SER主要反映微循环血容量;MSD是TIC下降最为陡峭一段的斜率,代表微循环血液流出的速度,与血管壁通透性相关。本研究中无肿瘤残余组MSIL和SERL均高于残余组,提示肿瘤血供丰富、含氧量多时对放射治疗敏感,预后较好,与既往研究[14]结果一致。
本研究中MRI参数的预测效能优于CPF,在预测CCRT治疗宫颈鳞癌效果中发挥主导作用,而CPF是其重要补充;二者联合可进一步提高MR功能成像的预测能力,为个体化治疗宫颈鳞癌患者提供有价值的信息。早期预测结果显示CCRT失败风险高时,可采用更积极的治疗,如增加放射剂量、使用增敏剂,甚至改变治疗方案,以避免治疗不充分;②对低风险患者,可降低放射剂量,尽可能保护周围组织器官功能,降低放射及化学治疗毒性和医疗成本。
综上所述,治疗前MSIL和ADC值是宫颈鳞癌CCRT后肿瘤残余的独立预后因素;功能MRI多参数联合CPF可提高预测宫颈鳞癌CCRT疗效的效能,为个性化治疗宫颈癌提供依据。本研究中无肿瘤残余组未经病理学检查证实,有待进一步完善。
