基于体素观察慢性阻塞性肺疾病肺叶损伤程度及空间分布
2020-04-02师美娟梁志冉杨全新金晨望郭佑民
师美娟,梁志冉,沈 聪,魏 霞,杨全新*,金晨望,郭佑民
(1.西安交通大学第二附属医院影像科,陕西 西安 710004;2.西安交通大学第一附属医院影像科,陕西 西安 710061;3.西安市第九医院影像科,陕西 西安 710003)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)患病率及致死率高[1],其病理改变为小气道病变(functional small-airway disease, fSAD)和肺实质损伤[肺气肿(emphysema, Emph)],最终导致进行性气流受限[2]。目前临床以肺功能为金标准诊断COPD,其影响因素多,无法定量测定Emph和fSAD,且反映的是肺整体功能,无法对各肺叶Emph和fSAD进行分析和局部定位[3];目前国际上广泛应用基于体素的定量CT对COPD患者肺功能进行定量分析[4]。本研究利用基于体素的定量CT观察COPD患者肺叶损伤程度及空间分布,为有效评价COPD疾病发生发展及预测疗效奠定基础。
1 资料与方法
1.1 一般资料 以2015年3月—2016年12月“数字肺”多研究中心中纳入的79例接受双气相扫描的COPD患者为研究对象。纳入标准:①有吸烟、慢性咳嗽、咳痰或呼吸困难史;②接受肺功能检查,且吸入支气管扩张剂后1秒用力呼气容积(forced expiratory volume in one second, FEV1)/用力肺活量(forced vital capacity, FVC)<0.70;③CT吸气及呼气图像完整;④吸气相及呼气相图像显示肺裂清晰,软件能正确分割;⑤患者对检查目的及扫描方法知情同意,并签署知情同意书。排除标准:①图像质量差;②肺内占位性病变如肺癌等;③既往胸部手术史;④胸廓畸形;⑤并发影响观察的肺部疾患,如肺实变、肺大面积感染、肺不张、重度肺间质纤维化及大量胸腔积液等;⑥并发呼吸系统其他疾病,如支气管哮喘、支气管扩张、肺结核及肺动脉高压等;⑦肺梗死或急性肺栓塞;⑧并发其他系统疾病如心、肝、肾功能不全;⑨尘肺等职业性粉尘接触者。
1.2 CT扫描 扫描前进行呼吸训练。使用GE、Siemens、Philips 64层及以上CT扫描仪。嘱患者仰卧,双手抱头,头先进。先于深吸气末、再于深呼气末行全肺扫描。参数:吸气相管电压120 kV,管电流200 mA;呼气相管电压120 kV,管电流50 mAs。机架旋转时间0.5 s/rot,螺距0.5,矩阵512×512。以骨算法重建数据,重建层厚1 mm,重建间隔0.625 mm。
1.3 肺功能检查 在咳嗽、咳痰症状稳定状态下,于CT扫描后3天内行肺功能检查(pulmonary function test, PFT)。使用体积描记仪Master lab(Jaeger,Germany) 采集肺功能数据,取坐位测肺功能,测量FEV1/FVC及1秒用力呼气容积率(FEV1%);之后予患者吸入沙丁胺醇200 μg(100 μg/支,2喷),之后瞩其屏气10 s,15~20 min后再次测量FEV1/FVC及FEV1%值。
1.4 图像分析 将双相CT图像导入“数字肺”软件数据分析平台,由2名分别具有20年、35年阅片经验的放射科医师参照文献[5] 方法进行数据处理。
1.5 统计学分析 采用SPSS 20.0软件行数据处理。计量资料用±s表示,以Shapiro-Wilk检验(W检验)行正态性检验;采用方差分析及多重比较LSD检验比较COPD患者各肺叶间Emph损伤,Kruskal-Wallis检验及多重比较(LSD-t检验)比较各肺叶间fSAD损伤、Emph及fSAD肺叶分布;使用单因素回归分析各肺叶定量CT分布与肺功能的相关性,决定系数R2值高,所起作用越大。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 50例符合纳入标准,年龄35~84岁,平均(64.6±7.8)岁;男44例,女6例,平均身高(159.18±39.63)cm,平均体质量(70.80±20.51)kg,体质量指数(24.41±6.32)kg/m2。按照COPD全球倡议(global initiative for chronic obstructive lung disease, GOLD)分级,1级4例,2级21例,3级15例,4级10例;FEV1%为(46.84±18.22)%,FEV1/FVC为(54.87±9.86)%。
2.2 各肺叶病变损伤程度 肺叶损伤参数值为损伤体积与该肺叶总体积的百分比。右肺上叶(right upper lobe, RUL)、左肺上叶(left upper lobe, LUL)及右肺中叶(right middle lobe, RML)的Emph及fSAD较重;“数字肺”软件处理定量结果显示,RUL、RML、右肺下叶(right lower lobe, RLL)、LUL及左肺下叶(left lower lobe, LLL)的Emph定量值分别为33.21、16.51、6.30、24.83及5.71,fSAD定量值分别为39.04、33.58、23.76、39.32及20.72,且患者RUL、LUL及RML的Emph及fSAD较重。见图1。

图1 患者男,58岁,GOLD 3级COPD A.经“数字肺”软件处理的Emph及fSAD效果图; B.CT图像
5个肺叶Emph程度总体差异有统计学意义(P=0.010),RUL重于RLL、LLL(P=0.012、0.030),LUL重于RLL、LLL (P=0.020、0.046),RML重于RLL、LLL (P=0.007、0.018),其余两两比较差异均无统计学意义(P均>0.05)。5个肺叶fSAD程度总体差异有统计学意义(P<0.001),RUL重于RLL、LLL (P=0.014、0.008),LUL重于RLL、LLL (P=0.003、0.002),RML重于RLL、LLL(P均<0.001),其余两两比较差异无统计学意义(P均>0.05)。Emph与fSAD均以RML最重,RUL、LUL次之,而RLL、LLL程度最轻。见图2。
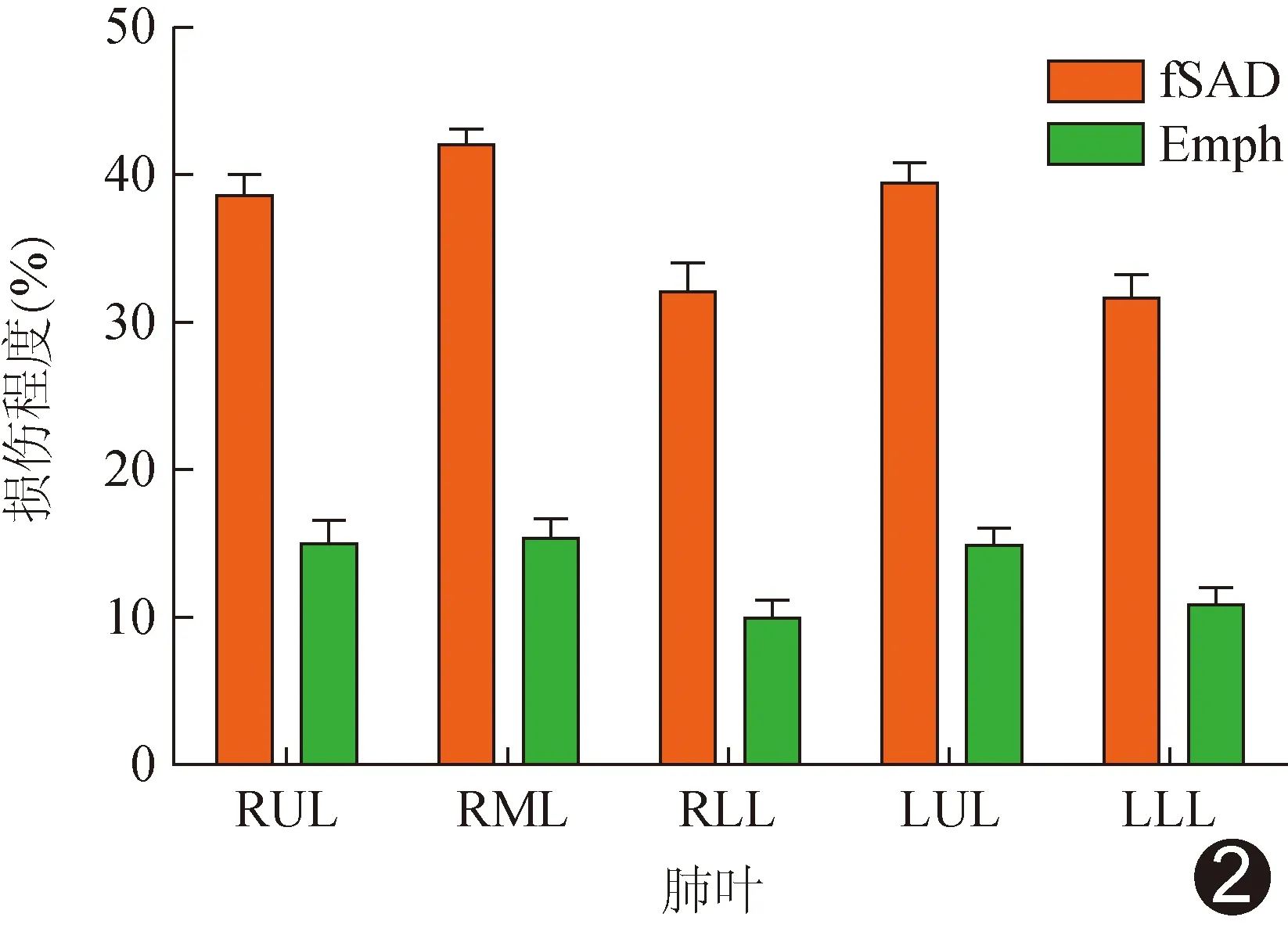
图2 COPD患者fSAD和Emph肺叶损伤程度
2.3 各肺叶Emph及fSAD分布 肺叶分布参数值为该肺叶体积与全肺体积的百分比。全肺组织(whole lung, WL)、RUL、RML、RLL、LUL及LLL的Emph分布定量值分别为31.52、12.77、1.86、2.62、11.74及2.55,fSAD的分布定量值分别为35.53、9.03、3.59、6.84、9.95及6.11。定量结果显示Emph及fSAD主要分布于RUL和LUL。见图3。
Cruskal-Wallis秩和检验结果显示5个肺叶Emph分布总体差异有统计学意义(P<0.001),LUL大于RUL、RML、RLL及LLL (P<0.001、<0.001、0.005及0.002),RUL大于RML (P=0.005),其余两两比较差异无统计学意义(P均>0.05)。5个肺叶fSAD分布总体差异有统计学意义(P<0.001),RUL与RLL、RML差异有统计学意义 (P=0.013、0.013),LUL与RLL、LLL差异有统计学意义(P均<0.001),其余两两比较无统计学差异。Emph与fSAD均主要分布于LUL,其次是RUL,而RML分布最少。见图4。
2.4 各肺叶定量CT分布与肺功能的相关性 Emph和fSAD损伤均为两肺下叶与FEV1%的相关性较好,Emph及fSAD损伤与FEV1/FVC的相关性见表1、2。
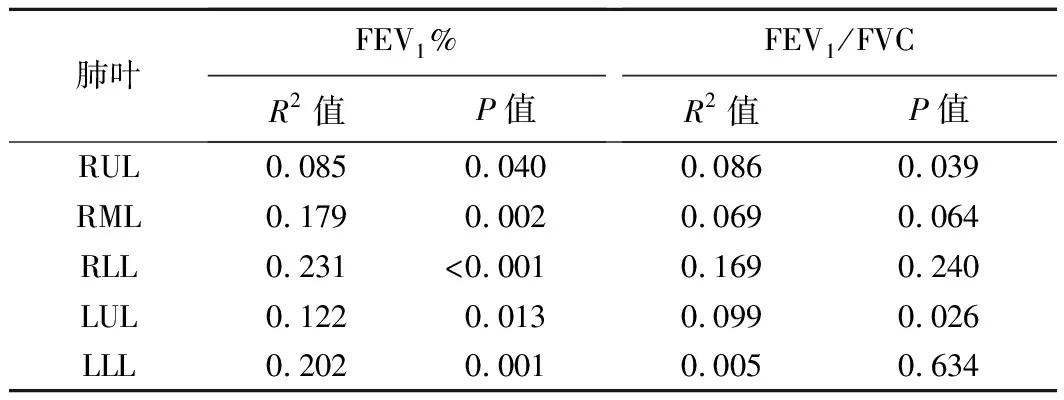
表1 Emph与FEV1%及FEV1/FVC的单因素回归分析结果
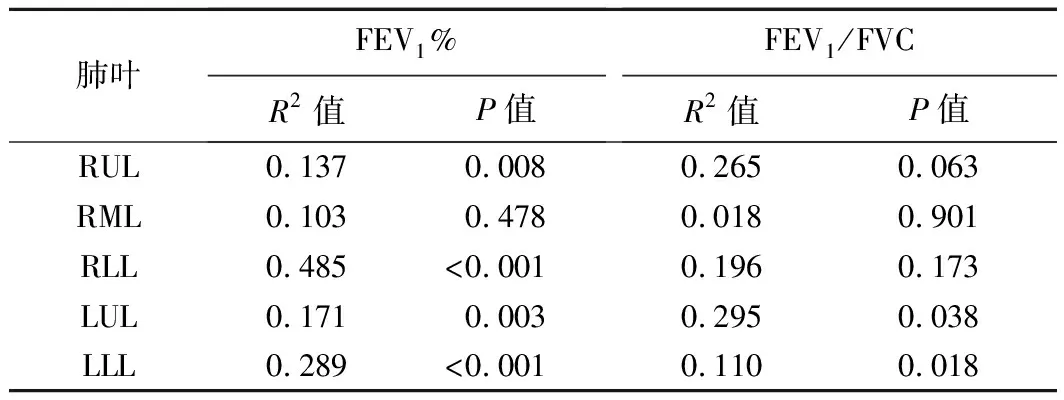
表2 fSAD与FEV1%及FEV1/FVC的单因素回归分析结果

图3 患者男,58岁,GOLD 3级COPD A.经“数字肺”软件处理的Emph及fSAD分布效果图; B.CT图
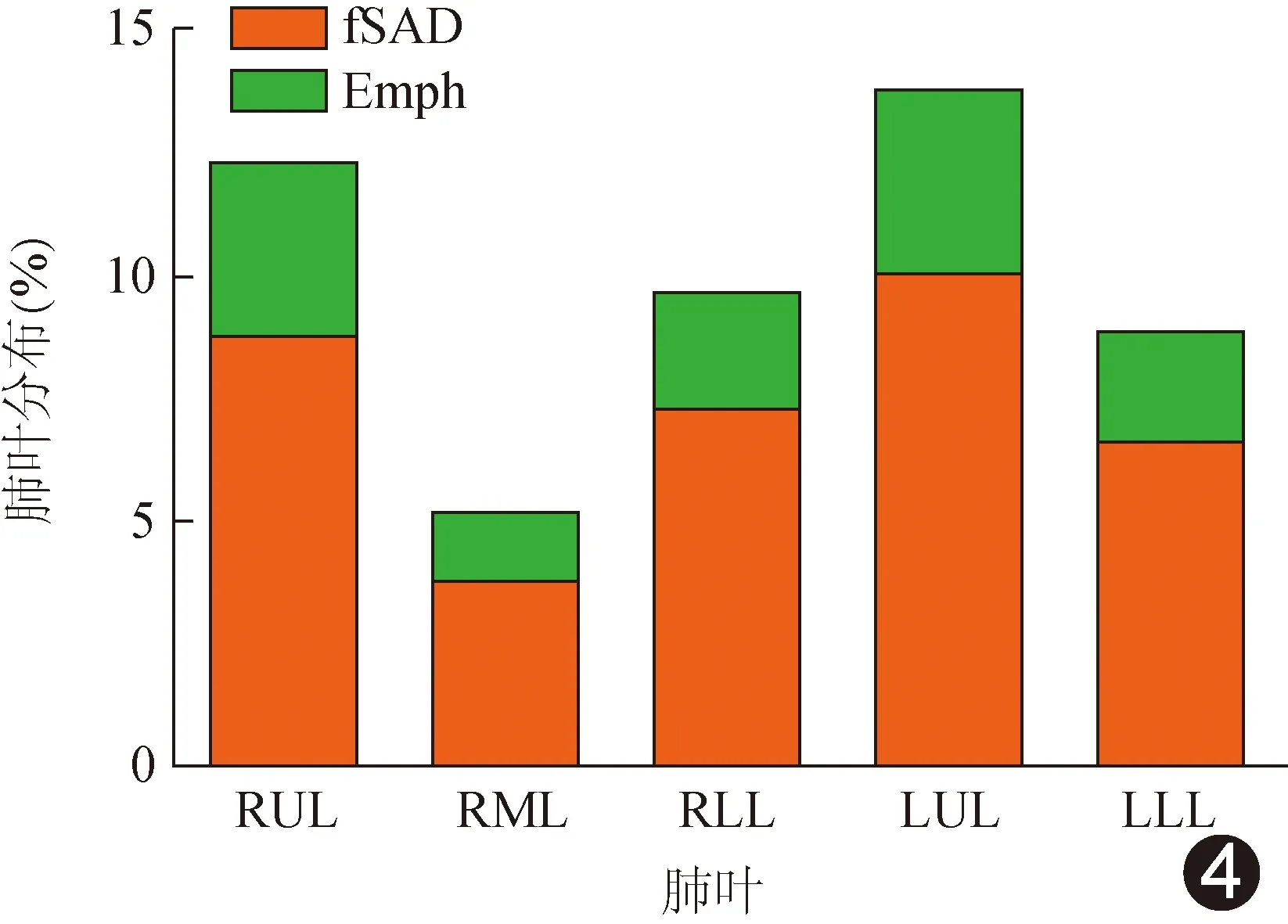
图4 COPD患者Emph和fSAD肺叶分布
3 讨论
3.1 COPD肺叶损伤主要以RML及两肺上叶为重 RML最易受损的原因首先在于解剖结构上RML管腔窄且长,角度较锐利,较其他肺叶更易出现通气不足[6-7];其次,通气及灌注因素可致RML及左肺舌叶存在严重换气不足[8];再次,RML支气管解剖特点使其极易感染,且不易将感染阻塞物排出;最后,由于肺裂分割,RML较其他肺叶更为孤立,发生不张或通气不良时,再膨胀的可能性小,形成恶性循环[9]。
造成两肺上叶损伤较两肺下叶更重的原因首先在于上叶胸膜腔负压高于肺底[7];其次,两肺上叶及下叶均发生缺氧时,首先需要保证下叶得到足够灌注,而上叶的再灌注效力不强,故易发生气体潴留[10]。
3.2 Emph及fSAD主要分布于两肺上叶(RML最少) LUL体积最大,对WL贡献最大。RML体积最小,对WL贡献最小[10]。研究[11-12]发现Emph最初发生于两肺上叶,继而向两肺下叶进展。本组COPD患者多为GOLD 2级和3级,4级较少;尽管Emph及fSAD均以RML最重,但RML体积小,故总体结果显示病变主要分布于两肺上叶。
3.3 两肺下叶损伤分布更能反映COPD严重程度 两肺下叶损伤分布主要影响COPD患者肺功能改变。因此,根据两肺下叶定量CT参数改变,可间接评估患者肺功能程度。两肺下叶胸廓内压较两肺上叶更负,用力呼气时,两肺下叶更易发生塌陷[10]。在COPD早期阶段,Emph主要发生于两肺上叶;随着病变进展,逐渐进展至两肺下叶,两肺下叶存在损伤时,肺功能下降非常迅速[11]。发生缺氧、通气血流不均时,两肺下叶迅速发生血流再灌注,使其具有一定代偿能力,而上叶代偿能力较差。两肺上叶发生损伤时,早期肺功能可无异常;而两肺下叶发生损伤、失去代偿能力后,可出现肺功能迅速下降[10]。另外,受重力影响,站位及坐位时,气道于两肺下叶时出现闭合,加重两肺下叶病变分布对于气流的影响。
3.4 定量观察COPD肺叶损伤的临床意义 评估各肺叶Emph及fSAD具有重要临床意义,有助于对COPD患者进行更精细的亚型划分[10],并可在PFT未检出异常时早期评估各肺叶损伤程度,利于筛选需要接受肺减容手术或支气管瓣膜治疗的Emph较重的COPD患者[6]。研究[13]发现,肺叶定量结果有助于预测术后肺功能改善:Emph位于两肺上叶时,肺减容手术效果较好,且术后FEV1增加;反之,两肺下叶Emph为主时,术后患者死亡可能性较大。另有研究[14]发现,Emph集中于两肺下叶更能预测急性发作。两肺下叶Emph为主时,病程会不断进展,肺功能下降速度更快。COPD合并肺癌时,定量观察 COPD肺叶损伤对于选择手术适应证具有重要价值[10],并可在一定程度上为靶向治疗提供依据[15]。
本研究样本量小,且主要为中度及重度COPD患者,有待扩大样本量进一步完善。
综上所述,RML为COPD患者最易受损肺叶,但体积较小,对WL的贡献有限;两肺上叶易受损程度次之,早期对于WL的贡献较大;无论是早期还是晚期,两肺下叶均为影响肺功能改变的主要肺叶。
