核酸染色剂对DNA在琼脂糖凝胶电泳中迁移速度的影响
2020-04-01薄秀梅
薄秀梅
摘要 核酸染色应用在许多DNA检测相关的技术领域,然而染色剂结合DNA会造成电泳迟滞。为研究溴化乙锭(ethidium bromide,EB)和GelRed这2种核酸染色剂对DNA在琼脂糖凝胶电泳中迁移速度的影响,分别用这2种染色剂采用前、后染色的方法对DNA进行染色,以琼脂糖凝胶电泳作为检测方法,凝胶成像系统拍照观察,用Reptation理论分析数据。研究结果表明EB和GelRed染色均使DNA迁移发生了滞后,但EB对于目的基因片段大小的判读未受电泳滞后的影响,而GelRed对目的基因判读略有影响。然而,与EB相比,GelRed具有荧光效果强、安全、环保等诸多优点。总之,需要精确鉴定目的基因片段大小可以选择后染色或EB前染色,对于鉴定目的基因片段大小要求不高且需要荧光效果好、环保的染色剂可以选择GelRed。
关键词 EB;GelRed;迁移速度;琼脂糖凝胶电泳
中图分类号 Q5-33 文献标识码 A 文章编号 0517-6611(2020)03-0001-03
doi:10.3969/j.issn.0517-6611.2020.03.001
开放科学(资源服务)标识码(OSID):
Abstract Nucleic acid dye has been used in many DNA detectionrelated fields,but the combination of different dyes with DNA can lead to electric swimming lag. To analyze the effect on mobility of DNA fragments in agarose with ethidium bromide(EB) and GelRed, we used preand poststaining with the two dyes, and the agarose gel electrophoresis was used as the detection method.Then the gel imaging system took photos and analyzed the mobility of DNA fragments with Reptation theory. The results showed that the mobility of DNA was delayed by EB and GelRed, but the EB had no effect on the measurement of DNA fragments while GelRed can influence the size of DNA fragments. But it is much more sensitive, nontoxic and environmentally safe than EB. In conclusion, prestaining with EB and poststaining can measure the DNA fragments accurately. And we can use GelRed to replace EB when the concentration of the samples is low and an environmentsafe dye is needed.
Key words EB;GelRed;Migration velocity;Agarose gel electrophoresis
核酸染色應用领域广泛,如DNA指纹技术、基因工程中鉴定DNA片段的大小、重组子鉴定等。使用琼脂糖凝胶电泳以及核酸染色剂可以简单快速地根据迁移距离结合分子量标准大致判断DNA片段的大小。DNA在电场中移动速度受到诸多因素影响,比如自身分子量、构象、电场电压、凝胶浓度、是否结合染色剂等[1],其中染色剂结合DNA会造成电泳迟滞,这一现象对于判断目的基因大小会有影响。溴化乙锭(EB)是最常用的核酸染色剂,EB具有致突变性,对环境会造成一定的污染[2]。近年来市场上出现了一些新型核酸染色剂替代EB,如SYBR safe、SYBR gold、SYBR Green Ⅰ、GelRed、GelGreen等,因GelRed与GelGreen具有安全、染色稳定、性价比高的特点,目前使用越来越多,而不同核酸染色剂使DNA产生电泳迟滞也不尽相同。染色方式根据电泳与染色的前后关系分为前染色与后染色,前染色是将染色剂预混在琼脂糖凝胶中,DNA在移动过程中结合染色剂形成染色剂-DNA复合体,电泳过程中可以随时观察DNA移动情况;后染色是电泳结束后再单独染色,染色剂用量较大。前者观察方便且染色剂用量少,应用广泛。
EB结合DNA形成EB-DNA复合物,增加了DNA分子量,同时改变了DNA的构象及所带电荷电量[3],使得DNA在电场中迁移速度发生改变。随着研究的深入,一些模型的建立可以很好地描述DNA在以琼脂糖凝胶为介质的电场中的移动情况,Ogston模型认为较小分子量的DNA片段可以通过凝胶孔径,它们的迁移速度与凝胶孔径形成的数量以及DNA分子量有关系[4]。Reptation理论认为DNA分子会反复通过排列密集的凝胶孔径,这些凝胶孔径连接起来就像形成了一根管子,因此可以看成DNA在一根管子中移动[5-7],这一模型成功地描述了小于40 kb的DNA分子在琼脂糖凝胶中的移动情况,其迁移率(u)和碱基对(N)的倒数成正比[8-9]。
GelRed是一种新型核酸染色剂,使用方法简便、染色优越、稳定性好。当它与DNA结合后形成GelRed-DNA复合物,对于DNA的改变与EB相似,包括DNA分子量增加、DNA构象改变等。笔者主要研究EB与GelRed结合DNA后在琼脂糖凝胶中的相对迁移速度变化特点。
1 材料与方法
1.1 材料
1.1.1 质粒与菌株。原核载体pXMCB-B2及菌种JM101为国家级基础医学实验教学示范中心保存。
1.1.2 主要试剂。PCR体系、分析级琼脂糖凝胶、质粒提取试剂盒购自Promega公司;凝胶纯化试剂盒购自生工(上海)生物工程有限公司;1 kb DNA Ladder、Gel Loading Dye(6×)购自NEB公司;GelRed Nucleic Acid Gel Stain 10 000×in Water购自Biotium公司;EB购自Sigma公司;1×TBE缓冲液(45 mmol/L Tris-Boric Acid,2 mmol/L EDTA,pH 8.3)为实验室配制。
1.2 方法
1.2.1 前染色1%凝胶配制。
称取1.2 g琼脂糖溶于120 mL 1×TBE缓冲液中,65 ℃水浴加热待琼脂糖全部溶解,量筒分别量取30 mL凝胶3份,分别加入GelRed 0(对照)、3 (10 000×)、6 μL(5 000×)混匀后灌至6 cm×6 cm胶槽中,然后放置于室温约1 h待其凝固;0.5 μg/mL EB凝胶的配制同GelRed。
1.2.2 后染色。
电泳结束后将凝胶放入1 mol/L NaCl中,含GelRed 3 300×,摇床低速染色30 min。
1.2.3 电泳。
将凝胶放入同一电泳槽,使用电压1.5 V/cm2,时间约60 min。
1.2.4 目的基因的扩增纯化。
以实验室保存质粒为模板,上游引物5′-GAGAGTCCATGGCCTCAG-3′,下游引物5′-GCAAGTCAAGCTTTATTCACTCTG-3′,扩增长度为711 bp的目的基因,测序正确后凝胶纯化、测定浓度后备用。
2 结果与分析
2.1 EB与GelRed染色特点
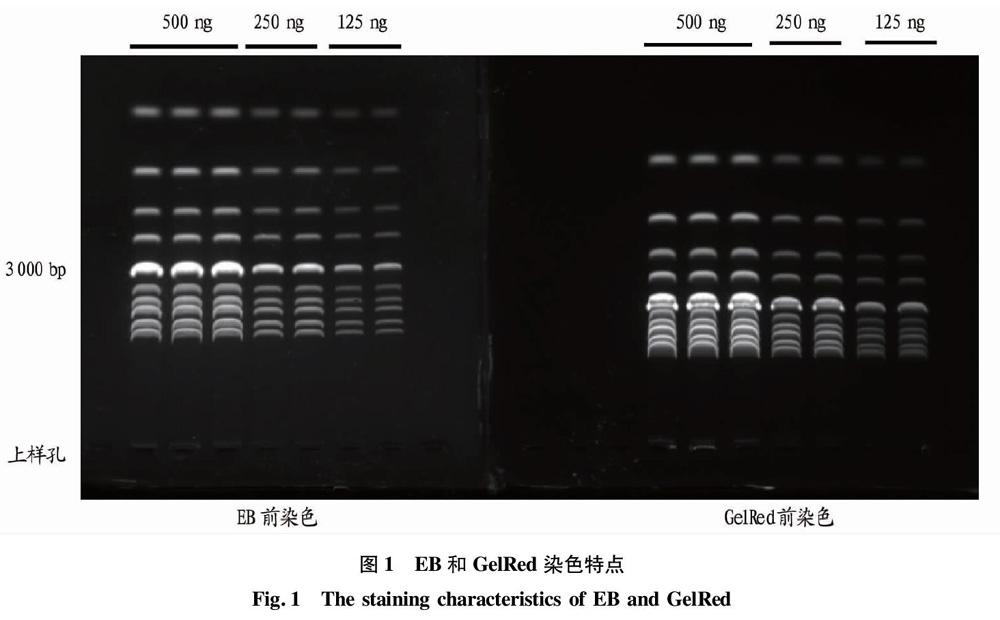
图1为2块凝胶,左图和右图分别使用EB(0.5 μg/mL)和GelRed(10 000×)作为染色剂,染色方式均为前染色,样品为1 kb DNA Ladder(NEB)。上样量分别为500、250、125 ng,电泳条件相同,电泳结束后将2块凝胶放入成像系统中,上样孔处于同一水平线,拍照观察,有如下几点现象:①EB染色较GelRed染色DNA迁移速度快;②DNA浓度对于迁移速度影响不明显;③随着浓度的降低荧光强度均出现不同程度的衰减;④对于大于3 000 bp的DNA片段,EB的分辨效果好于GelRed。
2.2 EB与GelRed均使DNA产生迁移滞后
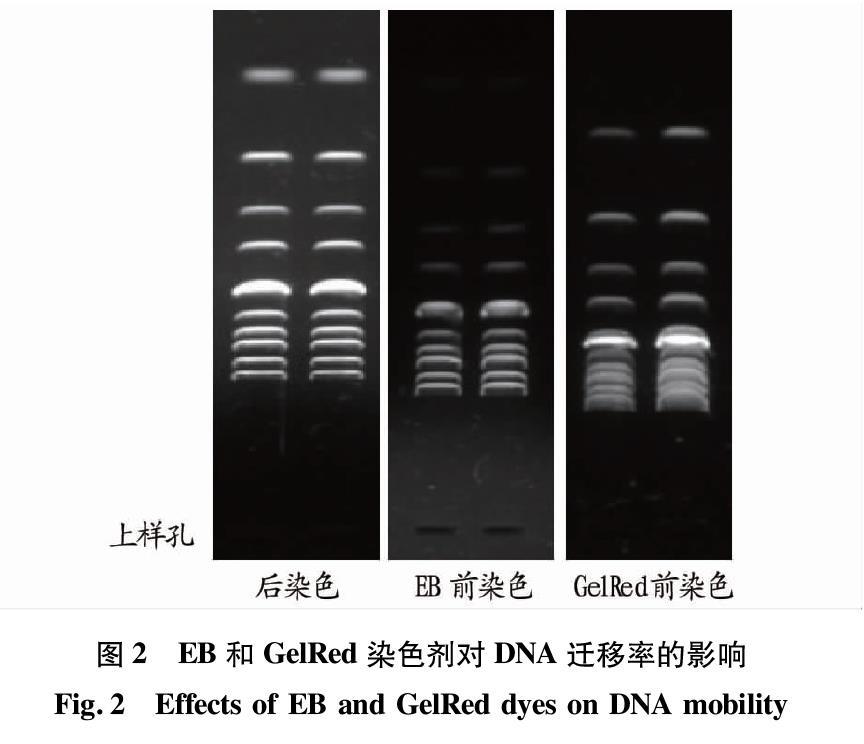
上述结果表明,250 ngDNA的上样量比较合适,且EB染色较GelRed染色迁移速度快。配制3块1%琼脂糖凝胶,其中1块无染色剂,另外2块分别加入染色剂EB(0.5 μg/mL)、GelRed(10 000×),样品为1 kb DNA Ladder(NEB),上样250 ng电泳条件相同。电泳结束后将无染色剂凝胶放入容器进行后染色,染色剂为GelRed(3 300×),时间30 min,染色结束后将3块凝胶放入成像系统,上样孔处于同一水平线拍照观察(图2)。结果表明,后染色DNA迁移速度最快,其次为EB前染色,GelRed前染色最慢,以上说明EB、GelRed结合DNA均使得DNA迁移滞后,但GelRed影响更大。
2.3 EB与GelRed染色剂使DNA迁移滞后对目的基因判读的影响
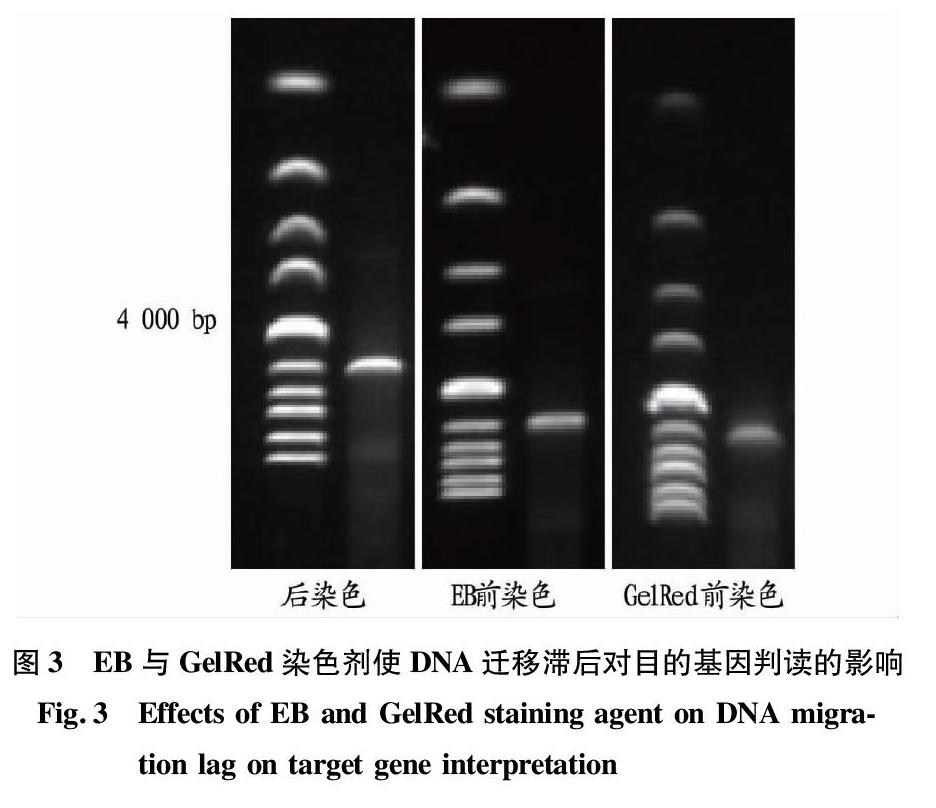
用琼脂糖凝胶电泳进一步检测染色剂结合DNA引起的迁移滞后对目的基因判读的影响分别制备3块凝胶,其中1块凝胶不含染色剂,另外2块胶分别加入EB和GelRed,终浓度为0.5 μg/mL、10 000×,使用1 kb DNA Ladder(NEB)作为分子量标准对已知的目的基因进行判读,该目的基因片段大小为3 973 bp,在相同条件下进行电泳,电泳结束后将无染色剂凝胶放入容器进行后染色,染色剂为GelRed(3 300×),时间30 min,染色结束后将3块凝膠放入成像系统(图3),发现后染色与EB前染色对于目的基因的判读基本一致,均为4 000 bp,而GelRed前染色目的基因移动速度比4 000 bp的分子量标准稍慢,由此可见后染色及EB染色对于目的基因的判读相对于GelRed准确。笔者认为,GelRed结合DNA使其迁移速度改变,这种变化对于目的基因的检测造成了一定程度的影响,而EB未发现这种现象。
2.4 用Reptation理论解释EB和GelRed结合DNA对目的基因判读的影响
Reptation理论认为在琼脂糖凝胶中移动的DNA片段其迁移率(u)和碱基对(N)的倒数成正比[8-9]。可以用Reptation理论来检测不同染色剂结合DNA后其迁移速度的变化特点。实验分为2组对比分析DNA结合染色剂后的迁移速度,第一组为后染色组(对照组)、0.5 μg/mL EB前染色组;第二组为对照组、10 000×GelRed前染色组、5 000×GelRed前染色组。凝胶制备及电泳条件均一致,用1 kb DNA Ladder(NEB)进行上样,上样量为250 ng,电泳结束后将对照组凝胶放入容器进行后染色,待染色结束后在放置标尺的凝胶成像系统中进行拍照,选取2 000、3 000、5 000、8 000、10 000 bp的DNA片段测量其迁移距离并记录,以1/N为横坐标,迁移距离为纵坐标,将数据录入Excel软件建立直角坐标系,如图4所示,DNA的迁移距离与其碱基对数量的倒数成正比,每组数据的r2均大于0988。发现0.5 μg/mL EB染色与对照组的标准曲线几乎平行,说明其线性关系的系数与对照组很接近,DNA在凝胶中迁移虽然发生了滞后,但迁移特性最接近对照组。10 000×GelRed、5 000×GelRed前染色组的标准曲线与对照组倾斜角度并不一致,说明其线性关系的系数与对照组有差别,其迁移特性与对照组也有所不同,但是GelRed浓度对其迁移特性的影响不大。综上所述,认为EB、GelRed结合DNA后使DNA迁移产生滞后,但是EB染色产生的迁移滞后对于目的基因的判读未产生明显影响,而GelRed略有影响。
3 討论
随着分子生物学及化学合成技术的发展,一些新型的核酸染色剂给人们的技术手段带来了很大的突破,Molecular Probes公司开发了SYBR系列的产品,该系列目前有4款产品,SYBR Green I 结合双链DNA能力很强,检测微量双链DNA的能力优于其他核酸染色剂[10],能特异性地结合双链DNA而对单链DNA的结合能力大大减弱,这一特点可使SYBR Green I作为实时定量PCR染色剂,另外有文献报道SYBR Green I有碱基亲和特异性[11],而这种亲和特异性表现在琼脂糖凝胶电泳中会造成AT碱基含量较高DNA片段的电泳偏差[12]。SYBR Green Ⅱ作为一款新型核酸染色剂可以特异性结合RNA和单链DNA,可以弥补SYBR Green I结合RNA及单链DNA的能力弱的特性,SYBR safe与SYBR gold可以结合双链DNA、单链DNA以及RNA,具有检测能力高、安全、稳定的特点,SYBR Green Ⅱ与SYBR gold在Ames试验中显示不具有致突变性[13]。PicoGreen作为一款核酸定量的染色剂可以对双链DNA精准定量,最小检测25 pg的痕量双链DNA,不易受到单链DNA及RNA的干扰,比传统方法更精确[14]。GelRed作为一种新型的核酸染色剂可以结合双链DNA、单链DNA及RNA,但对于双链DNA的结合能力强于单链DNA及RNA,可用于琼脂糖凝胶和聚丙烯酰胺凝胶染色,染色后荧光效果优于EB,对较小片段的DNA的检测能力尤为突出,具有和EB相同的光谱范围,另外无毒、对环境安全、废胶及废液可直接排放而无需特殊处理等诸多优势使得越来越多的科研机构采用了这种新型的核酸染色剂。在使用方面,GelRed后染色要比前染色更加灵敏,且DNA迁移不受染色剂的影响,对目的基因的判读准确,但是用量较大;前染色具有操作简便,不需单独染色以及节约用量等优点,但DNA结合染色剂会产生迁移滞后。在凝胶回收方面,GelRed结合DNA后易被乙醇洗脱,因此DNA可以回收用于下游试验[15]。综上,如果需要较为精确鉴定目的基因片段大小可以选择后染色或者EB前染色,如果对鉴定目的基因片段大小要求不高,不具备生物污染处理系统或者鉴定含量较低的目的基因片段的科研机构可以选择GelRed。
参考文献
[1] LEE P Y,COSTUMBRADO J,HSU C Y,et al.Agarose gel electrophoresis for the separation of DNA fragments[J].Journal of visualized experiments,2012,62:172-173.
[2] SINGER V L,LAWLOR T E,YUE S,et al.Comparison of SYBR Green I nucleic acid gel stain mutagenicity and ethidium bromide mutagenicity in the Salmonella/mammalian microsome reverse mutation assay(Ames test)[J].Mutation research,1999,439(1):37-47.
[3] WARING M J.Complex formation between ethidium bromide and nucleic acids[J].Journal of molecular biology,1965,13(1):269-282.
[4] STELLWAGEN N C.Effect of the electric field on the apparent mobility of large DNA fragments in agarose gels[J].Biopolymers,1985,24(12):2243-2255.
[5] LERMAN L S,FRISCH H L.Why does the electrophoretic mobility of DNA in gels vary with the length of the molecule?[J].Biopolymers,1982,21(5):995-997.
[6] LUMPKIN O J,DJARDIN P,ZIMM B H.Theory of gel electrophoresis of DNA[J].Biopolymers,1985,24(8):1573-1593.
[7] BORST P.Ethidium DNA agarose gel electrophoresis:How it started[J].IUBMB Life,2005,57(11):745-747.
[8] SIGMON J,LARCOM L L.The effect of ethidium bromide on mobility of DNA fragments in agarose gel electrophoresis[J].Electrophoresis,1996,17(10):1524-1527.
[9] SLATER G W.DNA gel electrophoresis:The reptation model(s)[J].Electrophoresis,2009,30:181-187.
[10] HUANG Q,FU W L.Comparative analysis of the DNA staining efficiencies of different fluorescent dyes in preparative agarose gel electrophoresis[J].Clinical chemistry & laboratory medicine,2005,43(8):841-842.
[11] ZIPPER H,BRUNNER H,BERNHAGEN J,et al. Investigations on DNA intercalation and surface binding by SYBR Green I,its structure determination and methodological implications[J].Nucleic acids research,2004,32(12):1-10.
[12] KONSCHAK R,TINHOFER I.Prestaining of PCR products with SYBR Green for agarose gel electrophoresis:Advantages and limitations[J].Clinical chemistry and laboratory medicine,2011,49(6):1069-1071.
[13] KIRSANOV K I,LESOVAYA E A,YAKUBOV SKAYA M G,et al.SYBR Gold and SYBR Green II are not mutagenic in the Ames test[J].Mutation research,2010,699:1-4.
[14] LI X F,WU Y H,ZHANG L,et al.Comparison of three common DNA concentration measurement methods[J].Analytical biochemistry,2014,451:18-24.
[15] HUANG Q,BAUM L,FU W L.Simple and practical staining of DNA with GelRed in agarose gel electrophoresis[J].Clinical laboratory,2010,56(3/4):149-152.
