乙醇熏蒸对采后甜樱桃的保鲜效果
2020-04-01杨晓哲1胡文忠姜爱丽修志龙1姬亚茹1杨香艳蒋海峰
杨晓哲1,3,胡文忠,*,姜爱丽,修志龙1,姬亚茹1,3,杨香艳,蒋海峰
(1.大连理工大学生物工程学院,辽宁大连 116024;2.大连民族大学生命科学学院,辽宁大连 116600;3.生物技术与资源利用教育部重点实验室,辽宁大连 116600)
甜樱桃(sweet cherry)果实颜色艳丽,酸甜可口,含有丰富的营养物质,富含蔗糖、葡萄糖和山梨醇,且苹果酸、柠檬酸、莽草酸和富马酸等有机酸含量比较高[1]。具有多种保健功能[2-3],因其铁的含量非常丰富,还具有促进血红蛋白再生、抗贫血的功效,因此,甜樱桃被称为“超级保健水果”[4]。甜樱桃皮薄多汁,组织柔软,并且收获季节的温度和湿度比较高,极易受到病原菌的侵染而导致腐烂[5],从而使甜樱桃的贮藏和加工成为一个难题。现有的保鲜技术由于在某些方面的局限性已不能满足对甜樱桃保鲜的需要[6]。因此,从采后甜樱桃病害、生理生化及品质等角度出发,研究安全有效的保鲜技术具有重大意义。
据报道,每年甜樱桃果实因采后病害引起的腐烂损耗占总产量的25%~50%[7]。甜樱桃最容易感染和最难防治的病虫害主要有灰霉病、褐腐病、病毒病、流胶病等[8],目前研究多集中在真菌性病害如青霉病(Penicilliumexpansum)、灰霉病(Botrytiscinerea)、软腐病(Rhizopussp.)、褐腐病(Moniliniafructicola)、绿腐病(Cladosporiumherbarum)、交链孢霉腐病(Altematalternata)[9]。目前,国内外在甜樱桃采后病害防治和贮藏保鲜方面采用的技术手段主要有低温贮藏[10]、气调贮藏[11]、高压脉冲电场杀菌[12]、辐照杀菌[13]等物理保鲜技术;二氧化氯浸泡、氯化钙[14]等化学方法保鲜;拮抗菌[15]等生物保鲜技术等。
乙醇作为果蔬自身的代谢产物,具有很强的杀菌作用,已被美国FDA认证为是安全物质(GRAS)[16]。研究表明,300 μL/L的乙醇有效控制了采后枇杷炭疽病(anthracnose rot)的发生[17]。近几年,乙醇在葡萄[18]、甜瓜[19]、腰果梨[20]等果蔬的保鲜上都取得了显著的效果。Wang等[21]利用250、500 μL/L乙醇蒸汽结合热空气的手段对杨梅采后病害进行控制,研究发现500 μL/L浓度的乙醇结合热空气处理有效抑制了杨梅采后由杨梅轮帚霉(Verticicladiellaabietina)、桔青霉(Penicilliumcitrinum)和绿色木霉(Trichodermaviride)引起的病害。乙醇在不同类型果实的保鲜应用上存在差异,目前,国内外关于乙醇对采后甜樱桃果实灰霉病的控制及其生理代谢与品质的影响还鲜有报道,为此,本研究以新鲜甜樱桃(萨米脱,summit)为试验材料,用不同浓度乙醇进行熏蒸处理,探讨乙醇对甜樱桃采后灰霉病的控制及品质的影响,旨在为甜樱桃贮藏保鲜提供理论与应用依据。
1 材料与方法
1.1 材料与仪器
实验用甜樱桃品种为“萨米脱(summit)”,采自大连市金州区甜樱桃园,选取无机械损伤和病虫害、成熟度一致(九成熟)的果实,采后立即运回实验室,在0~4 ℃下预冷24 h后备用;马铃薯葡萄糖琼脂(PDA) 北京奥博星生物技术有限责任公司;吐温-80 天津市津南区咸水沽工业园区;无水乙醇、磷酸二氢钠、磷酸氢二钠、聚乙烯吡咯烷酮、邻苯二酚、氢氧化钠、草酸、抗坏血酸、2,6-二氯酚靛酚、邻苯二甲酸氢钾(分析纯) 上海国药集团。
AL240型精密电子天平 梅特勒-托利多仪器上海有限公司;Lamda-25 紫外可见分光光度计UV-9200 北京瑞利分析仪器有限公司;美国PEGC-2010型气相色谱仪 日本岛津公司;BR4i型台式高速冷冻离心机 法国Jouan公司;GY-I型果实硬度计 上海梅特勒-托利多有限公司;T25型匀浆机 德国IKA公司;SIM F140-型制冰机 日本三洋有限公司;电热恒温水浴锅 上海精宏实验设备有限公司;TA. XT Plus型质构仪 英国SMSTA公司。
1.2 实验方法
1.2.1 灰霉菌孢子悬液的制备 试验中所使用的灰霉菌(Botrytiscinerea)是本实验室前期从腐烂的甜樱桃果实中分离纯化并鉴定获得的。使用前,在马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)上于25 ℃下活化培养5 d,借助血球计数板计数,用体积分数为0.05%的吐温-80调整至3×106cfu/mL的孢子悬浮液,备用。
1.2.2 乙醇熏蒸对灰霉菌的体外试验 用已灭菌的PDA培养基制作平板,每板15~20 mL,待培养基完全凝固后,用无菌打孔器在平板中央打取直径6 mm的孔,注入已制备好的孢子悬浮液20 μL。在培养皿盖子上放置一片无菌的直径为6 mm的滤纸。分别取一定体积(15.75、31.50、63.00 μL)的无水乙醇滴于滤纸片上,以不加乙醇的滤纸片的平板为对照,使体积为63 mL平板(90 mm×10 mm)内的乙醇浓度分别为0、250、500、1000 μL/L(v/v),将平板用封口膜密封,于25 ℃培养箱中培养3 d后观察抑菌效果并测量菌斑直径。
1.2.3 乙醇熏蒸对甜樱桃人工接种灰霉菌的体内试验 将已挑选好的新鲜甜樱桃(约12 kg)洗净并在2%的次氯酸钠溶液中浸泡1 min,用自来水冲洗后晾干。然后用灭菌牙签在甜樱桃果实赤道部位刺一个直径约2 mm,深约3 mm的孔,向孔中注入20 μL孢子浓度为3×106cfu/mL的菌悬液,于通风橱中晾干,置于密闭箱中,密闭箱内的乙醇浓度分别为0、250、500、1000 μL/L,于25 ℃下熏蒸12 h,然后通风30 min,并置于25 ℃下密封贮藏,每隔3 d观察病害情况。
1.2.4 乙醇熏蒸对新鲜甜樱桃果实生理生化和品质的影响 将未进行任何处理的新鲜甜樱桃直接放置于密闭箱中,每箱放置3 kg,密闭箱内的乙醇浓度分别为0、250、500、1000 μL/L,于4 ℃下熏蒸12 h,然后通风30 min,通风结束后于4 ℃密封贮藏,每隔3 d取样对生理生化指标进行测定。
1.3 指标测定方法
1.3.1 失重率和腐烂率 分别从实验组和对照组随机挑取15个甜樱桃,置于白色托盘中,并用保鲜膜包装,于4 ℃贮藏,每隔6 d进行失重率和腐烂率的测定,做3个重复。果实腐烂率(%)=(腐烂果实数/总果实数)×100。腐烂果实是指果实表面存在1/3破损或褐变现象或存在菌丝体生长现象的果实。
1.3.2 硬度、呼吸强度、可滴定酸 果实硬度采用手持GY-I型硬度计测定。设3个重复,每个重复测定10个果实。
利用气相色谱法测定呼吸强度,将200 g样品放在呼吸盒中静置1 h,用针抽取1 mL气体用GC-2010型气相色谱仪进行测定。检测器采用热传导检测器(TCD),色谱柱采用Alhech ctrl column,载气为氦气,流速3 mL/min,进样口和检测器温度均为120 ℃,柱温保持在30 ℃。

利用氢氧化钠滴定法测定样品中可滴定酸含量[22]。
1.3.3 PPO酶活 多酚氧化酶(Polyphenol oxidase,PPO)活性的测定参照杜小琴[23]的方法,略有修改。称取2.5 g样品,加入2.5 mL提取缓冲液,冰浴匀浆,于4 ℃、12000×g离心30 min,收集上清液,即酶提取液,低温保存备用。在3 mL 0.5 mol/L的邻苯二酚溶液的反应体系中加0.5 mL酶液,反应温度为25 ℃,加酶液5 s后开始扫描,记录10 s内OD398值的变化,重复3次。酶活性单位表示为ΔOD398/min·g。
1.3.4 POD酶活 过氧化物酶(Peroxidase,POD)活性的测定参照靳苗苗等[24]的方法,分别以每克果实每分钟在460 nm条件下吸光值变化1为1个酶活单位,结果以U/g表示,重复测定3次取平均值。
1.4 数据统计分析
所有指标均采用3个样品重复测定取平均值。采用SPSS 17.0进行数据处理分析,用邓肯多重比较方法进行差异显著性检验,0.05为显著水平。
2 结果与分析
2.1 不同浓度乙醇熏蒸对灰霉菌的体外抑制效果
如图1所示,当用0、250、500、1000 μL/L的乙醇对灰霉菌进行体外熏蒸实验时,随着乙醇浓度的增加,对平板上灰霉菌的抑制效果逐渐增强,接种培养3 d后,1000 μL/L浓度乙醇熏蒸处理组的抑菌效果显著高于其它三组(P<0.05)。培养至6 d后,对照组的菌丝基本长满平板,500和1000 μL/L处理组的抑制效果较好,但二者差异不显著(P>0.05)。这说明,乙醇熏蒸处理能有效地降低甜樱桃果实灰霉病的发病率,减缓病斑的扩展。

图1 不同浓度乙醇对灰霉菌的体外抑制效果(25 ℃)Fig.1 Inhibition of different concentrations of ethanol on Botrytis cinereal in vitro at 25 ℃
2.2 不同浓度乙醇熏蒸对灰霉菌的体内抑制效果
图2为不同浓度乙醇熏蒸对灰霉菌的体内抑制测试结果,通过对甜樱桃果实进行人工接种灰霉菌,于25 ℃条件下,贮藏4 d后的病害情况。从图中可以看出,0 μL/L(a)和250 μL/L(b)处理组的菌丝明显,菌斑直径在1 cm左右且差异不显著(P>0.05),500 μL/L处理组的病害情况不明显,菌斑直径只有0.5 cm左右,1000 μL/L处理组几乎没有发生病害,实验结果表明,随着乙醇浓度的增加,对病害甜樱桃上灰霉菌的抑制效果增强。

图2 25 ℃下不同浓度乙醇对灰霉菌的体内抑制效果Fig.2 Inhibition of different concentrations of ethanol on Botrytis cinereal in vivo at 25 ℃注:a:0 μL/L;b:250 μL/L;c:500 μL/L;d:1000 μL/L。
2.3 不同浓度乙醇熏蒸处理对甜樱桃果实呼吸强度的影响
呼吸强度是衡量果实成熟衰老速度、生理代谢速率及保鲜效果的一个重要指标。由图3可以看出,贮藏期间,所有处理组的呼吸强度呈先上升后下降的趋势,500 μL/L处理组的果实在第6 d出现呼吸峰,而后呈迅速下降趋势,下降速率最快(P<0.05),18 d后又有所升高,分析原因可能是后期出现腐烂现象导致的。对照组在第12 d出现呼吸高峰,12 d后有所下降,但下降趋势不明显,且整个贮藏期间对照组果实的呼吸强度始终最大,第12 d时与三个处理组的差异显著(P<0.05),其中与500 μL/L处理组的差异最大(P<0.01)。24 d时,对照组与250、1000 μL/L处理组的呼吸强度相差不大(P>0.05)。结果表明,乙醇熏蒸处理能够抑制甜樱桃果实贮藏期间的呼吸强度,且500 μL/L的乙醇抑制效果最显著。乙醇抑制呼吸强度可能是通过抑制乙烯的生物合成,从而影响乙烯诱导的呼吸升高;也可能是通过抑制线粒体功能和相关酶活性的原因[25]。这在乙醇处理的鲜切莲藕[26]和甜瓜[27]中已经得到证实。
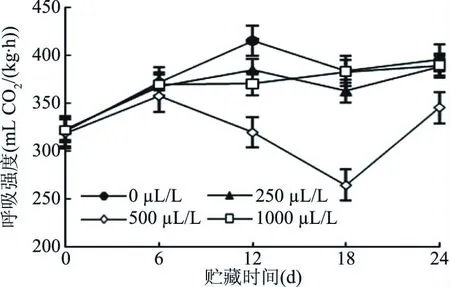
图3 不同浓度乙醇处理对甜樱桃果实呼吸强度的影响Fig.3 Effects of different concentrations of ethanol on respiration of sweet cherry
2.4 不同浓度乙醇熏蒸处理对甜樱桃果实硬度的影响
果实硬度能够直接反映果实的贮藏效果和果实软化程度,是衡量果实品质的重要指标之一[28]。如图4所示,各组果实的硬度均随贮藏时间的延长而下降,其中0 μL/L处理组果实的硬度始终最低,且下降速率比处理组大,差异显著(P<0.05)。从第6 d开始,500 μL/L处理的果实硬度始终最高,与250、1000 μL/L两个处理组的差异显著(P<0.05),而250和1000 μL/L处理组的硬度相差不显著(P>0.05)。据报道,当果实的细胞膜与乙醇相互作用时,细胞膜的透水性降低,对维持果实的硬度起到了重要的作用[29];也可能与抑制细胞壁降解相关酶(多聚半乳糖醛酸酶、纤维素酶、果胶甲酯酶和β-半乳糖苷酶)的活性有关[30]。
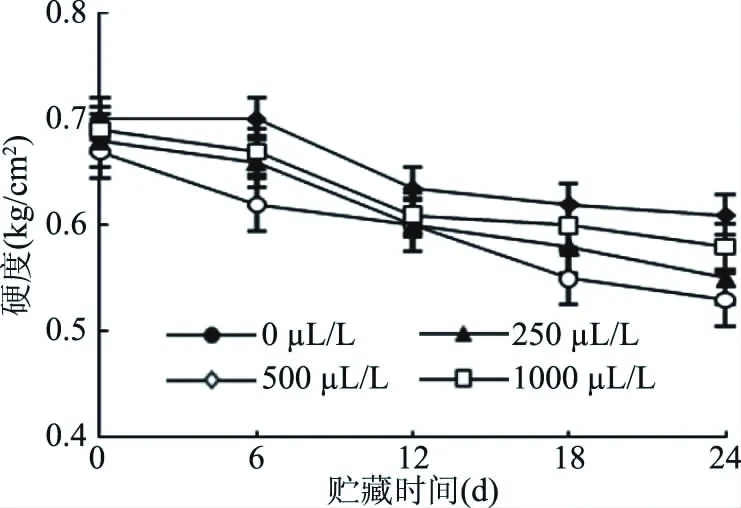
图4 不同浓度乙醇处理对甜樱桃果实硬度的影响Fig.4 Effects of different concentrations of ethanol on the hardness of sweet cherry
2.5 不同浓度乙醇熏蒸处理对甜樱桃果实失重率和腐烂率的影响
贮藏期间的新鲜果蔬,极易发生水分散失,导致果实软化和萎蔫,从而加速果蔬的衰老。因此,寻找有效的保鲜技术抑制果蔬贮藏过程中自身水分的过度散失,越来越成为保鲜研究的热点[31]。由图5(a)可以看出,随着贮藏时间的延长,各个处理组甜樱桃果实的失重率均呈上升趋势,在整个贮藏过程中,500 μL/L处理组的失重率始终低于其它组,贮藏24 d后,500 μL/L处理组的失重率与其它组的差异极显著(P<0.01),而0、250、1000 μL/L三个处理组的失重率相当,差异不显著(P>0.05)。因此,500 μL/L的乙醇熏蒸处理可以更好地抑制甜樱桃果实水分的散失,保持更高的新鲜度。同样,类似的实验结果在枇杷上得到验证,2 mL/kg乙醇能够保持枇杷较高的出汁率[32]。这可能是由于一定浓度的乙醇作为脂肪醇溶解在膜脂双层中,增强细胞膜的稳定性和疏水性;也可能是由于乙醇使细胞保持较高的渗透压,阻碍水分向细胞壁和细胞间隙渗透,从而降低失重[33]。
腐烂率是评价果实贮藏效果的主要指标。腐烂率以甜樱桃果实表面发生汁液外漏、长菌或腐烂现象作为判别依据。0、250 μL/L处理组从12 d开始发生腐烂,二者在24 d时的腐烂率差异不显著(P>0.05)。对照组的腐烂率始终高于处理组,500、1000 μL/L处理组从18 d开始出现腐烂现象,且500 μL/L处理组的腐烂率最低,与其它组的差异显著(P<0.05)。Dong等[34]通过研究不同浓度乙醇(400、600、1000 μL/L)熏蒸对马铃薯保鲜效果的影响,发现当乙醇浓度超过600 μL/L时,会导致马铃薯的腐烂;同样,类似的实验结果也在其它果蔬上得到验证,高浓度乙醇加速了枇杷果实的腐烂,正是由于过量的乙醇对果实细胞产生毒害加速衰老腐烂的结果[35]。
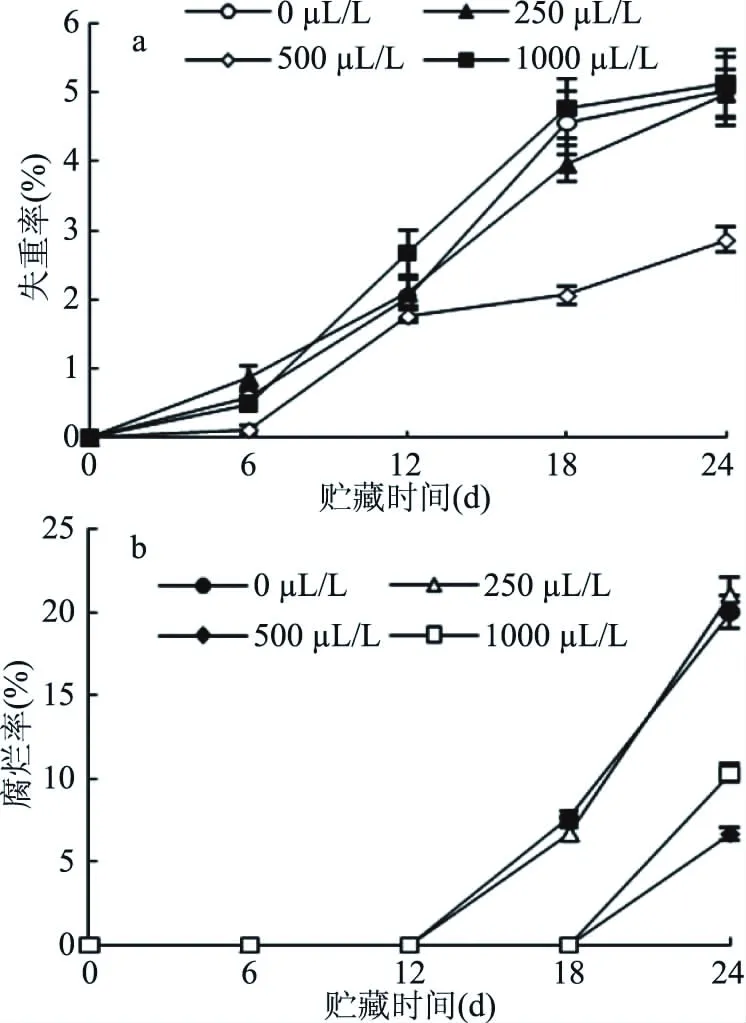
图5 不同浓度乙醇处理对甜樱桃果实失重率(a)和腐烂率(b)的影响Fig.5 Effects of different concentrations of ethanol on weight loss rate(a)and decay rate(b)of sweet cherry
2.6 不同浓度乙醇熏蒸处理对甜樱桃果实可滴定酸含量的影响
果实在贮藏过程中为了维持正常的呼吸作用,需要消耗糖、酸等有机物,可滴定酸含量的变化反映了果肉细胞内营养物质的消耗速率和程度,且可滴定酸的含量与果实的风味有很大的关联性,因此,可滴定酸含量是衡量果实采后风味变化和保鲜效果的重要指标之一[36]。如图6所示,在整个贮藏过程中,可滴定酸含量呈逐渐下降趋势,总体上看,500 μL/L处理组的下降趋势最缓慢,贮藏24 d后,500 μL/L处理组的可滴定酸含量是0 μL/L处理组的1.24倍,分别是其它两个处理组的1倍。结果说明乙醇熏蒸可以延缓甜樱桃可滴定酸含量的下降,且500 μL/L浓度乙醇处理的效果最显著(P<0.05)。
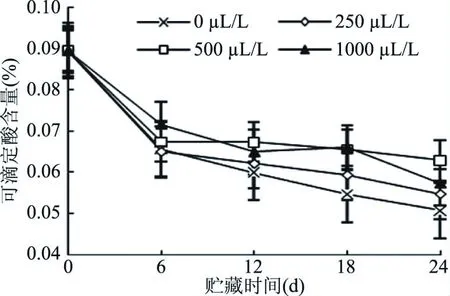
图6 不同浓度乙醇处理对甜樱桃果实可滴定酸含量的影响Fig.6 Effects of different concentrations of ethanol on titratable acid content of sweet cherry
2.7 不同浓度乙醇熏蒸处理对甜樱桃果实PPO活性的影响
多酚氧化酶(PPO)与果蔬的褐变有着直接的联系,酶褐变现象是果蔬中的酚类化合物被多酚氧化酶催化氧化后,经一系列的聚合反应生成色素的过程。多酚氧化酶的含量是衡量果实成熟的指标之一[37]。果肉组织中的PPO存在结合态(BPPO)和可溶态(FPPO),果实在贮藏过程中,由于各种原因会造成组织细胞的伤害,导致BPPO向FPPO转变,并且因果肉组织细胞膜降解使体内原本分离的FPPO氧化酶系统与酚类物质作用,形成醌类物质,并进一步聚合成褐色产物,严重影响着果实的营养、风味及外观品质[38]。
由图7可知,经不同浓度乙醇熏蒸处理后,贮藏过程中甜樱桃果实的PPO活性呈先升高后下降的趋势,在贮藏的第12 d,各组PPO活性达到峰值,其中0 μL/L处理组的峰值最大,500 μL/L处理组的峰值最小,二者差异显著(P<0.05),而0 μL/ L处理组与250、1000 μL/L处理组的相差不大(P>0.05)。贮藏12 d后,各组的PPO活性开始下降,其中0 μL/ L处理组的下降速率最慢,500 μL/L处理组的PPO活性一直处于最低状态,且与其它各组的差异显著(P<0.05)。以上结果表明,乙醇熏蒸处理可以降低甜樱桃果实贮藏过程中的PPO活性,但乙醇浓度不同,抑制效果也存在一定的差异,500 μL/L的抑制效果最佳,该结果与郭禹等的结果一致[39]。
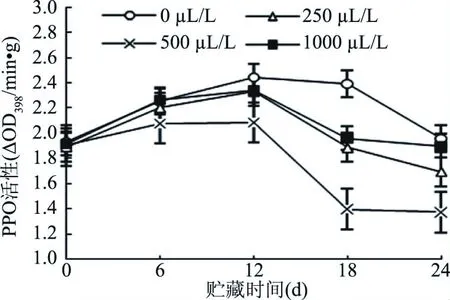
图7 不同浓度乙醇处理对甜樱桃果实PPO活性的影响Fig.7 Effects of different concentrations of ethanol on the PPO activity of sweet cherry
2.8 不同浓度乙醇熏蒸处理对甜樱桃果实POD活性的影响
POD能够催化水和有机过氧化物对植物细胞内多种有机物和无机物的氧化分解作用。POD活性的升高,既能够有效地清除内源活性氧自由基,还有利于植物木质素和植保素的合成。图8表明,整个贮藏期间,各乙醇处理组甜樱桃果实POD活性均呈先上升后下降的趋势,250、500、1000 μL/L处理组果实的POD活性始终高于0 μL/ L处理组,其中500 μL/L处理组的POD活性显著高于其他组(P<0.05),且在贮藏第12 d出现一次活性高峰。在贮藏前期,随着贮藏时间的延长,由于甜樱桃果实逐渐衰老导致代谢产生的自由基逐渐增多,诱导了果实POD活性的增强;贮藏后期,由于果实本身抗氧化性增强,能清除自身的自由基,POD激发活性而呈下降趋势[40]。
从甜樱桃果实POD活性的变化来看,乙醇处理在一定程度上刺激POD活性增加,可能是因为乙醇处理过程中快速积累了过氧化物,诱导机体抗性体系的增强,提高了POD活性,加强保护系统清除自由基的能力,有助于克服膜脂过氧化现象[41]。试验结果表明,500 μL/L乙醇处理有增强果实POD活性的作用,确保组织免受活性氧的伤害,同时延缓果实在贮藏过程中的衰老进程。
且乙醇熏蒸处理能维持甜樱桃的POD活性,有利于减缓果实衰老的速度。由图8可知,在贮藏过程中,甜樱桃果实中的POD活性整体呈现下降趋势,500 μL/L乙醇处理组的POD活性在第12 d时出现峰值,0 μL/ L处理组POD活性下降速度最快。
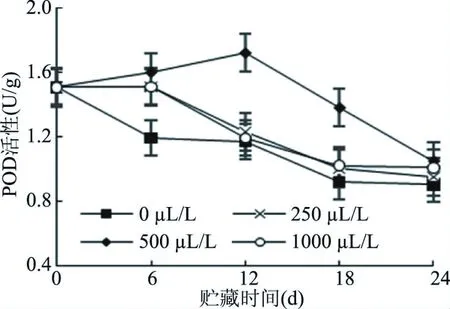
图8 不同浓度乙醇处理对甜樱桃果实POD活性的影响Fig.8 Effects of different concentrations of ethanol on POD activity of sweet cherry
3 结论
乙醇作为一种安全无毒、绿色无污染、添加量不受限制的食品保鲜物质,其保鲜效果已在多种水果和蔬菜上得到了证明。国内外已有大量研究表明,乙醇熏蒸可以抑制果蔬采后成熟衰老、延长寿命,降低果蔬采后贮藏过程中的呼吸速率,使微生物的活动受到抑制。本研究中发现,乙醇熏蒸对甜樱桃具有一定的保鲜效果,且乙醇浓度不同,保鲜效果也存在差异,其中500 μL/L浓度的乙醇对甜樱桃的保鲜效果最显著,能够延缓甜樱桃果实软化的进程,延缓水分的散失,抑制呼吸作用,维持较高的硬度和可滴定酸含量,且使贮藏过程中的PPO活性处于最低,减缓褐变程度;乙醇熏蒸处理可以防止甜樱桃灰霉病的发生,且从体内和体外熏蒸实验结果可以得出,1000 μL/L浓度的乙醇抑菌效果最好,但对果实品质影响较大。综上所述,乙醇熏蒸处理能够减少采后甜樱桃的腐烂变质,延缓果实衰老进程,提高抗病性,从而保持果实的品质,其中以500 μL/L的乙醇处理效果最佳。
